
导读:
疏水性药物在水性环境中的溶解度差,限制了它们的生物利用度和治疗效果。近期,有研究人员开发了一种基于微流控技术的溶剂萃取共固化方法,成功制备出四种不同形态的核壳结构载药微胶囊,用于改善疏水性药物环孢素A的释放性能。相关研究以“Microfluidic generation of drug-loaded polymer microcapsules with modulated core–shell morphologies and drug release profiles”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究提出一种微流控辅助的溶剂萃取共固化策略,用于制备形态可调的载药聚合物微胶囊(SMDMs),以改善疏水性药物环孢素A(CsA)的释放性能。
2、通过调控微流控系统中两相流速,单乳液液滴经溶剂扩散诱导相分离形成核壳结构,成功生成四种形态的微胶囊(球形、环形、双凹形、凹形)。
3、微胶囊尺寸均一(90–110 μm,变异系数<2.5%),载药效率≥94%,载药量达16.6%。
4、实验表明,不同形态微胶囊的释放曲线显著差异:环形和双凹形微胶囊在18小时内实现近完全释放,球形和凹形释放较慢但仍优于未包载的CsA原料药(30小时仅释放1.8%)。
5、该技术通过形态调控优化药物扩散路径,避免了突释现象,且无需化学修饰,为疏水性药物的短周期控释(如眼科给药)提供了新方案。
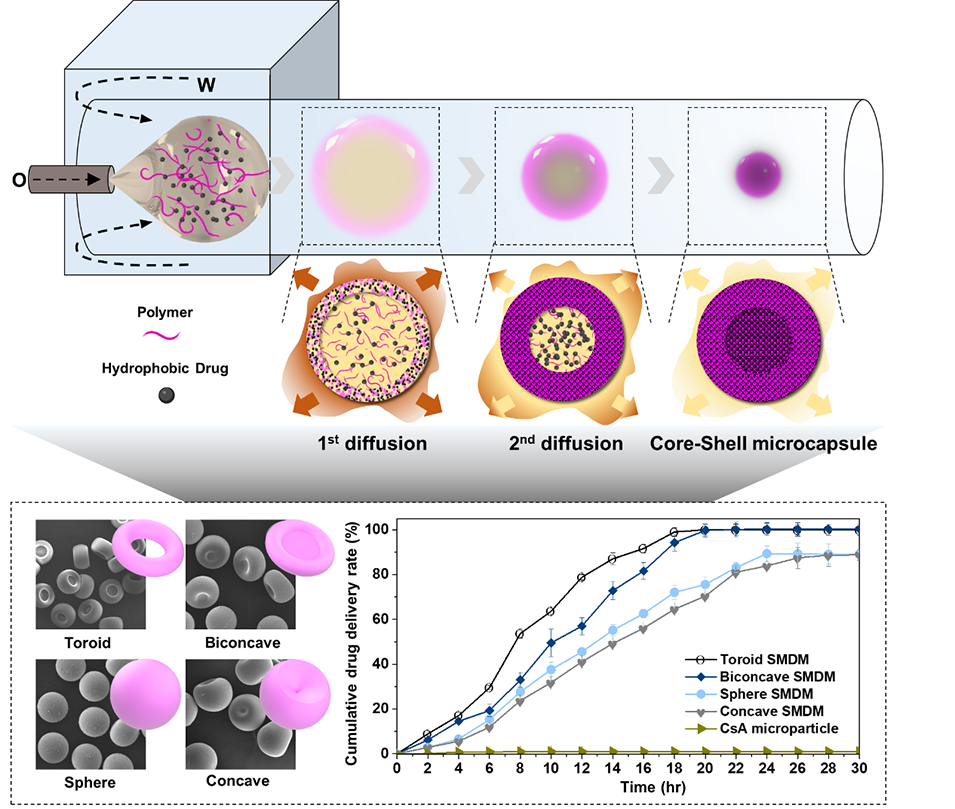
微流控技术制备SMDMs的具体步骤如下:
1、材料配制:将疏水性药物(CsA)与两亲性共聚物P(MMA-MAA)溶解于复合溶剂(EA-THF,体积比50%),形成均质分散相。
2、微流控乳化:
装置构建:采用管中管式流动聚焦微流控芯片(34G针头插入玻璃毛细管),分散相(含药溶液)与连续相(含7% Pluronic F-127的水溶液)分别以5–20 μL/min和100–600 μL/min流速注入。
单乳液生成:两相剪切形成单分散O/W乳液液滴(初始直径约360 μm)。
3、溶剂萃取与形态调控:
扩散诱导相分离:THF(快扩散)优先从液滴表面逸出,触发P(MMA-MAA)在界面固化形成壳层;EA(慢扩散)持续内迁,形成核壳结构。
流速调控变形:通过调节两相流速(如低分散相流速+高连续相流速生成环形),利用通道内抛物线流速分布和内部涡流诱导液滴变形。
4、后处理:收集乳液后经水洗、冻干,获得最终微胶囊(尺寸收缩约7%)。
P(MMA-MAA)在制备SMDMs中起到以下关键作用:
1、核壳结构形成的关键载体
P(MMA-MAA)在THF(快扩散)和EA(慢扩散)复合溶剂中表现出差异溶解度(高溶于THF,低溶于EA)。在微流控过程中,THF优先从液滴表面扩散至水相,触发P(MMA-MAA)在界面快速固化形成致密壳层,EA的缓慢迁移则促进了内部药物与聚合物的共固化,形成核心结构。
P(MMA-MAA)的高分子链通过物理交联形成刚性壳层(厚度约19 μm,CV 4.2%),保护药物免受外界环境(如酶或pH)侵蚀。
2、药物负载与均匀分布的调控者
P(MMA-MAA)的羧基(-COOH)与CsA的胺基(-NH)形成氢键,抑制药物分子聚集,确保CsA在微胶囊内均匀分布(荧光标记显示均质信号)。
P(MMA-MAA)的两亲性(亲水羧基与疏水甲基丙烯酸酯链段)增强与疏水性CsA的相容性,实现高载药效率(≥94%)。
3、形态调控的流体力学响应介质
P(MMA-MAA)的固化速率受溶剂扩散速率(THF/EA比例)和流速影响。例如,低分散相流速(5 μL/min)下,快速固化导致液滴在微通道内受剪切力变形为环形结构;而高流速下,固化延迟则会形成球形或凹形。
P(MMA-MAA)的黏弹性在溶剂萃取过程中决定液滴的变形能力。高聚合物浓度(50 mg/mL)增强液滴抗剪切能力,维持形态稳定性。
4、药物释放行为的控制器
P(MMA-MAA)壳层的致密度和孔隙率直接影响药物扩散速率。例如,薄壳(70 v/v% EA条件)加速释放,而厚壳(40 v/v% EA)延缓释放。
P(MMA-MAA)的羧基可赋予微胶囊pH敏感性,未来可通过环境pH(如眼部炎症区域pH升高)动态控制药物释放。
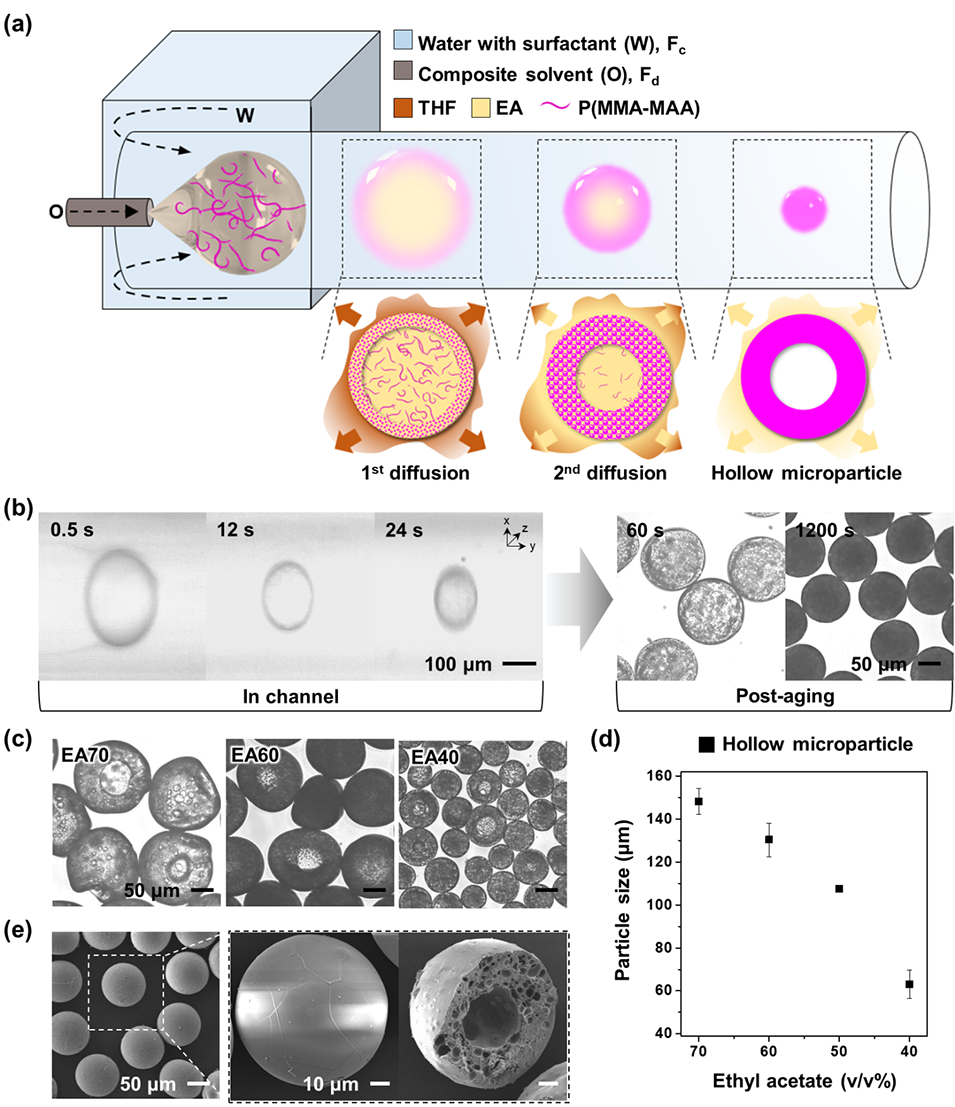
图1.聚合物中空微粒的制备。
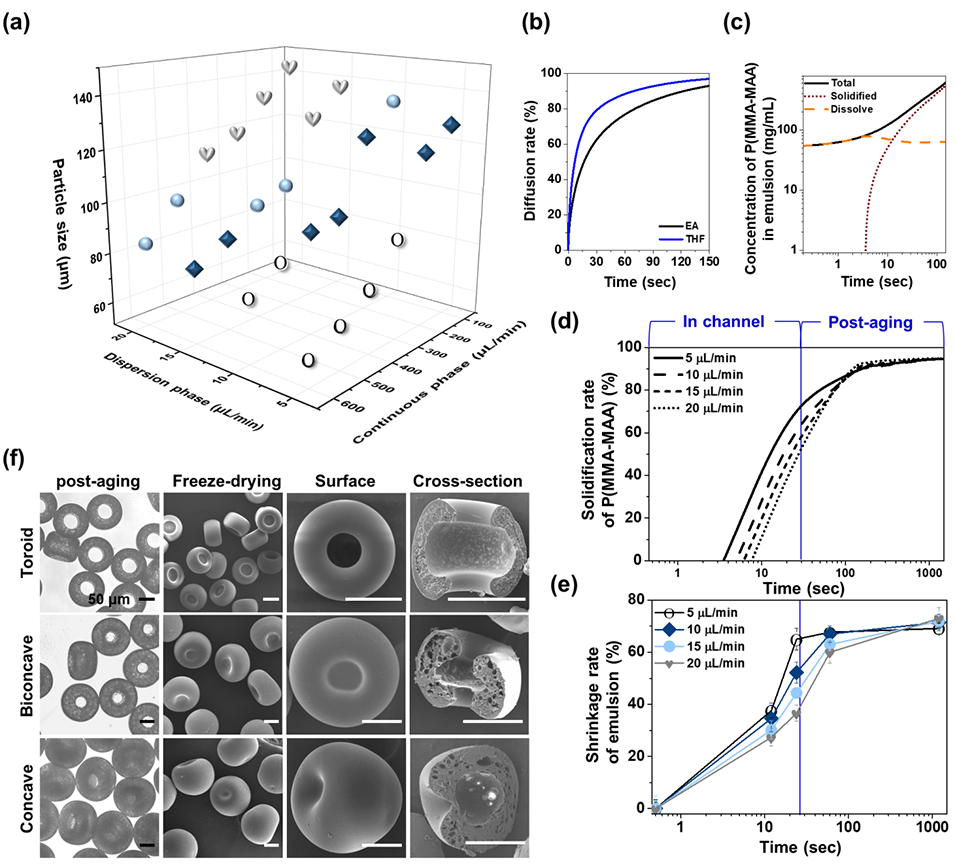
图2.非球形形态的中空P(MMA-MAA)微粒。
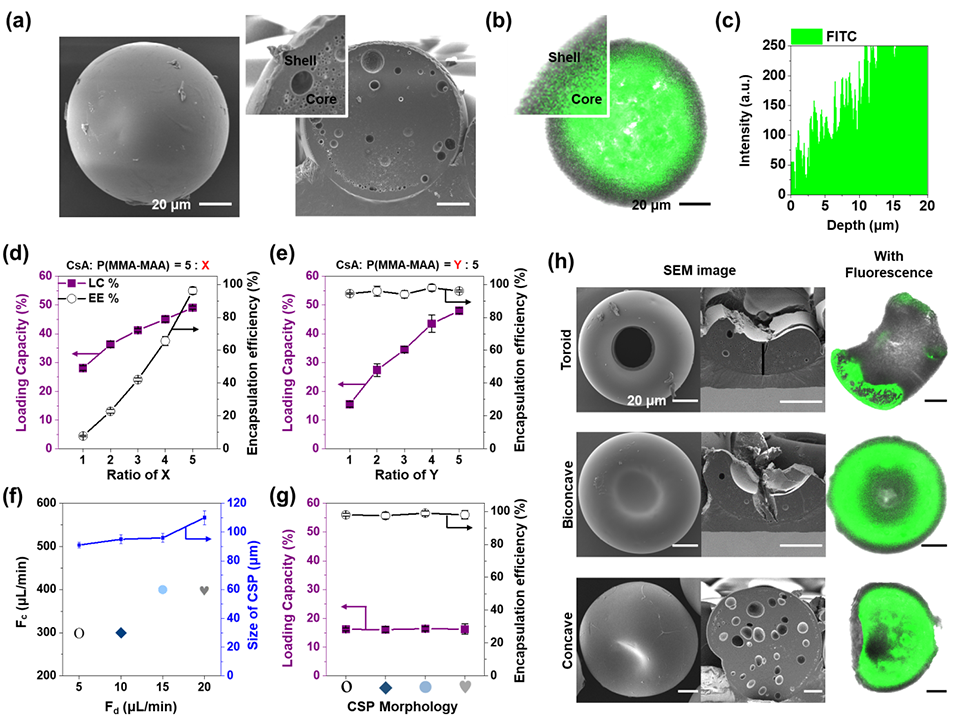
图3.载CsA的聚合物微胶囊的工程形态。
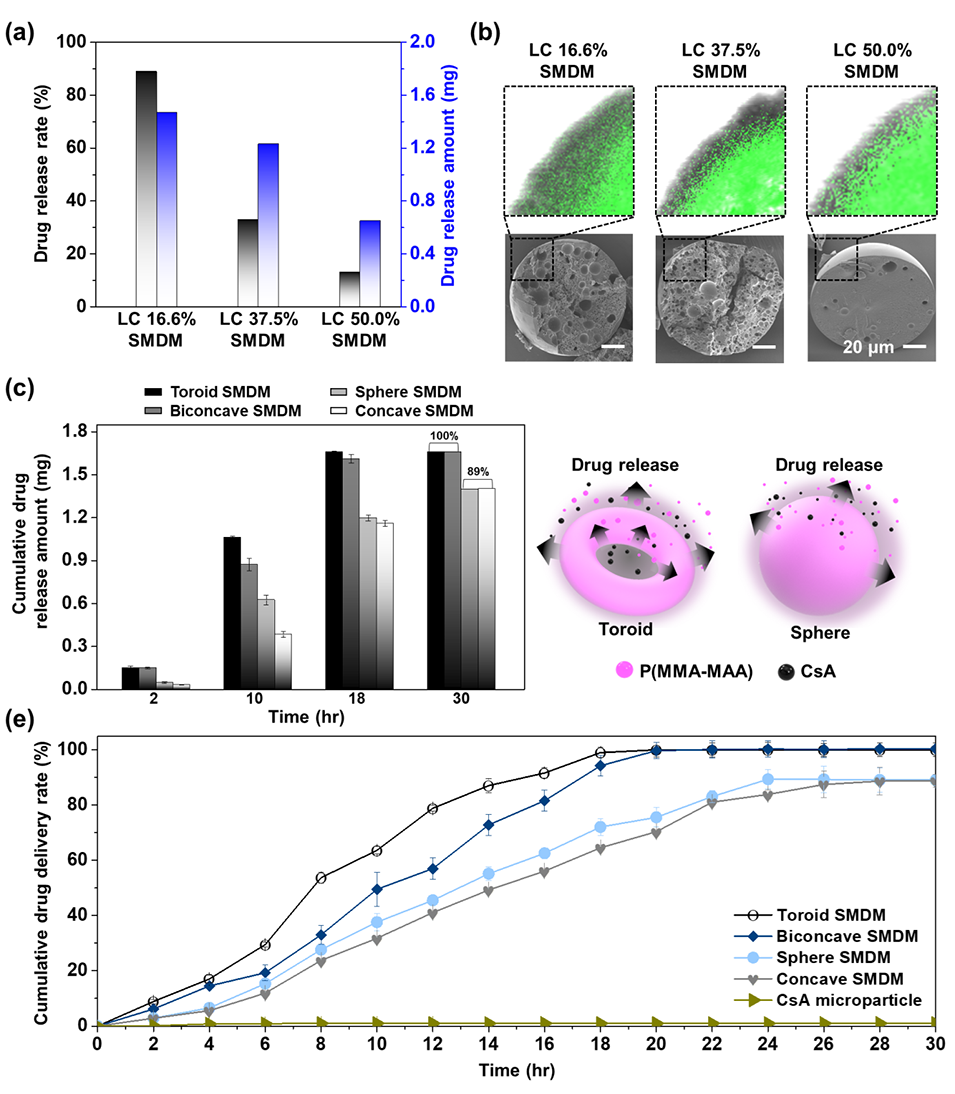
图4.不同形态CsA微胶囊的药物释放特性。
论文链接:https://doi.org/10.1016/j.cej.2025.163244














