
导读:
骨关节炎(OA)是全球致残的主要退行性关节疾病,现有抗氧化疗法因靶向性差、疗效短暂而受限。近期,南华大学附属长沙中心医院陈智毅教授团队创新性地利用微流控技术,将普鲁士蓝(PB)纳米酶与海藻酸盐-透明质酸(AlgHA)水凝胶微球结合,开发出可注射的AlgHA@PB平台。该平台通过同步清除活性氧(ROS)与持续供氧,显著延长关节内滞留时间,并展现出优异的抗氧化、抗炎与润滑协同效应,为OA治疗提供了长效、靶向的新策略。相关研究以“Microfluidic-engineering Prussian blue hydrogel microspheres for enhanced osteoarthritis antioxidant therapy”为题目,发表在期刊《Biomaterials Advances》上。
本文要点:
1、本研究通过微流控技术将普鲁士蓝(PB)纳米酶与海藻酸盐-透明质酸(AlgHA)水凝胶微球结合,构建了可注射的AlgHA@PB平台,兼具活性氧(ROS)清除与氧气生成功能。
2、水凝胶微球结构通过Fe3+离子交联实现PB的均匀分布,其低摩擦系数(保持在0.03以下)和机械稳定性可减少关节磨损。
3、体外实验表明,AlgHA@PB可完全清除细胞内ROS并持续释放氧气,显著保护软骨细胞免受H2O2损伤。
4、在大鼠OA模型中,AlgHA@PB表现出长期关节滞留(>7天),抑制软骨退化并降低炎症因子(IL-6、TNF-α)。
5、组织学分析显示其促进胶原II表达,降低MMP13活性,有效改善关节微环境。
6、该平台通过微流控技术实现规模化生产,为OA治疗提供了抗氧化、抗炎与生物力学相容性协同的多功能策略,具备临床转化潜力。
在本研究中,水凝胶微球的制备主要通过微流控技术结合离子交联与普鲁士蓝(PB)原位合成实现,具体步骤如下:
1、溶液配制:将海藻酸钠(Alg)与透明质酸(HA)按1:1比例溶于去离子水,形成2 wt%的聚合物溶液(AlgHA),并与8 wt%的EDTA-Fe3+混合作为分散相。
2、微流控液滴生成:将上述分散相通过微流控系统注入含有5 wt% Span 80的花生油(连续相),优化流速比以产生均匀的液滴。
3、交联固化:液滴在收集浴中固化为AlgHA/Fe3+微球,随后用1 wt% K4[Fe(CN)6]处理,使铁交联点处形成PB纳米颗粒。最后,用1 wt% CaCl2溶液稳定交联结构,得到AlgHA@PB微球。
4、纯化与干燥:用己烷和去离子水交替洗涤以去除残留油相,然后进行冷冻干燥,获得最终产物。
这种制备方法不仅实现了PB纳米酶在水凝胶微球中的均匀分布,还通过离子交联和微流控技术确保了微球的结构稳定性和功能完整性,为后续的实验和应用奠定了基础。
普鲁士蓝(PB)纳米酶的形成机理
1、化学反应基础
普鲁士蓝(Fe4[Fe(CN)6]3)的形成基于Fe3+与[Fe(CN)6]4-的配位反应,具体如下:
4Fe3++3[Fe(CN)6]4-→Fe4[Fe(CN)6]3
Fe3+来源:EDTA-Fe3+络合物缓慢释放Fe3+,避免局部浓度过高导致沉淀。
混合价态:部分Fe3+被[Fe(CN)6]4-还原为Fe2+,形成Fe2+/Fe3+共存的PB晶格,赋予其氧化还原活性。
2、纳米结构的控制
浓度调控:1 wt%K4[Fe(CN)6]提供适中的氰根浓度,平衡反应速率与颗粒分散性。
水凝胶限域:AlgHA网络通过空间位阻限制PB晶核生长方向,结合PVP表面活性剂吸附抑制聚集,形成均匀纳米颗粒(约175 nm)。
3、纳米酶功能来源
多酶活性:
类过氧化氢酶(CAT)活性:催化H2O2分解为H2O和O2,AlgHA@PB的O2生成速率是游离PB的1.5倍。
类超氧化物歧化酶(SOD)活性:清除超氧自由基(O2-),抑制氧化应激。
结构稳定性:
Fe3+与PB氰根的配位键起到固定纳米颗粒的作用
Ca2+与AlgHA羧基的离子交联增强了水凝胶机械强度,防止PB流失。
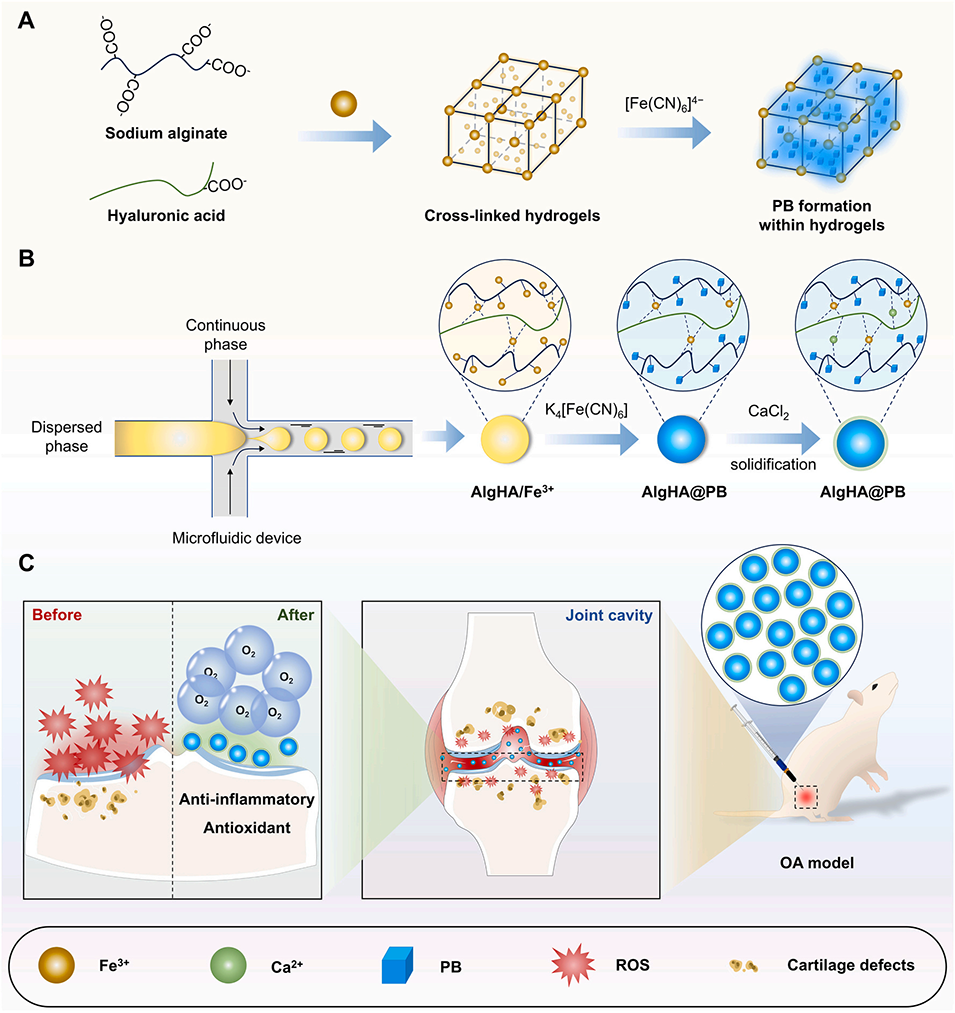
图1.AlgHA@PB的构建及其在骨关节炎抗氧化治疗中的应用示意图。(A)水凝胶内PB结构形成的原理。(B)使用微流体系统合成AlgHA@PB。(C)AlgHA@PB注射到OA关节中的反应过程。

图2.PB、AlgHA/Fe3+和AlgHA@PB的表征。(A)通过微流控芯片合成AlgHA@PB的示意图。(B)AlgHA/Fe3+(i,ii)和(C)AlgHA@PB((iii,iv)的图像。(左:比例尺=200μm,右:比例尺=50μm)(D,E)AlgHA/Fe3+和AlgHA@PB尺寸的统计分析。(F,G)AlgHA/Fe3+、AlgHA@PB和PB的SEM图像。(左:比例尺=10μm,中:比例尺=2μm,右:比例尺=1μm)(H)AlgHA@PB的元素分布图。(比例尺=50μm)(I)PB和AlgHA@PB的紫外吸收光谱。(J)AlgHA、AlgHA/Fe3+、PB和AlgHA@PB的傅里叶变换红外光谱。(K)PB和AlgHA@PB的摩擦系数。
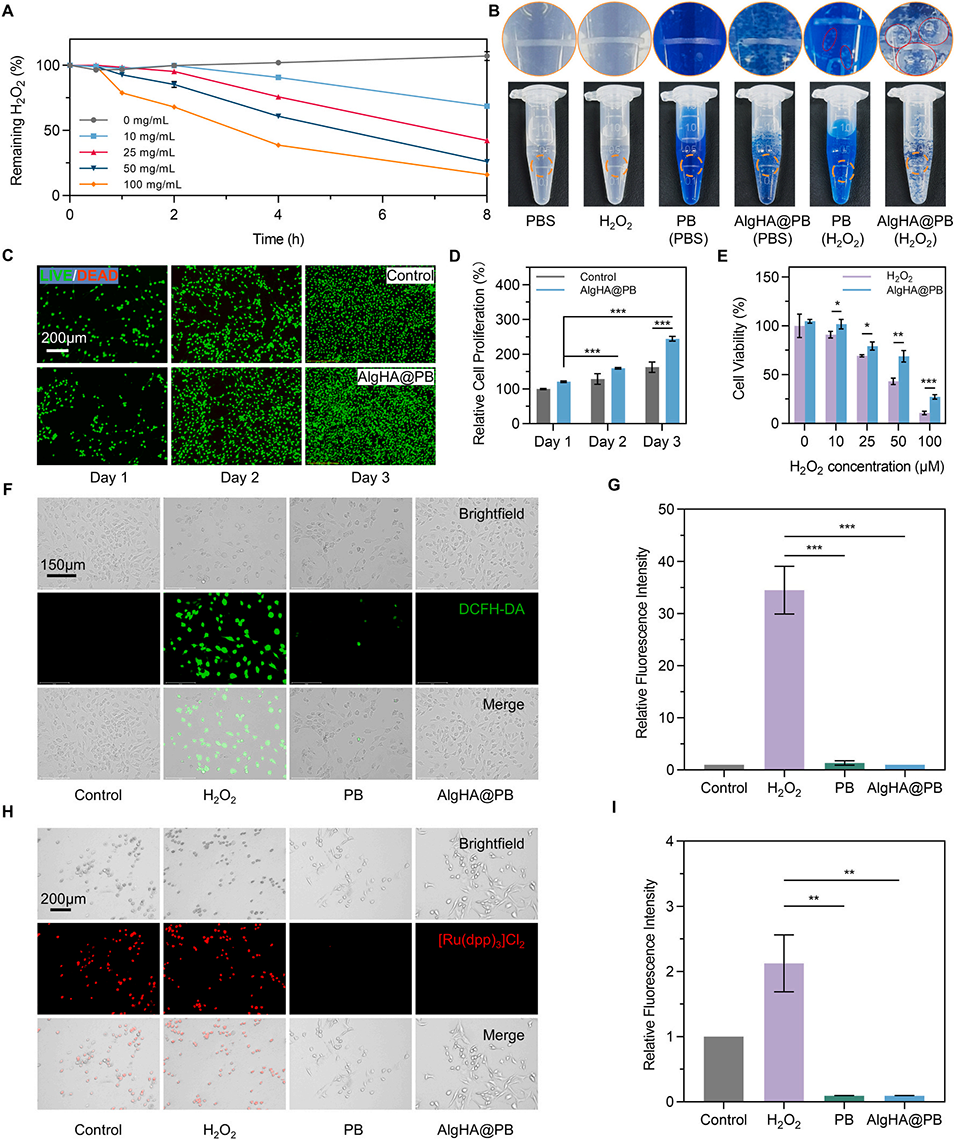
图3.AlgHA@PB的CAT酶活性和抗氧化功能评价。
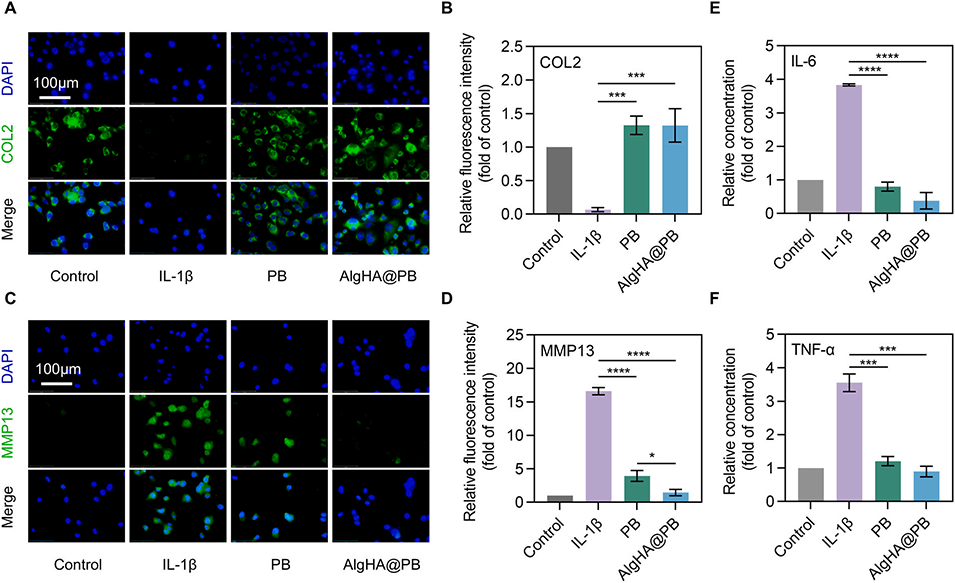
图4.AlgHA@PB通过抗氧化作用减轻炎症并保护软骨。(A,C)不同处理下共培养软骨细胞的COL2和MMP13染色结果(比例尺=100μm)。(B,D)与对照组相比,免疫荧光的荧光强度(数据以平均值±标准差表示,n=3)。(E)通过Elisa试验检测IL-6的表达(n=3)。(F)通过Elisa检测TNF-α的表达(数据以平均值±标准差表示,n=3)。(***p<0.001,****p<0.0001)。
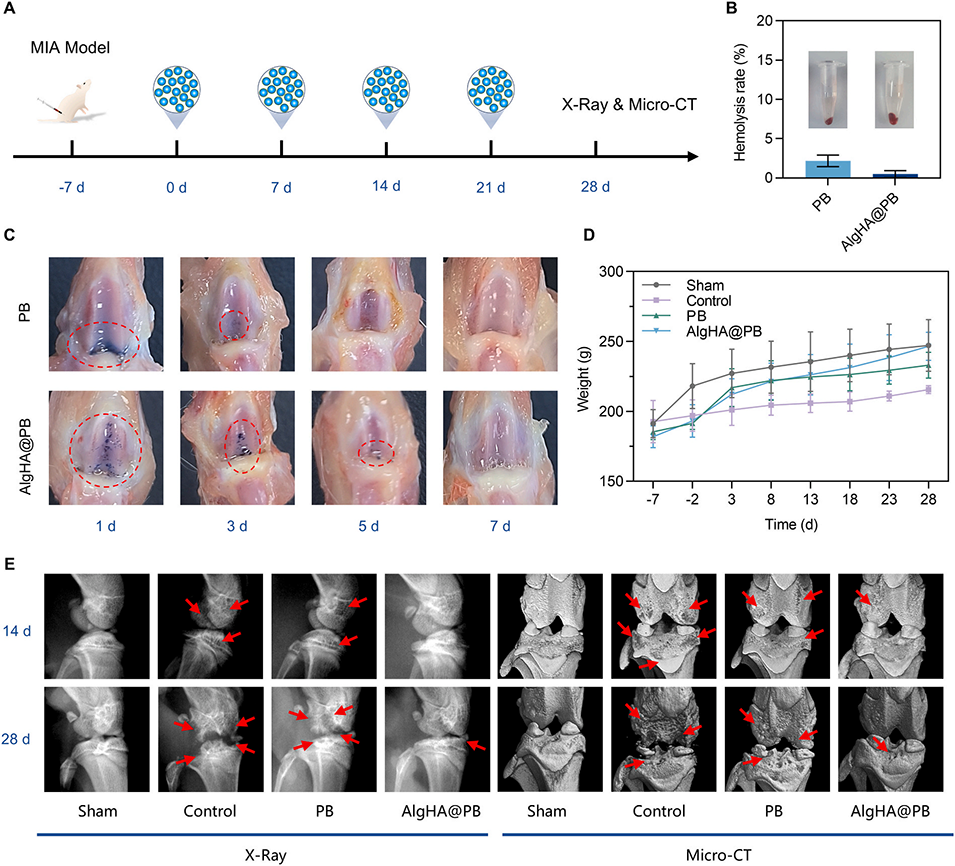
图5.AlgHA@PB增强OA大鼠的治疗效果。(A)OA大鼠的AlgHA@PB治疗流程。(B)暴露于不同浓度AlgHA@PB后的溶血实验结果(数据以平均值±标准差表示,n=3)。(C)PB和AlgHA@PB在关节腔内的保留。(D)在整个治疗周期内,不同组别大鼠的体重(数据以平均值±标准差表示,n=3)。(E)14d和28d时不同组膝关节的代表性X射线图像和显微CT图像(红色箭头:软骨损伤)。
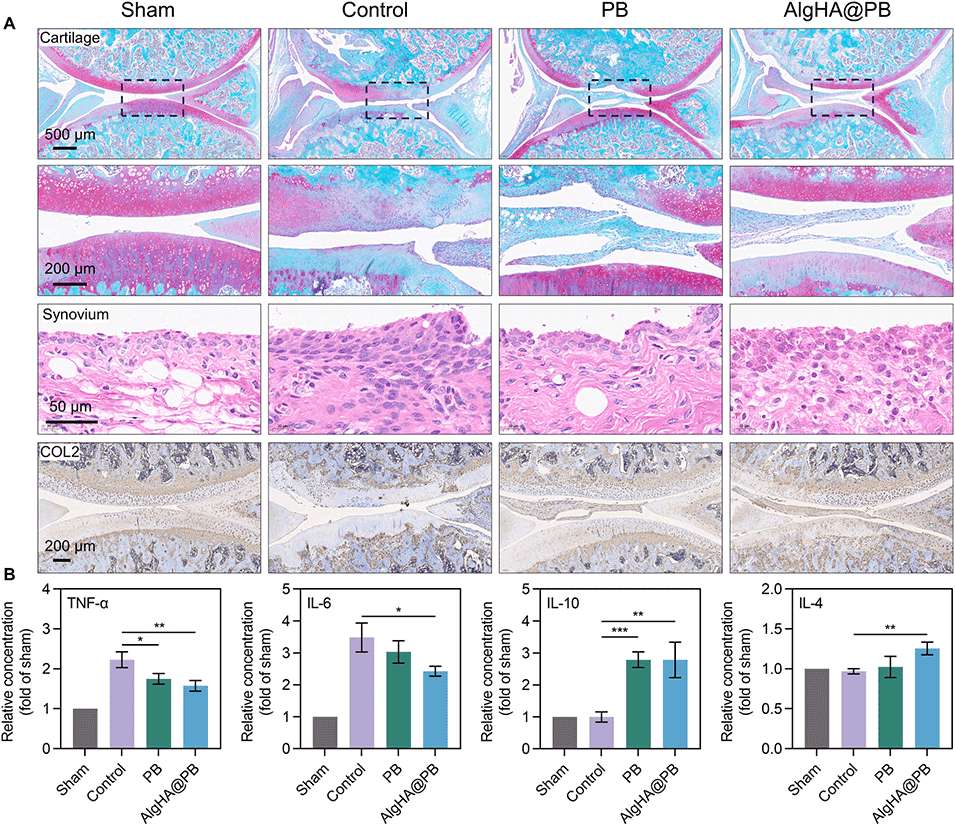
图6.短期治疗周期中的组织学染色和细胞因子检测。(A)各组的番红O-固绿染色、H&E染色和免疫组织化学。(B)Elisa结果显示TNF-α、IL-6、IL-10、IL-4的相对水平。(*p<0.05,**p<0.01,***p<0.001)(数据以平均值±标准差表示,n=3)。
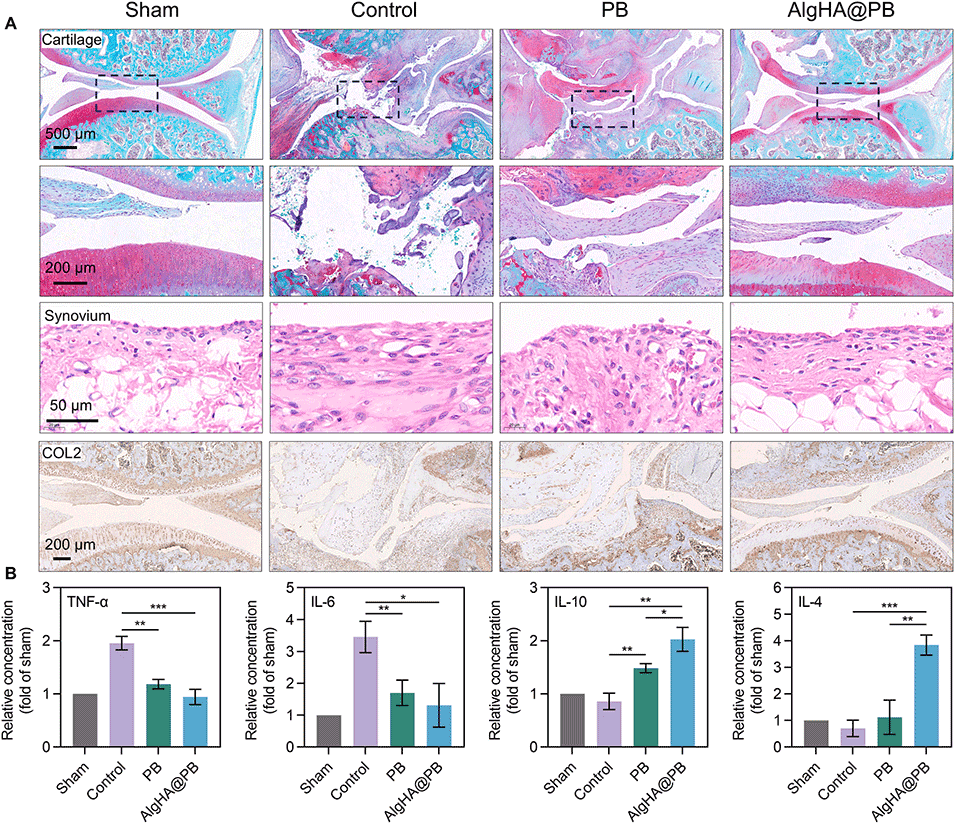
图7.长期治疗周期中的组织学染色和细胞因子检测。(A)各组的番红O-固绿染色、H&E染色和免疫组织化学。(B)Elisa结果显示TNF-α、IL-6、IL-10、IL-4的相对水平。(*p<0.05,**p<0.01,***p<0.001)(数据以平均值±标准差表示,n=3)。
论文链接:https://doi.org/10.1016/j.bioadv.2025.214345














