房颤显著增加卒中风险,是成人死亡的主要原因之一,口服抗凝药阿哌沙班作为直接FXa抑制剂,其片剂存在患者依从性差和用药剂量不当等问题。

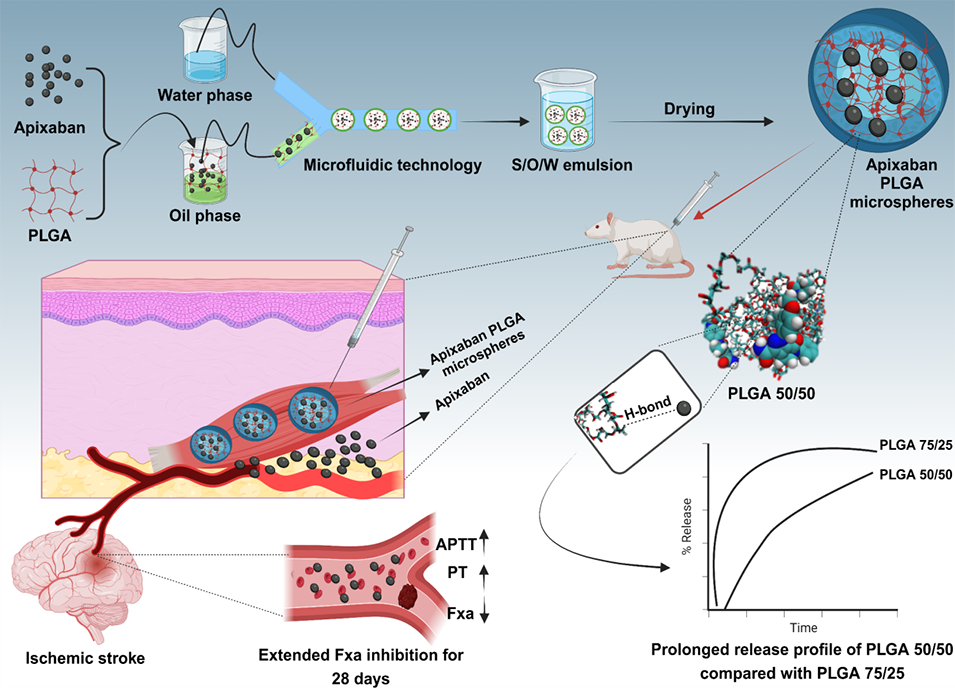
近期,苏州大学药学院曹青日教授团队联合苏大附一院中医科魏明刚教授等人开发了一种负载阿哌沙班的PLGA长效微球,通过微流控技术结合S/O/W双乳液-溶剂蒸发法制备,优化后微球表面光滑,粒径在45.99±0.07μm至71.74±0.02μm之间,封装效率超90%。分子模拟表明阿哌沙班与PLGA 50/50通过氢键作用实现长效释放,体内外实验显示其可延长抗凝血活性,FXa抑制作用持续28天,且具有良好的生物相容性,为房颤相关卒中预防提供了新的给药系统。相关研究以“Engineering Long-Acting apixaban loaded PLGA microspheres for the treatment of stroke caused by atrial fibrillation”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究借助微流控技术结合S/O/W双乳液-溶剂蒸发法,成功制备出表面光滑、粒径在45.99±0.07μm至71.74±0.02μm之间且封装效率超90%的载阿哌沙班PLGA长效微球。
2、通过分子模拟证实,阿哌沙班与PLGA 50/50之间形成的强氢键(576个)使其释放特性从速释转变为长效释放,此机制有别于传统认知中PLGA 50/50比75/25释放更快的情况。
3、体内外实验表明,该微球具有良好的生物相容性,可通过降低FXa 水平、延长APTT和PT时间,实现长达28天的抗凝血活性,药效优于阿哌沙班悬浮液。
4、微流控技术在制备中展现出显著优势,其精确控制流速产生的高剪切力能优化微球形态,将粒径缩小至40-70μm,减少注射不适与针头堵塞风险,提升药物递送可行性。
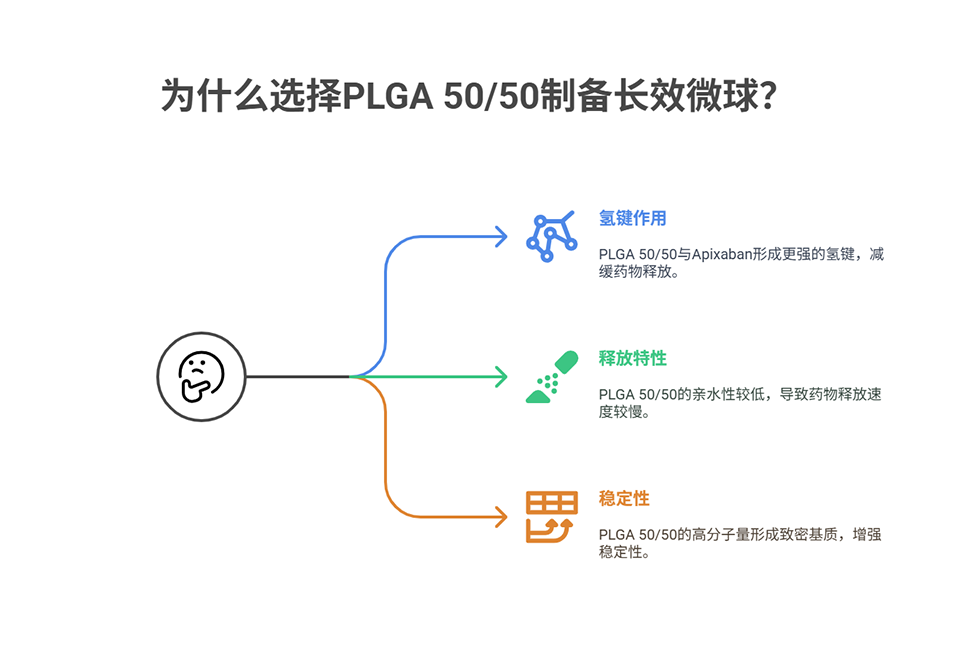
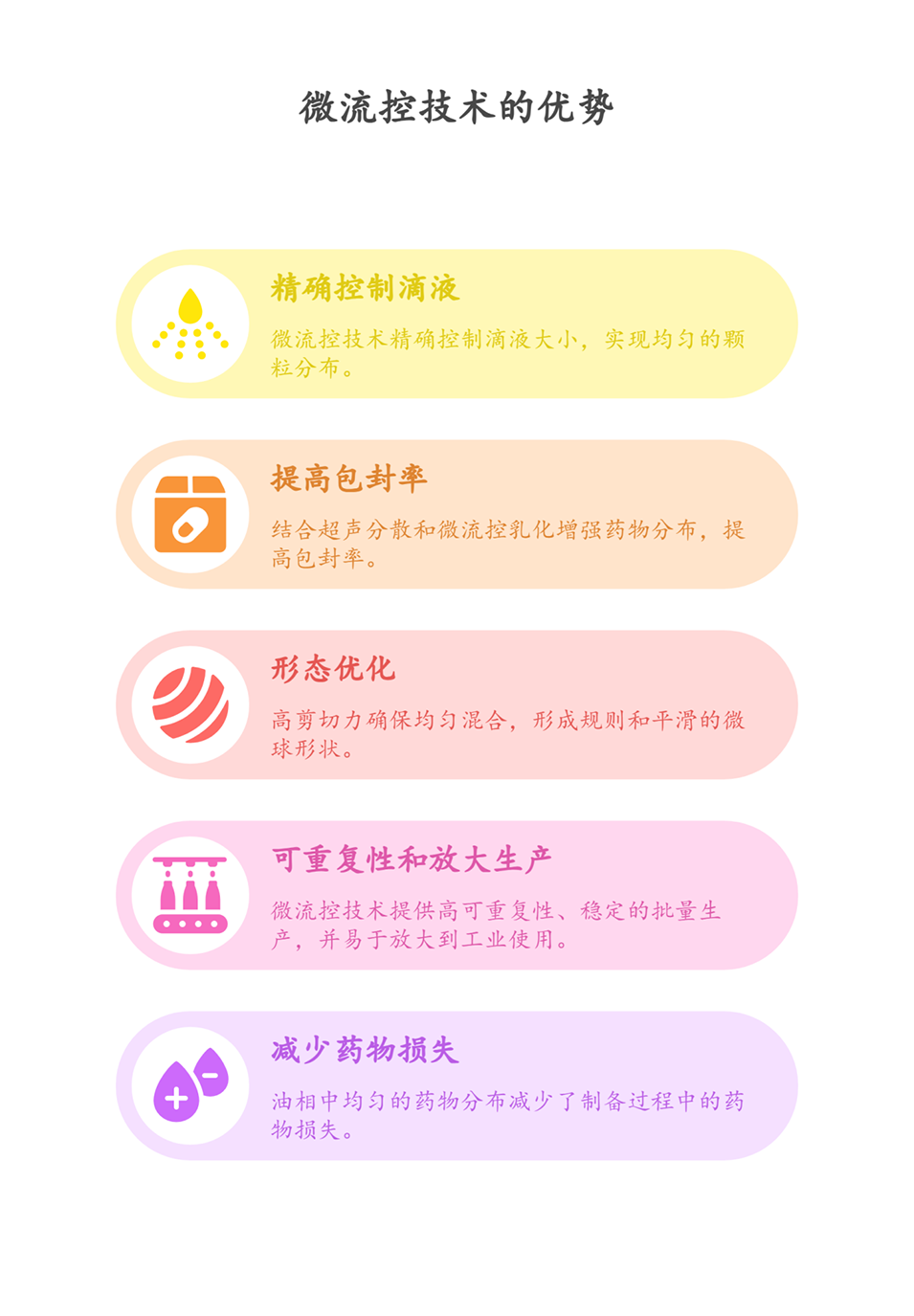

图1. (a)利用双乳液-溶剂蒸发法制备Apixaban微球的示意图。(b) Apixaban微球的包封效率与药物原料粒径的关系。(c)比较了通过研磨和沉淀两种方法获得的药物粒径对微球包封效率的影响。(d)比较了超声处理和机械搅拌两种方法对微球包封效率和粒径的影响。(e-f)不同PLGA类型(如PLGA 50/50和PLGA 75/25)对微球包封效率和粒径的影响。(g-h) PLGA 50/50不同分子量对微球包封效率和粒径的影响。(i-j)分别展示了双乳化均质时间和均质速度对微球包封效率和粒径的影响。(k)展示了不同PLGA类型(PLGA 50/50和PLGA 75/25)以及不同分子量的PLGA 50/50制备的微球的形态对比。
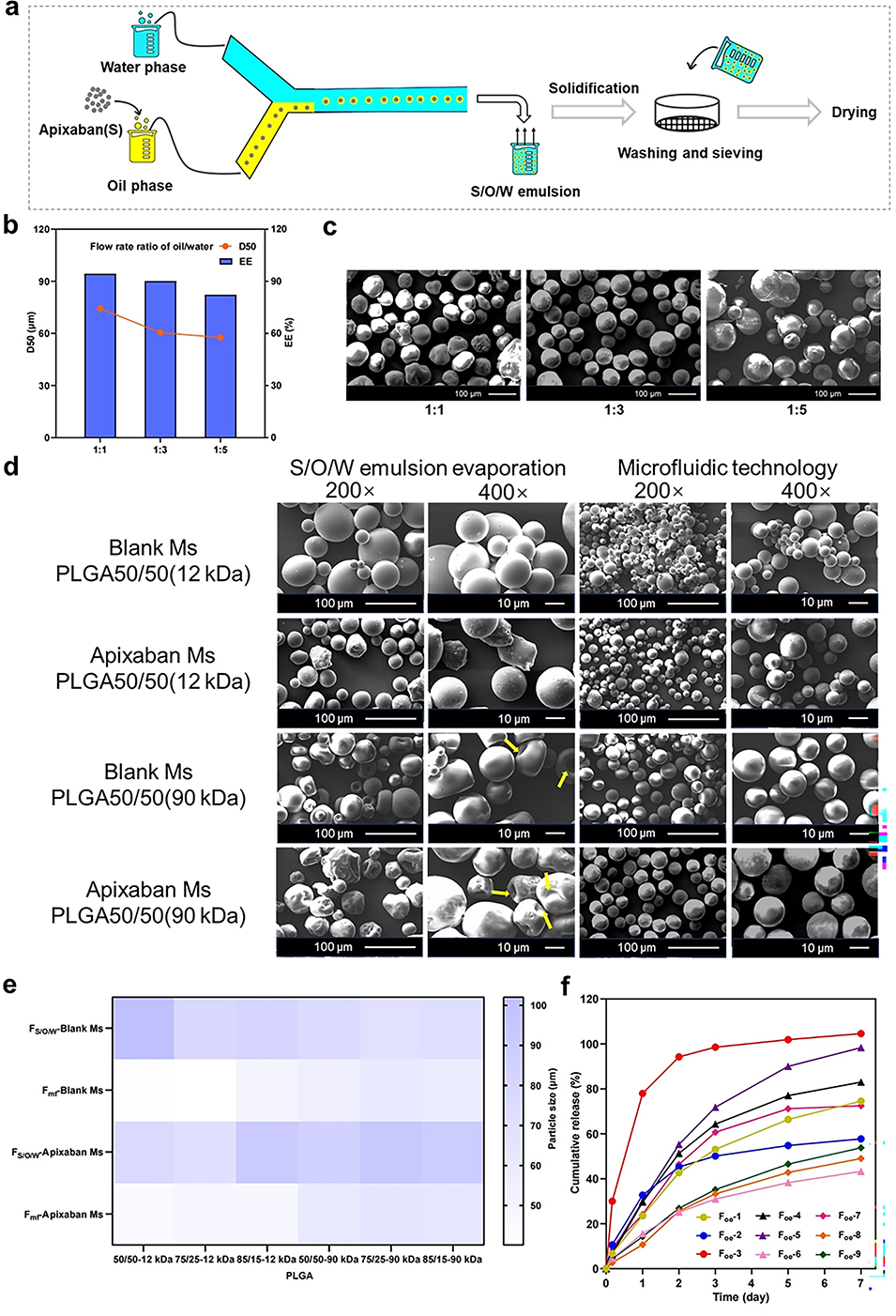
图2. (a)利用微流控技术制备Apixaban微球的示意图。(b-e)微流控技术制备的微球与传统方法制备的微球在形态和粒径上的对比。(f)正交设计组中Foe-6释放最慢(高分子量PLGA 50/50),Foe-3突释最高(低分子量PLGA)。
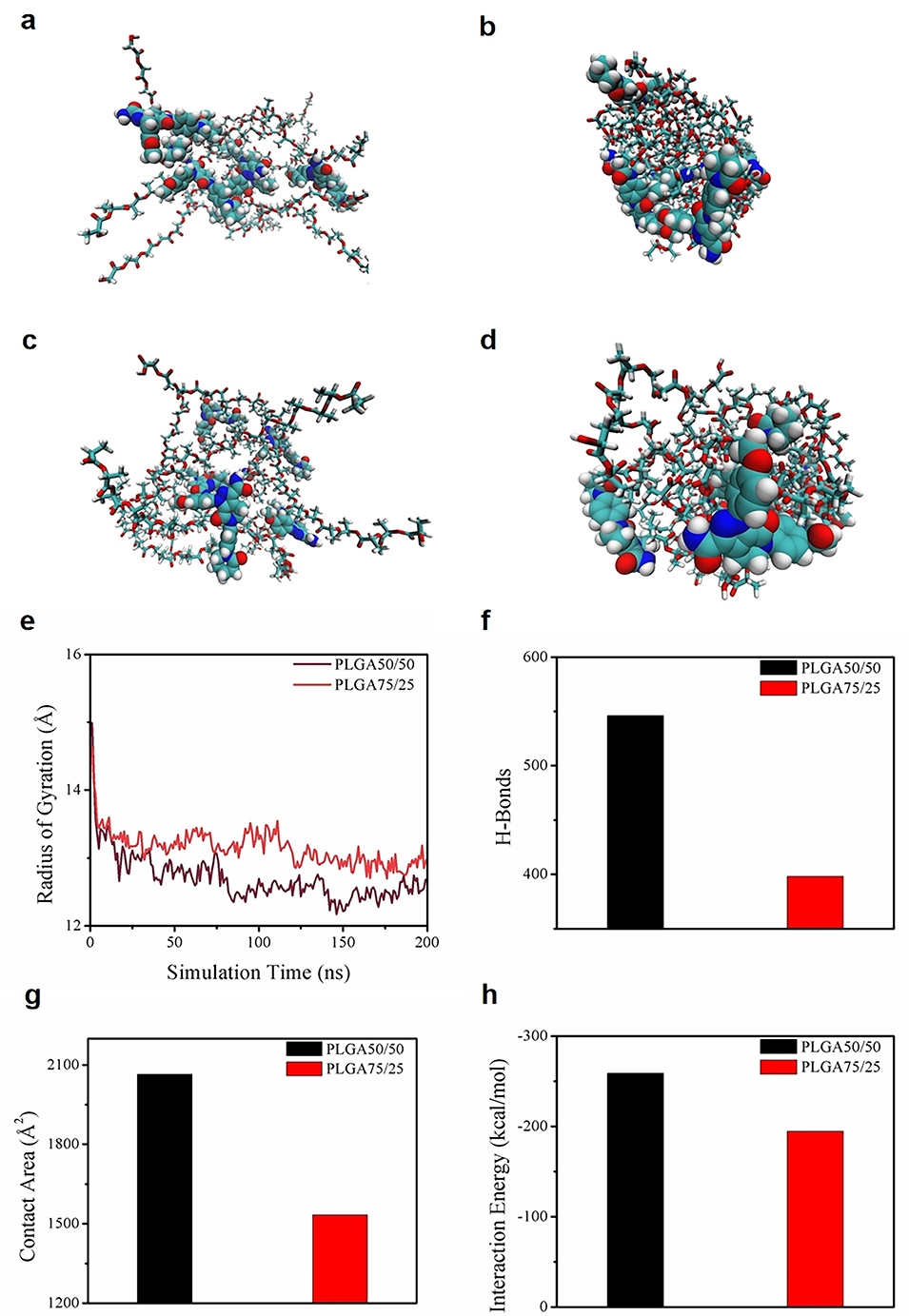
图3. (a-d)分子动力学模拟显示PLGA链从伸展态卷曲成团,药物向表面迁移。(e) PLGA 75/25回转半径(Rg)始终大于50/50(卷曲度更低)。(f) PLGA 50/50氢键数量(576)显著高于75/25。(g-h) PLGA 50/50与药物接触面积/结合力更强(解释缓释机制)。
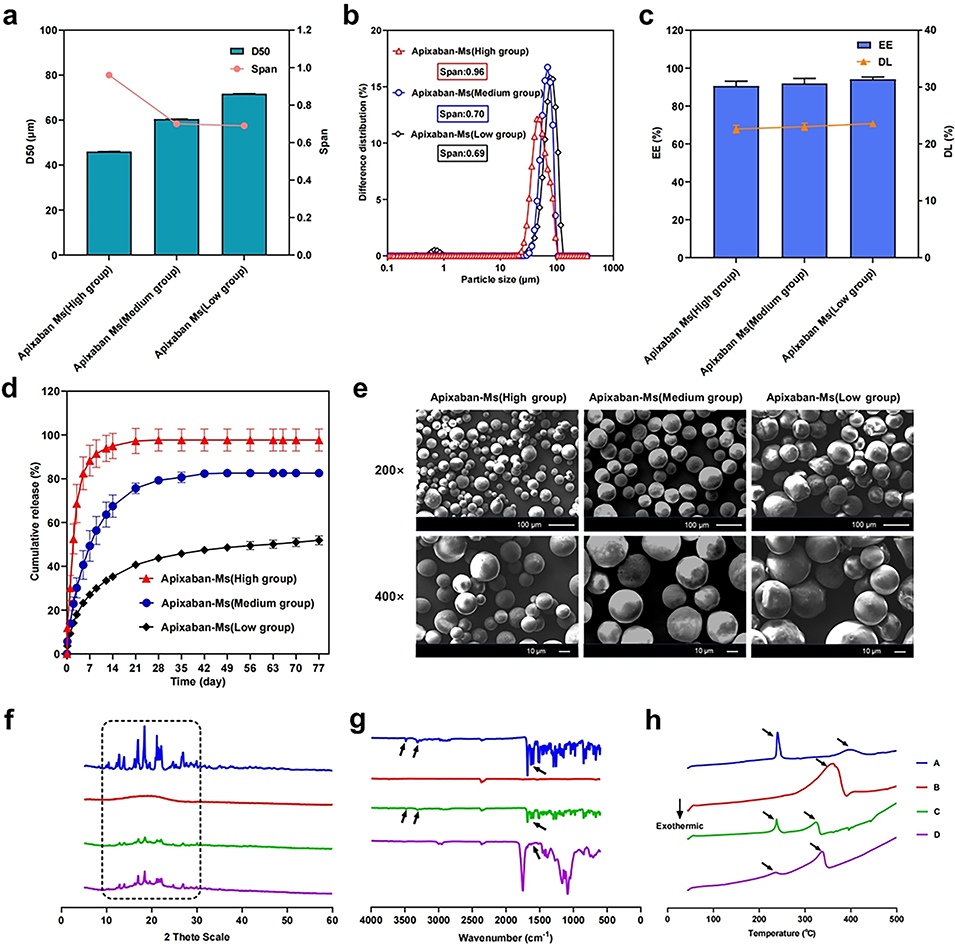
图4. (a-e)三种不同释放速率的Apixaban微球(低、中、高)的粒径、包封效率、药物载荷量和形态。(f-h)分别通过XRD、FTIR和DSC分析了Apixaban微球的晶体状态和药物-载体相互作用。
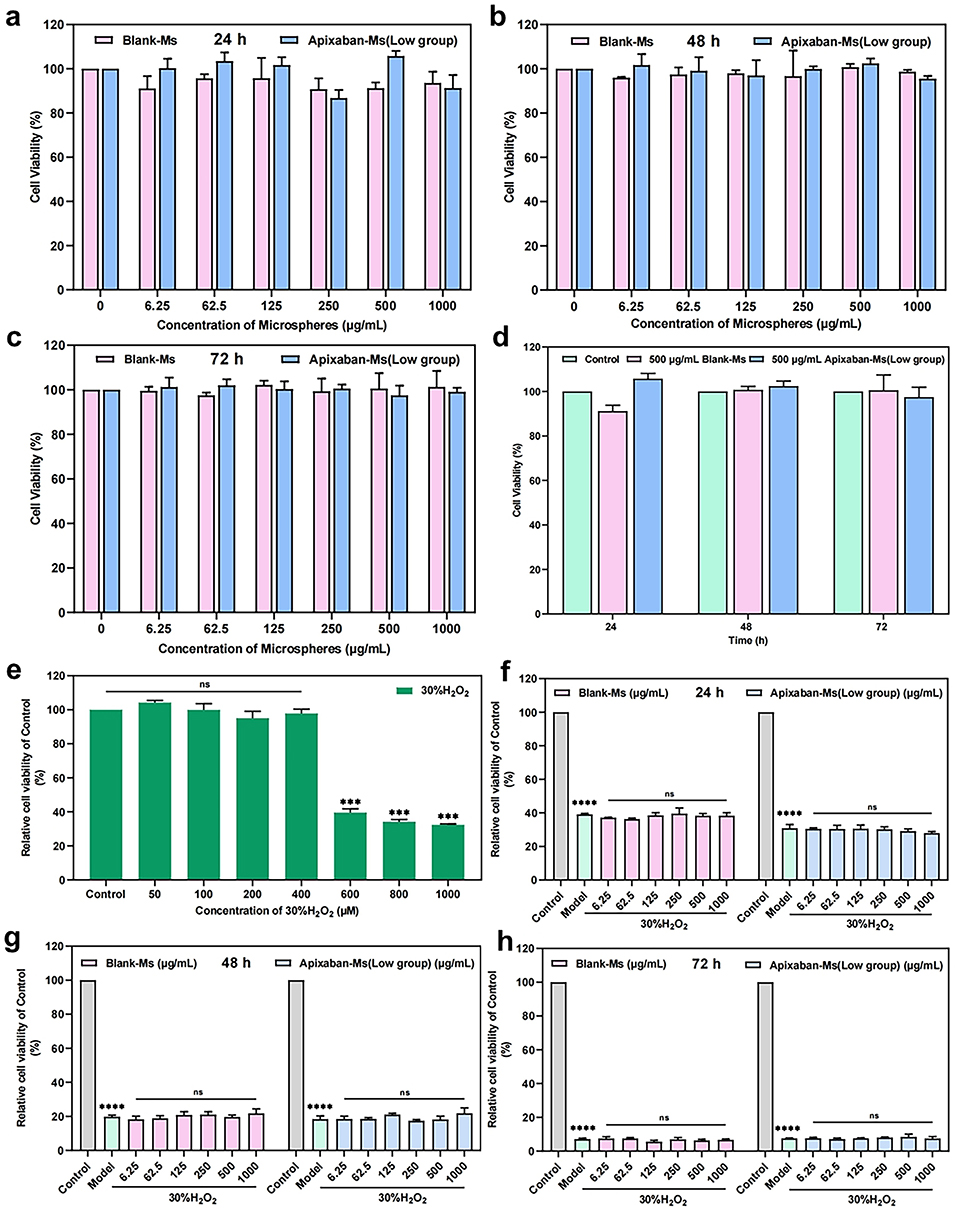
图5.空白和载药微球对人脐静脉内皮细胞(HUVEC)的细胞毒性评估结果。
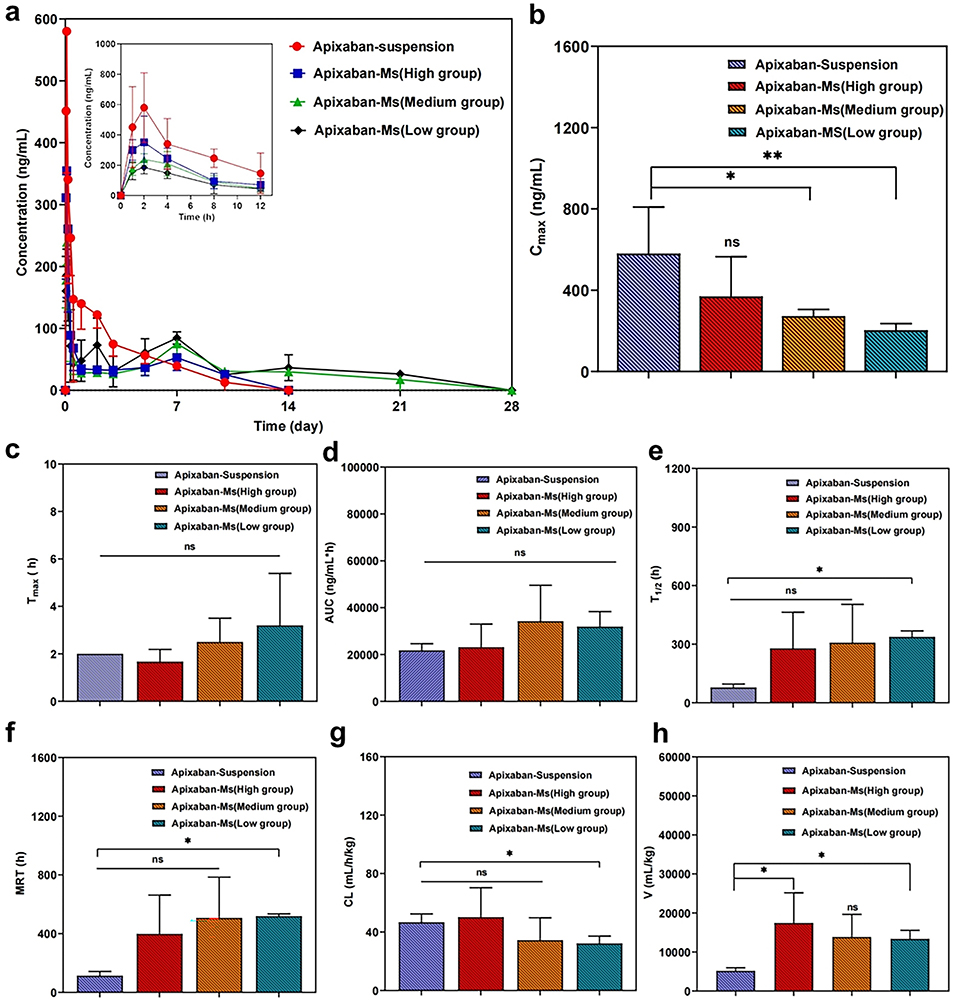
图6. Apixaban微球在体内的药代动力学特性。与Apixaban悬浮液相比,微球制剂在体内具有更长的循环时间和更缓慢的药物释放特性。Apixaban-Ms(低)组的Cmax较低,清除率降低,半衰期(T1/2)和平均滞留时间(MRT)延长,表明药物在体内的暴露时间更长,作用时间更持久。
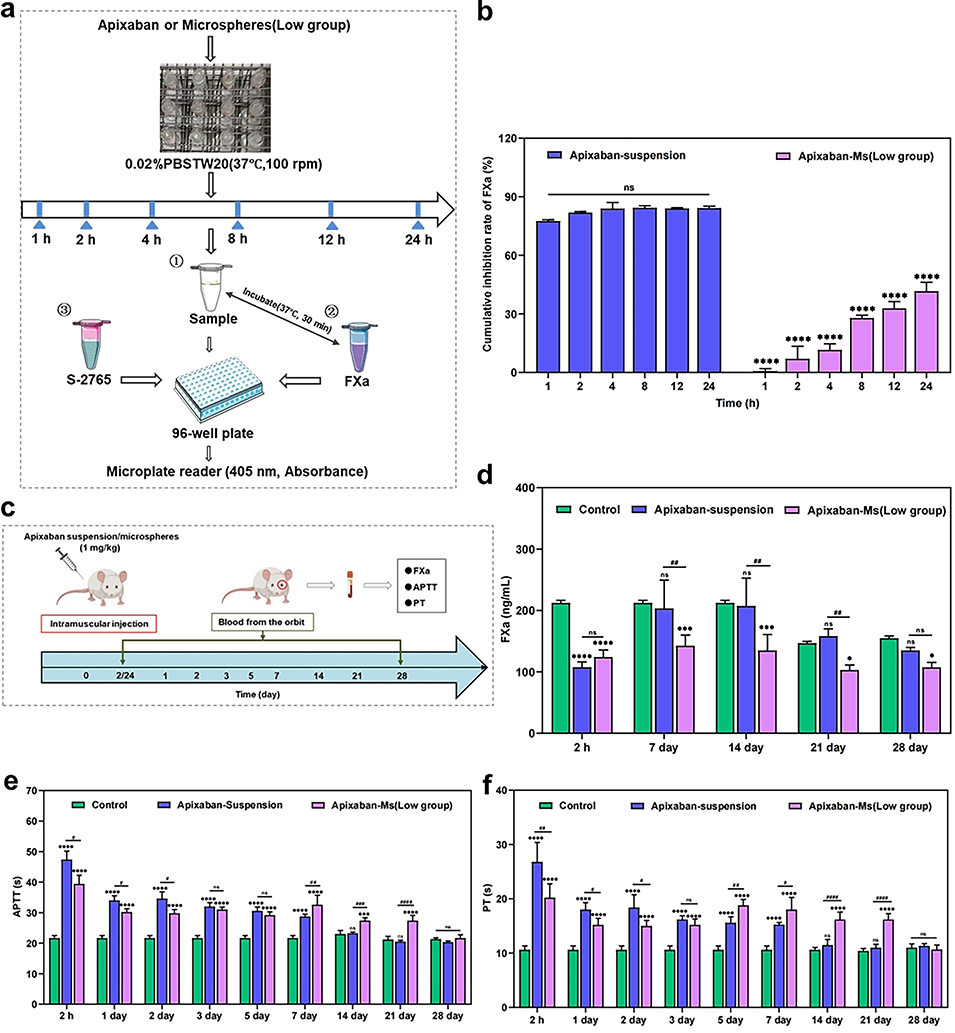
图7. (a-c) Apixaban微球的体外和体内药效学研究结果。(d-f) Apixaban微球在体内对FXa水平、APTT和PT的影响。
论文链接:https://doi.org/10.1016/j.cej.2025.164321














