
导读:
肝细胞癌(HCC)是常见的致命性肝癌。经动脉放射栓塞(TARE)是治疗不可切除HCC的有效方法,但现有临床放射性微球(如⁹⁰Y树脂微球)存在同位素泄漏和比活度低等问题,影响疗效与安全性。为了应对这些挑战,苏州大学附属第四医院文玲副教授与苏州大学放射医学与防护学院吴书旺教授、段广新副研究员等人合作,通过微流控技术成功开发了一种基于双膦酸盐的水凝胶微球(DPMs)。该微球不仅能高效、稳定地螯合治疗性放射性核素(如¹⁷⁷Lu),还可同时负载化疗药物,从而在一个平台上实现了经动脉放射栓塞(TARE)与化疗栓塞(TACE)的协同治疗。相关研究以“Disphosphate based hydrogel microspheres for targeted transarterial radioembolization and chemoembolization therapies”为题目,发表在期刊《Journal of Advanced Research》上。
本文要点:
1、本研究开发了一种双膦酸盐功能化聚(丙烯酰胺-丙烯酸)水凝胶微球(DPMs)。该微球通过微流控技术制备,尺寸均一(约55 μm),密度适宜(1.2 g/cm³),生物相容性良好。
2、其关键优势在于双膦酸盐基团能高效、稳定地螯合多种治疗性金属核素(如¹⁷⁷Lu、90Y、166Ho),¹⁷⁷Lu标记效率15分钟内达98.3%,且在血清中7天内放射性标记率保持99%。
3、微球的多孔结构还能高效负载并控释化疗药物阿霉素(DOX),形成¹⁷⁷Lu-DPMs@DOX多功能平台,实现TARE与经动脉化疗栓塞(TACE)的协同治疗。
4、体内外实验表明,该平台在兔VX2肝癌模型中展现出卓越的抗肿瘤效果和良好的生物安全性,为不可切除HCC及其他难治性肿瘤提供了一种精准、安全、高效的治疗新策略。

双膦酸盐功能化的聚(丙烯酰胺-丙烯酸)水凝胶微球(DPMs)的载药原理
1、物理吸附:多孔结构提供负载基础
DPMs通过微流控技术制备,具有高度多孔且相互连接的三维网络结构,该结构不仅提供充足空间容纳药物分子(如阿霉素,DOX),还显著增大微球比表面积;其表面及内部的羟基、酰胺基等基团可通过范德华力、疏水相互作用,将药物分子吸附在微球内外部,实现初步药物负载。
2、化学结合:电荷作用增强负载稳定性
DPMs的聚合物基体含丙烯酸单元,解离后产生带负电荷的羧基(-COOH);而DOX等化疗药物为含氨基的碱性药物,在水溶液中易质子化带正电荷。二者通过静电相互作用(正负电荷吸引) 形成稳定结合,既提升药物负载效率(如对DOX 10分钟内包封率接近100%),又避免药物提前泄漏,同时保障后续在肿瘤部位的可控释放,适配经动脉化疗栓塞(TACE)治疗需求。
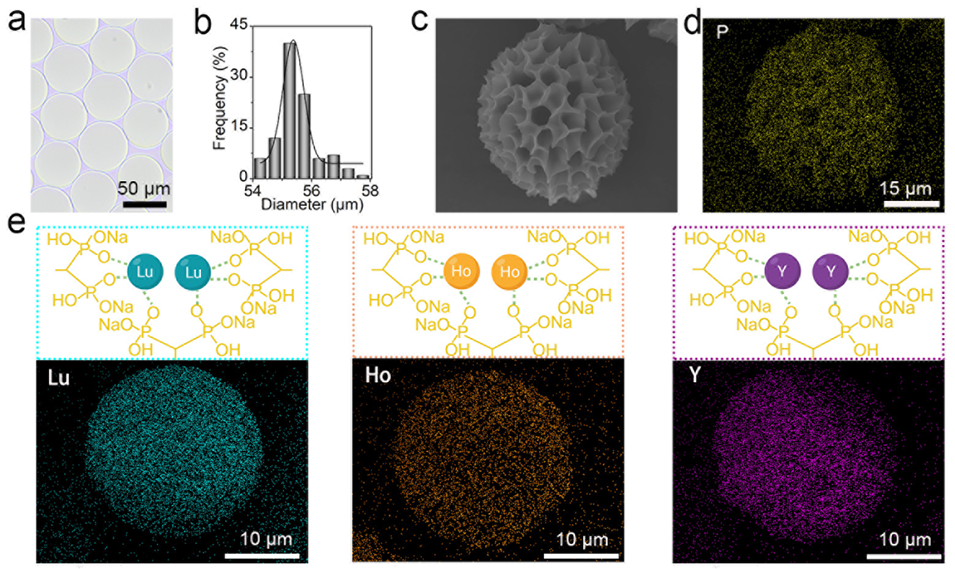
图1: DPMs的制备、金属核素标记与表征。a) DPMs的光学显微镜图像,显示其单分散性良好。b) DPMs的直径分布图,显示其尺寸均一,平均直径为55.5 ± 0.4 μm。c) DPMs的扫描电子显微镜(SEM)图像,显示冻干后微球仍保持球形,结构稳定。d) DPMs的EDS元素映射图,显示磷(P)元素在微球上均匀分布,证明双膦酸盐基团成功引入。e) 示意图展示了双膦酸盐基团与金属核素的螯合作用;EDS映射图显示Lu、Ho、Y三种金属元素在DPMs上均匀分布,证明其标记的普遍性和均匀性。
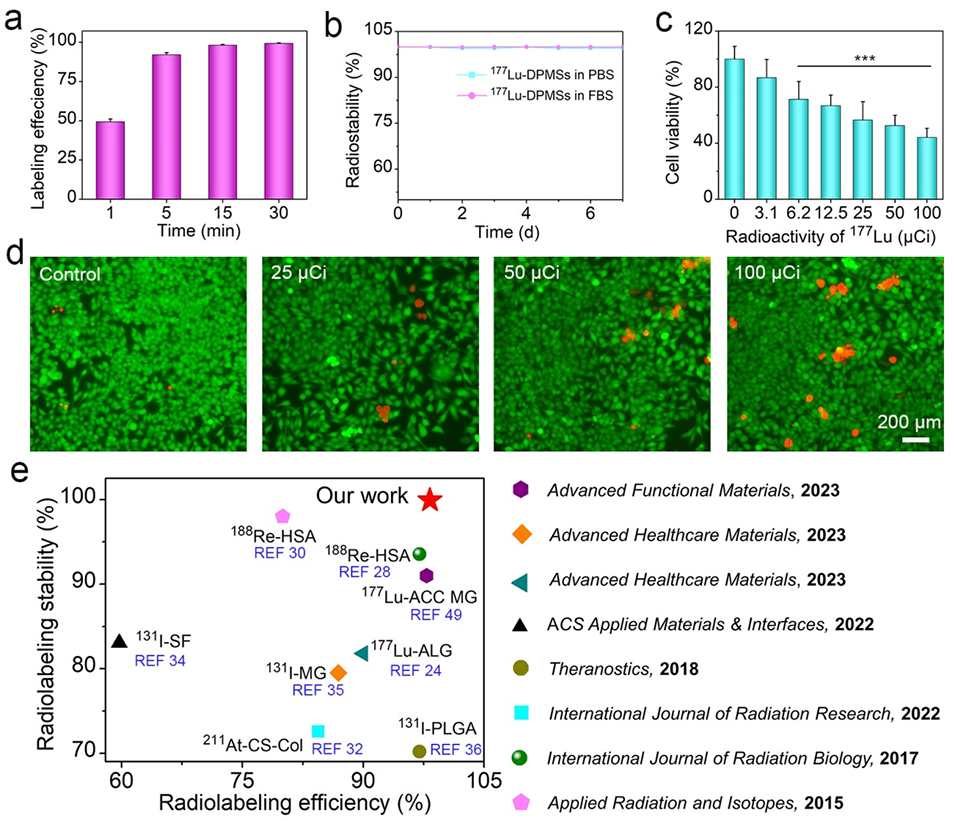
图2: ¹⁷⁷Lu在DPMs上的标记性能及体外抗肿瘤效果。a) 不同标记时间下¹⁷⁷Lu在DPMs上的标记效率曲线,显示15分钟内效率可达98%以上,标记迅速。b) ¹⁷⁷Lu-DPMs在PBS和FBS溶液中7天内的标记稳定性,显示泄漏率极低(<1%),稳定性卓越。c) CCK-8实验显示¹⁷⁷Lu-DPMs对HepG2细胞的毒性呈剂量依赖性。d) 活/死细胞染色直观展示了¹⁷⁷Lu-DPMs对HepG2细胞的杀伤效果(死细胞为红色)。e) 将DPMs的核素标记效率和稳定性与文献中已报道的其他微球进行对比,显示DPMs性能优越。
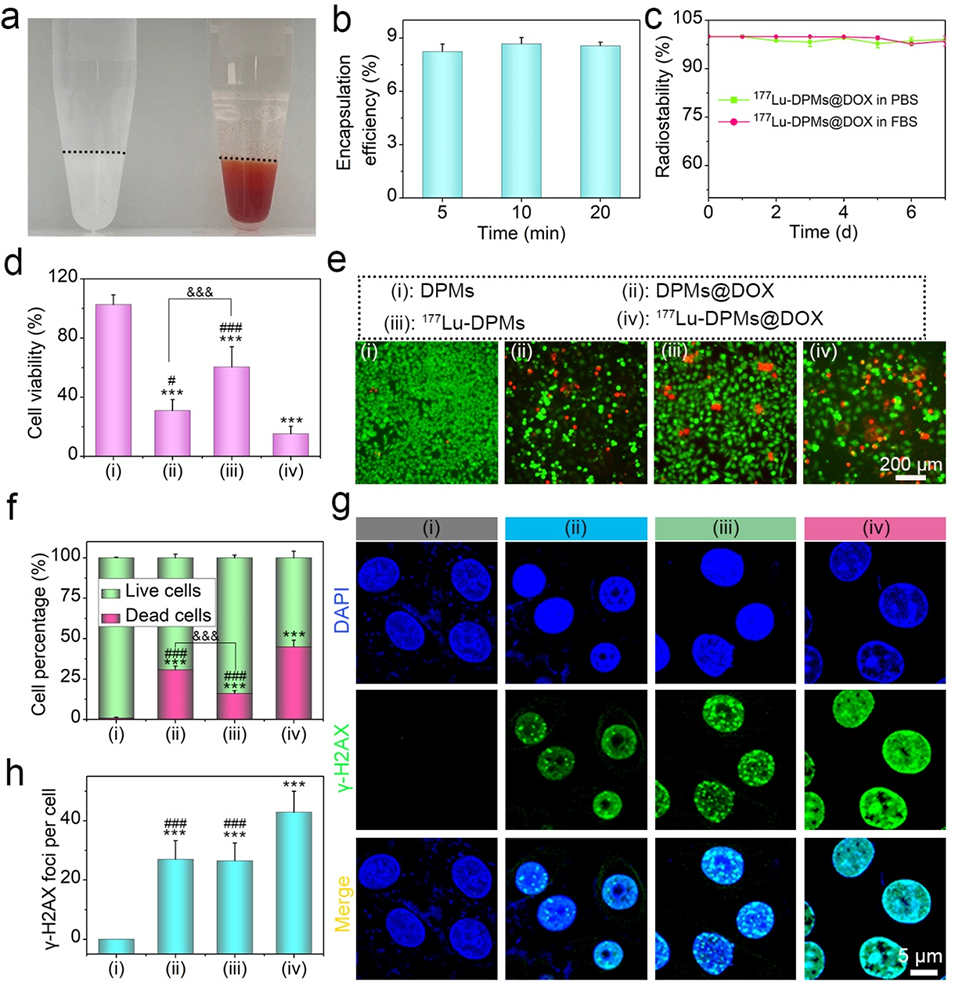
图3: DOX负载及¹⁷⁷Lu-DPMs@DOX的体外协同治疗效果。a) 负载DOX前后DPMs的光学照片,颜色由白变红,直观显示快速载药能力。b) DPMs对DOX的包封效率随时间变化曲线,显示10分钟内可达近100%。c) 载药后,¹⁷⁷Lu-DPMs@DOX在PBS和FBS中仍保持极高的放射性标记稳定性。d) CCK-8实验证明,¹⁷⁷Lu-DPMs@DOX组(联合治疗)的细胞存活率最低,显著优于单一疗法组。e) 活/死细胞染色结果与CCK-8一致,显示联合治疗组死细胞最多。f) 对(e)图中活死细胞数量的定量分析。g) γ-H2AX免疫荧光染色(DNA损伤标志),显示¹⁷⁷Lu-DPMs@DOX处理组每个细胞的DNA损伤焦点数最多,表明其能造成最严重的DNA双链断裂。h) 对(g)图中γ-H2AX焦点数的统计分析。
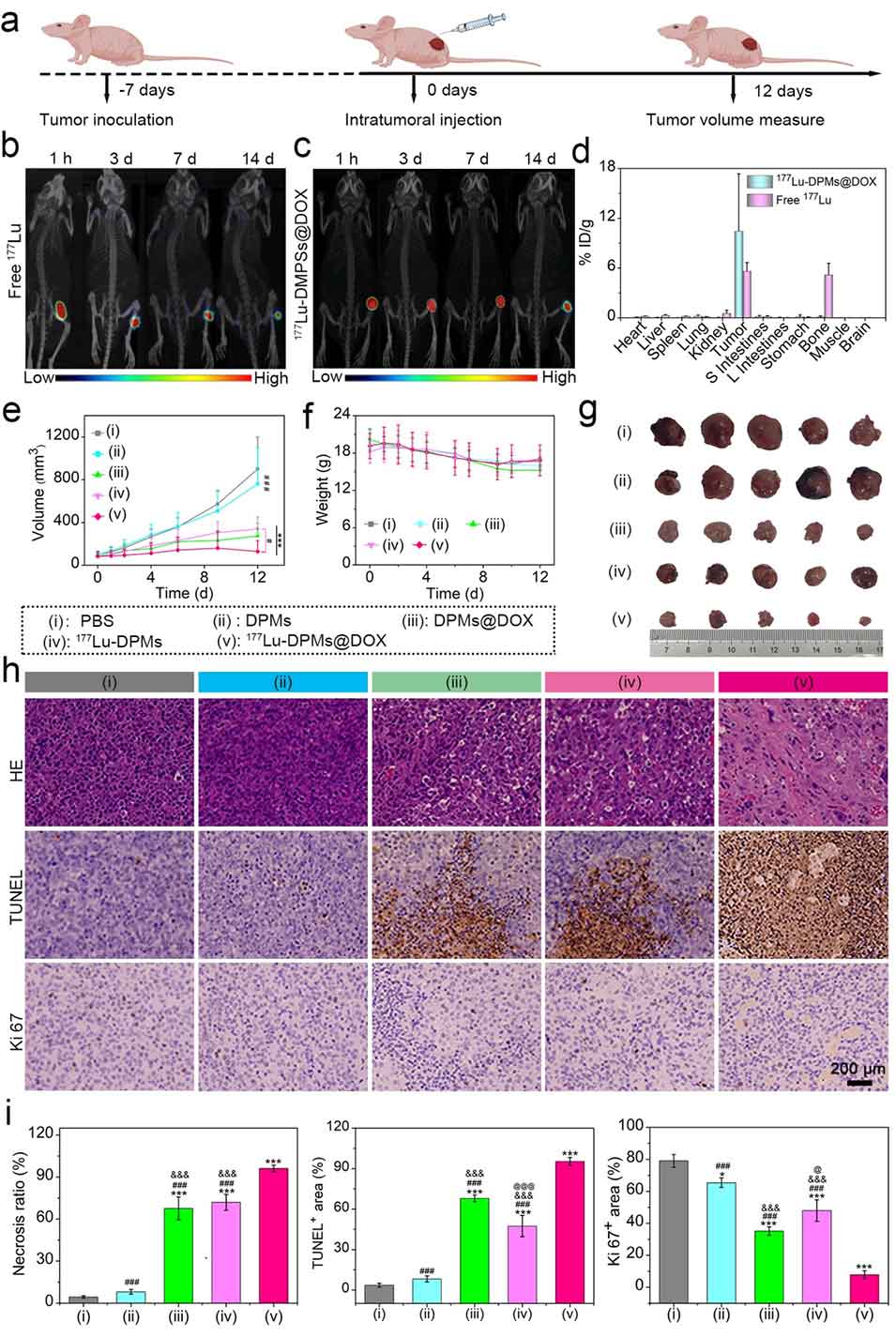
图4: ¹⁷⁷Lu-DPMs@DOX在HepG2荷瘤小鼠模型中的抗肿瘤实验。a) 小鼠模型建立、治疗和监测的时间流程示意图。b) 注射游离¹⁷⁷Lu后不同时间点的SPECT/CT图像,显示¹⁷⁷Lu逐渐从肿瘤泄漏并富集到骨骼中。c) 注射¹⁷⁷Lu-DPMs@DOX后的SPECT/CT图像,显示¹⁷⁷Lu信号在14天内持续稳定位于肿瘤区域,无显著泄漏。d) 注射后14天,通过γ计数器分析各组织放射性分布,定量证实¹⁷⁷Lu-DPMs@DOX组仅在肿瘤有高信号,而游离¹⁷⁷Lu组在骨骼中有高摄取。e) 不同治疗组(PBS, DPMs, ¹⁷⁷Lu-DPMs, DPMs@DOX, ¹⁷⁷Lu-DPMs@DOX)的肿瘤生长曲线,显示联合治疗组抑瘤效果最显著。f) 各组小鼠体重变化曲线,表明治疗无明显系统性毒性。g) 治疗12天后取出的肿瘤照片,直观展示各组的肿瘤大小差异。h) 肿瘤组织的H&E(坏死)、TUNEL(凋亡)和Ki67(增殖)染色切片图。i) 对(h)图染色结果的定量分析,显示¹⁷⁷Lu-DPMs@DOX组肿瘤坏死和凋亡率最高,增殖指数最低。
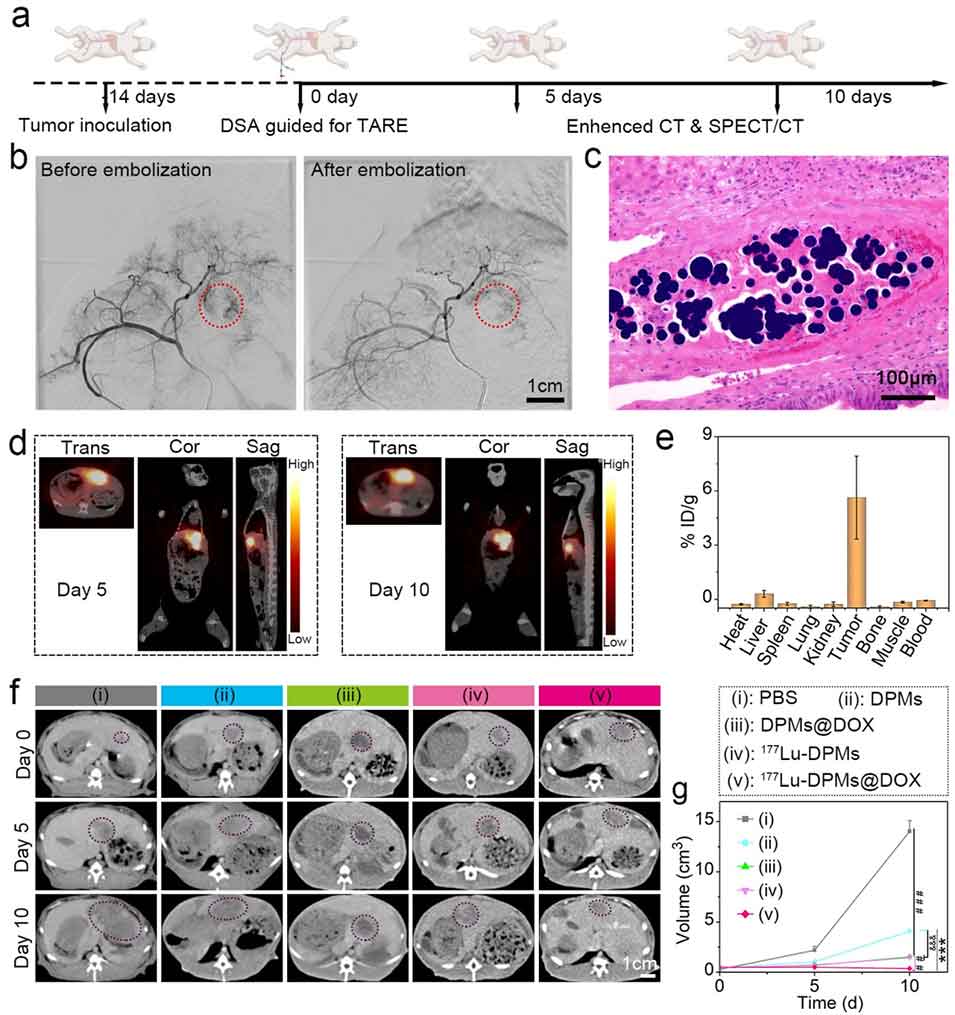
图5: ¹⁷⁷Lu-DPMs@DOX在兔VX2肝肿瘤模型中的抗肿瘤实验。a) 兔VX2肝癌模型建立、经动脉介入治疗和监测的时间流程示意图。b) 介入栓塞手术的DSA图像,显示栓塞后肿瘤供血血管模糊或消失,证明DPMs具有良好的血管栓塞性能。c) 治疗后第10天,组织切片显示微球(¹⁷⁷Lu-DPMs@DOX)仍完整存在于血管内,未降解或聚集。d) 治疗后第5和第10天的SPECT/CT图像,显示γ信号始终局限于肝脏肿瘤内,再次证明体内标记稳定性。e) 治疗后第30天,通过γ计数器分析主要器官的放射性分布,定量证实¹⁷⁷Lu仅存在于肝癌组织,未分布于正常肝组织或其他器官。f) 增强CT图像显示不同治疗组在0、5、10天时肿瘤体积的变化(圆圈标示肿瘤位置)。g) 不同治疗组的肿瘤生长曲线定量数据,显示¹⁷⁷Lu-DPMs@DOX联合治疗组肿瘤抑制效果最佳。
论文链接:https://doi.org/10.1016/j.jare.2025.09.044
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














