经动脉化疗栓塞术(TACE)是中期肝癌一线疗法,但传统栓塞微球(如Embosphere®、CalliSpheres®)存在血管堆积松散、药物释放不理想、尺寸分布宽、不可降解等问题,导致治疗效果受限且易引发并发症。

近期,苏州大学钟志远教授、邓超教授联合苏州大学附属第一医院介入科朱晓黎教授等人开发了一种基于透明质酸的新型可降解栓塞微球(3Asphere)。该微球具备优异的血管适配性与生物粘附性,能实现化疗药物的快速装载与长期缓释,在动物模型中显著提升了肝动脉化疗栓塞术的疗效并抑制了肿瘤转移。相关研究以“Tumor vessel-adaptable adhesive and absorbable microspheres for sustainable transarterial chemoembolization therapy”为题目,发表在期刊《Nature Communications》上。
本文要点:
1、本研究开发了一种基于透明质酸、兼具肿瘤血管适应性、粘附性和可吸收性的微球(3Asphere),用于可持续的肝动脉化疗栓塞术治疗。
2、该微球通过微流控和自由基聚合法制备,尺寸均一,可在两个月内逐渐降解,并能快速装载并持续释放表柔比星等化疗药物。
3、3Asphere凭借高弹性实现稳健的血管栓塞,在兔VX2原位肝癌模型中,能通过CD44主动结合内皮细胞,有效抑制肿瘤生长、延长生存期,其疗效优于商用Embosphere®。
4、载药3Asphere进一步增强了抑瘤效果并阻止肺转移。本研究为TACE提供了一种多功能先进的治疗策略。
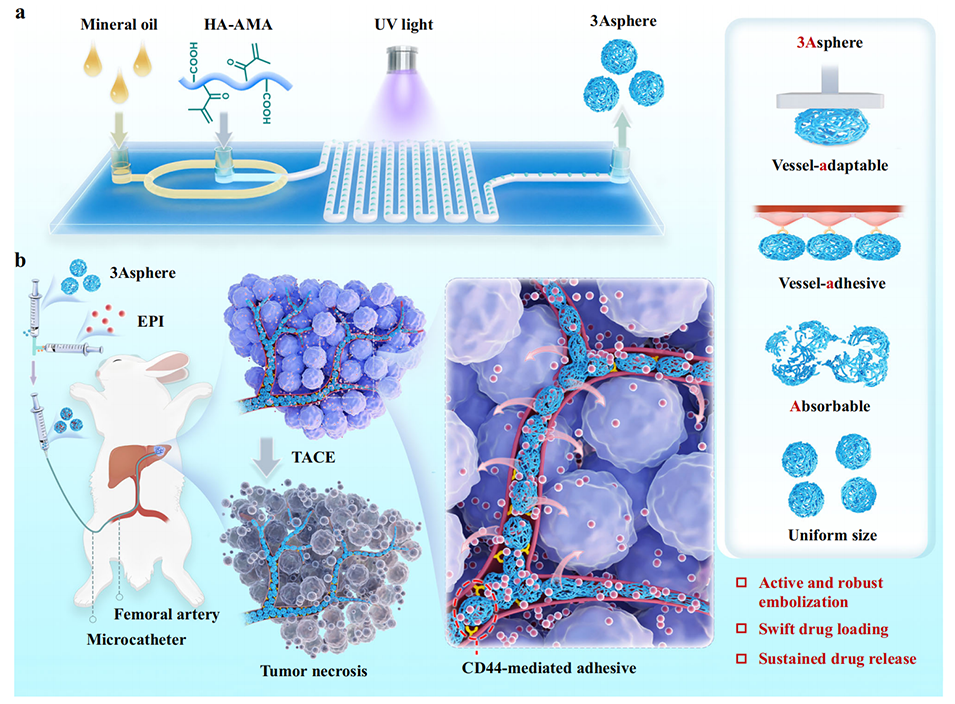
图1. 用于可持续经动脉化疗栓塞(TACE)治疗的肿瘤血管适配性黏附可吸收微球(3Asphere)示意图
本研究采用微流控与自由基聚合相结合的技术,以透明质酸(HA)衍生物为原料,制备出3Asphere。具体流程如下:
原料与预制备:先通过酰胺化反应合成透明质酸-甲基丙烯酸2-氨基乙酯衍生物(HA-AMA),将其配制成浓度为45mg/mL的磷酸盐缓冲液(PB,10mM,pH 8.5),并加入0mg/mL的光引发剂Irgacure 2959(I2959),作为水相;同时将含有9.0wt% Span 80的矿物油作为油相。
微球形成与交联:在微流控芯片中,利用侧向油相对水相的流体动力聚焦作用,生成尺寸均一的微液滴;随后用365nm波长、功率30mW/cm²的紫外光照射微液滴,引发HA-AMA的自由基聚合反应,形成稳定的微球。
纯化处理:通过异丙醇、己烷、磷酸盐缓冲液(PBS)依次清洗生成的微球,去除残留的油相、未反应原料及光引发剂,最终得到3Asphere。
此外,该制备过程可通过调整HA浓度、微流控芯片深度及水相/油相流速比,精准控制3Asphere的尺寸(范围40-180 μm),且批次间重复性良好(变异系数< 2%)。
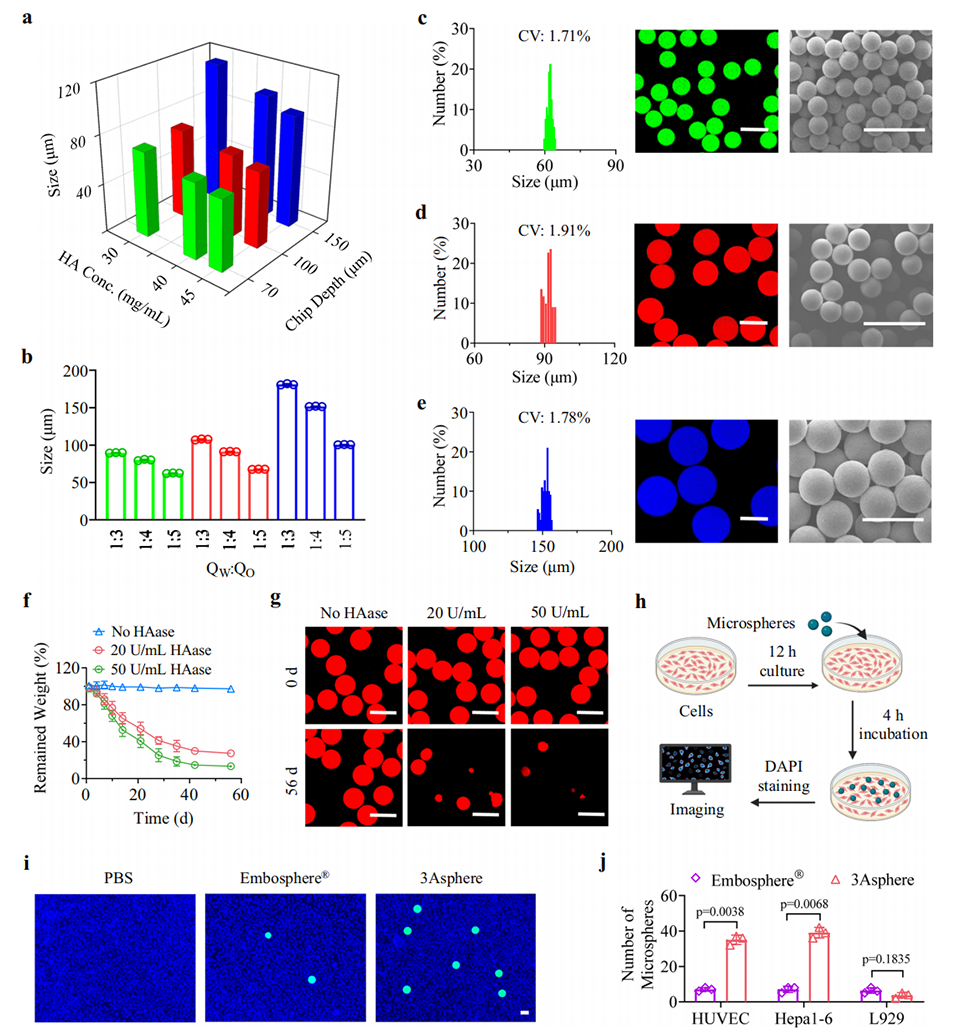
图2. 3Asphere的制备与表征
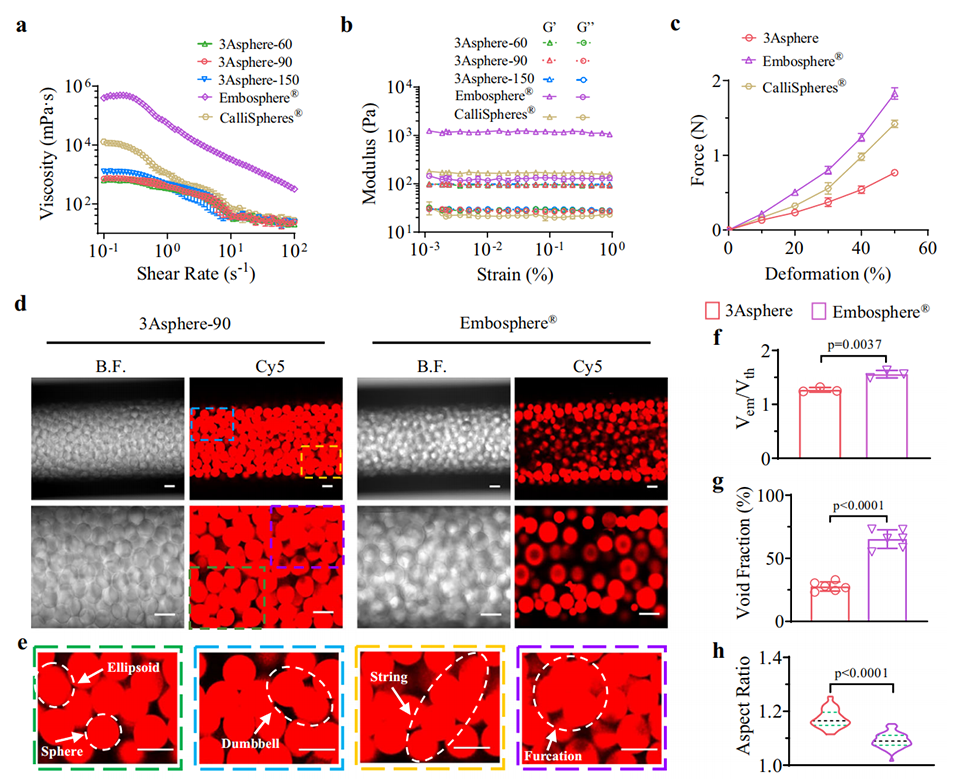
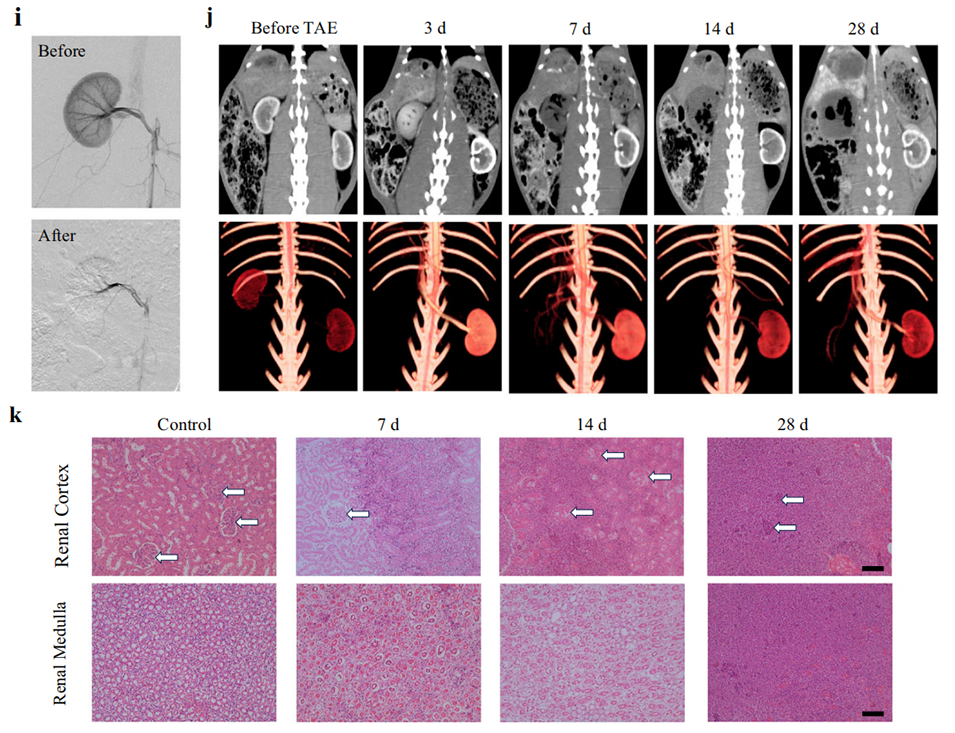
图3. 3Asphere的力学性能及栓塞效果
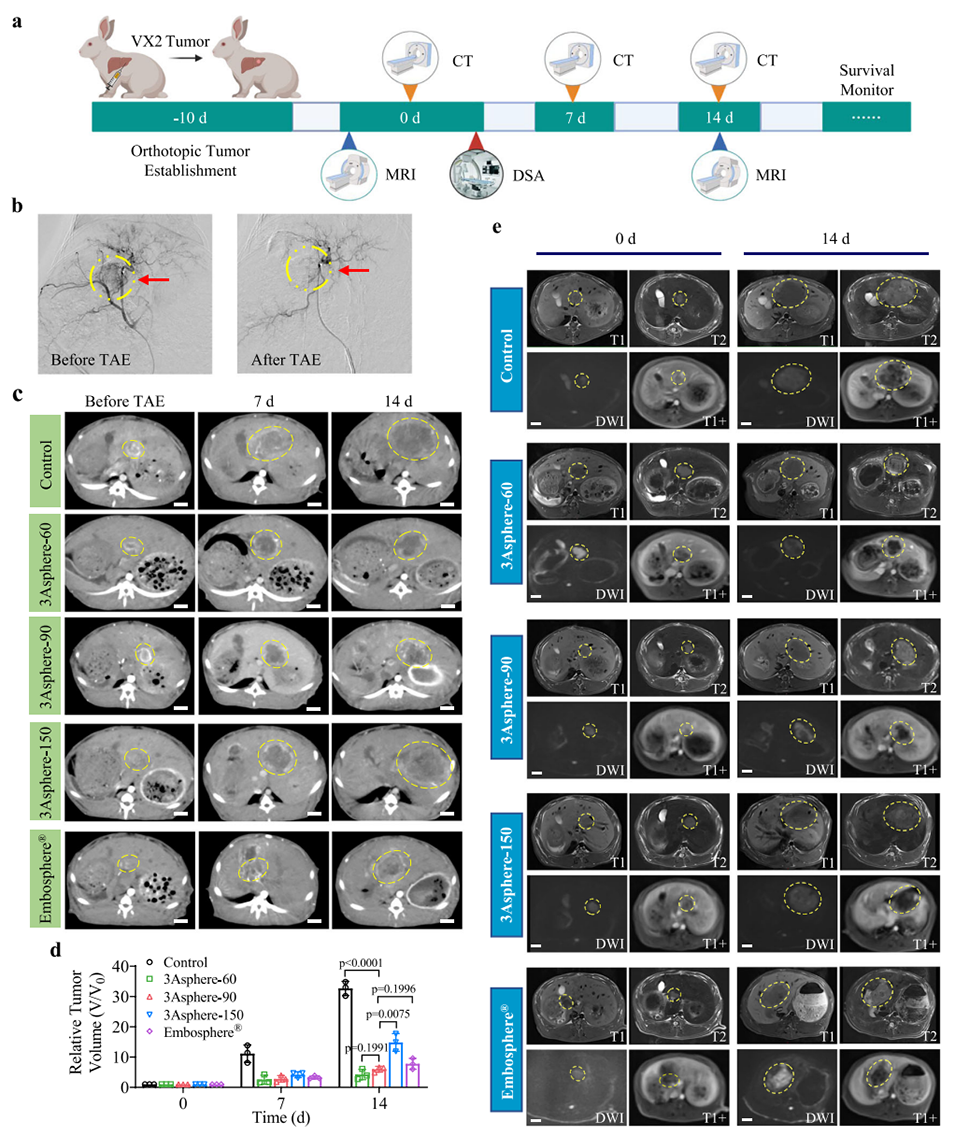
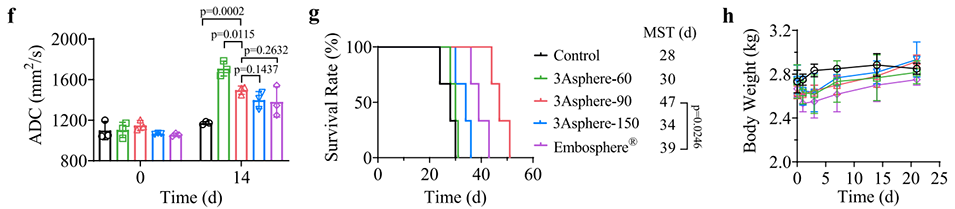
图4. 3Asphere尺寸对兔VX2肿瘤经动脉栓塞(TAE)治疗效果的影响
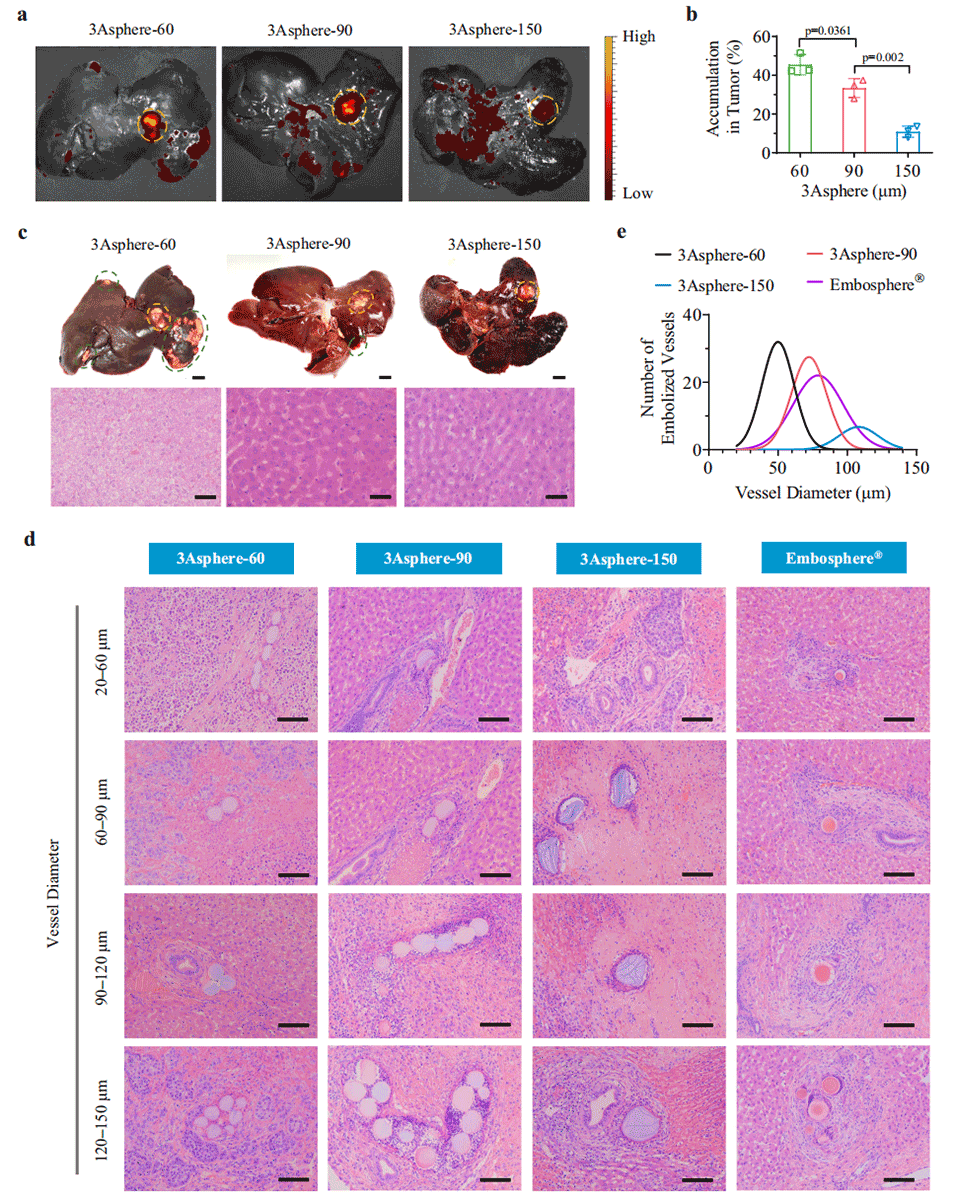
图5. 兔VX2肿瘤栓塞后3Asphere在肝脏、肿瘤组织及血管中的分布

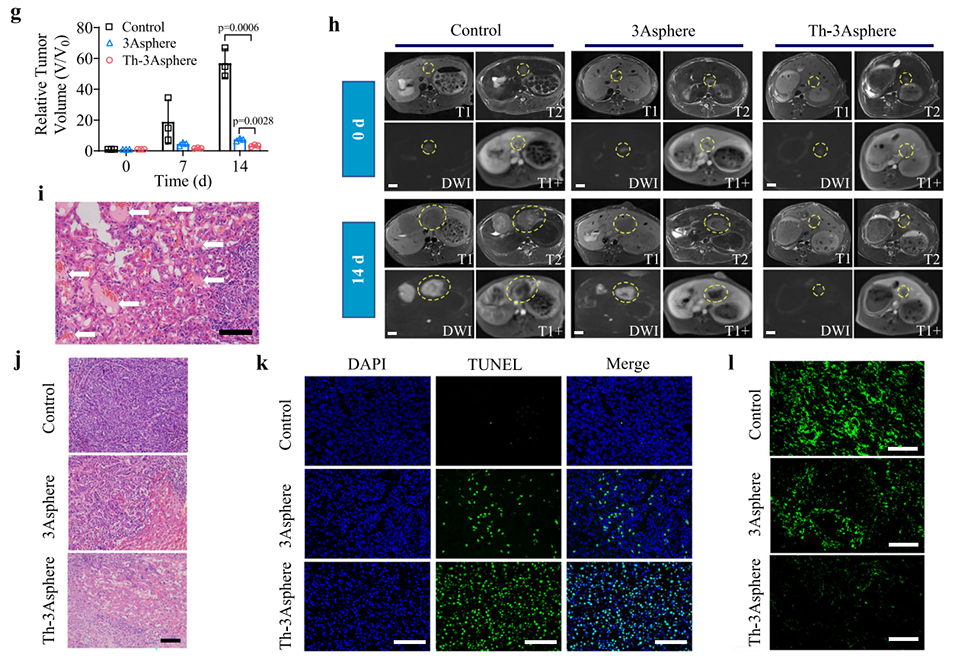
图6. 载凝血酶3Asphere(Th-3Asphere)的体内栓塞效果
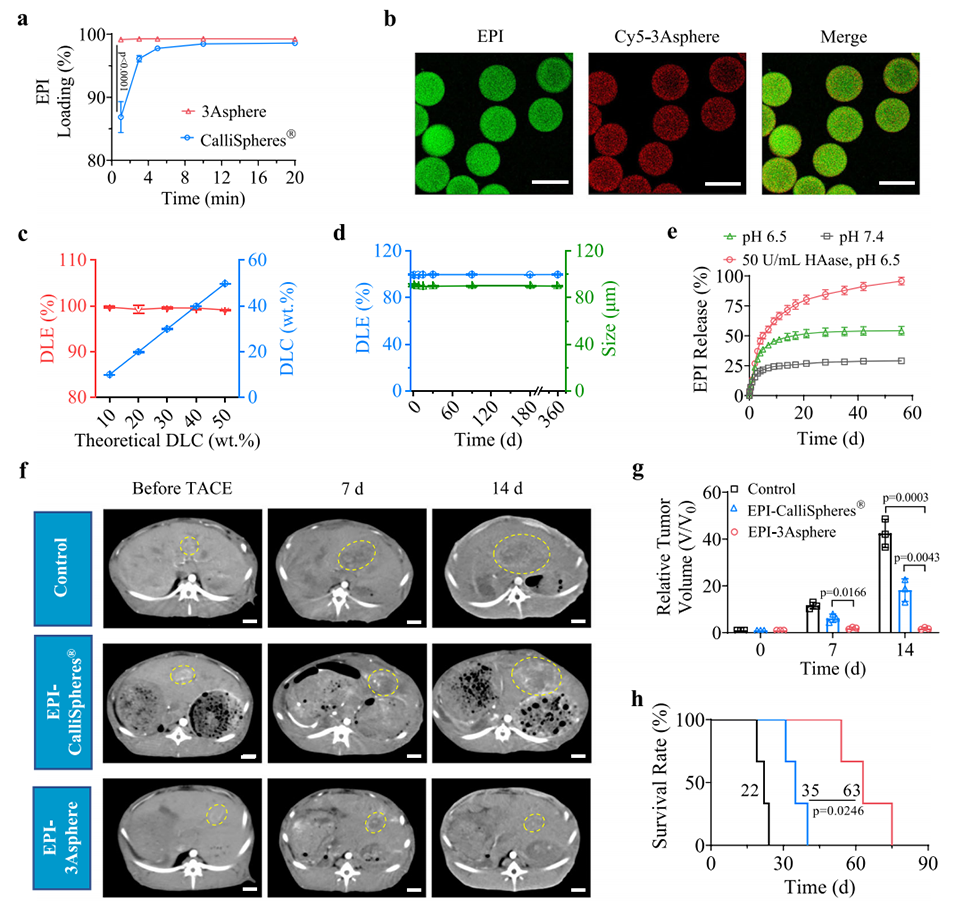
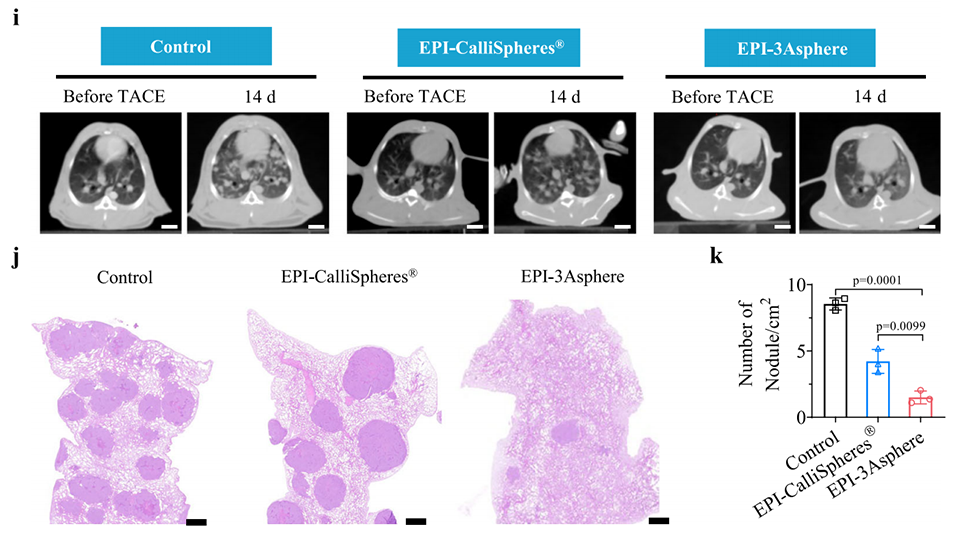
图7. 载表柔比星3Asphere(EPI-3Asphere)用于经动脉化疗栓塞(TACE)治疗
论文链接:https://doi.org/10.1038/s41467-025-61621-4
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














