周围神经损伤,可能会导致神经横断或长节段缺损,目前仍然是一个具有挑战性的医学问题。将神经引导导管(NGC)与神经营养因子的递送相结合是一种很有前途的周围神经缺损治疗方法。

近期,新疆医科大学第一附属医院艾合买提江·玉素甫教授团队成功构建了一种由定向多孔壳聚糖-胶原蛋白(CH-CO)导管与微流控技术制备的载胶质细胞源性神经营养因子(GDNF)复合微球(CP-MSs)相结合的新型修复系统。该系统不仅能提供引导轴突定向生长的物理支架,还可持续释放神经营养因子长达六周,在大鼠坐骨神经缺损模型中有效促进了轴突再生、髓鞘化及功能恢复,其修复效果与自体神经移植相当。相关研究以“GDNF-loaded composite microspheres enhanced porous-oriented conduits for peripheral nerve regeneration”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、针对周围神经损伤修复的难题,本研究开发了一种结合定向多孔神经导管(POC)与载胶质细胞源性神经营养因子(GDNF)复合微球(CP-MSs)的新型治疗策略。
2、该POC由静电纺丝PLGA外鞘和定向冷冻干燥的壳聚糖-胶原蛋白(CH-CO 1:1)内核构成,具备适宜的孔隙率、降解性和机械强度,在体外表现出良好生物相容性。
3、通过微流控技术制备的CP-MSs粒径均一(73.2 ± 4.5 μm),包封率和载药量高,能持续释放具有生物活性的GDNF达6周,并有效促进PC12细胞分化。
4、在大鼠坐骨神经10毫米缺损模型中,植入该复合导管系统显著促进了轴突髓鞘化、纵向生长及功能恢复,证实其在周围神经再生中具有良好应用前景。
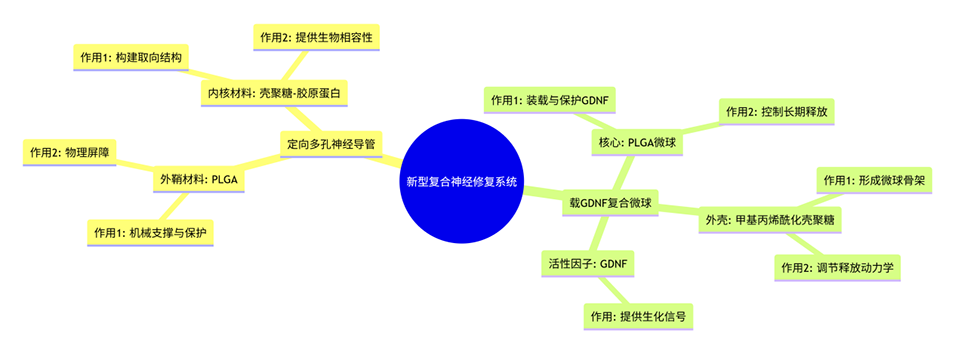
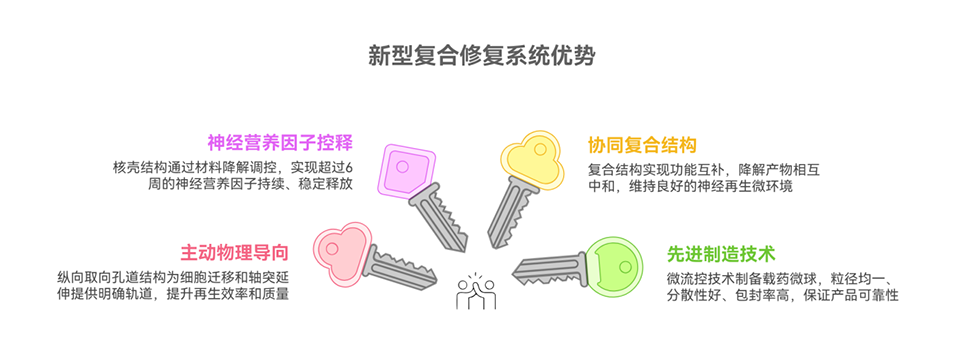
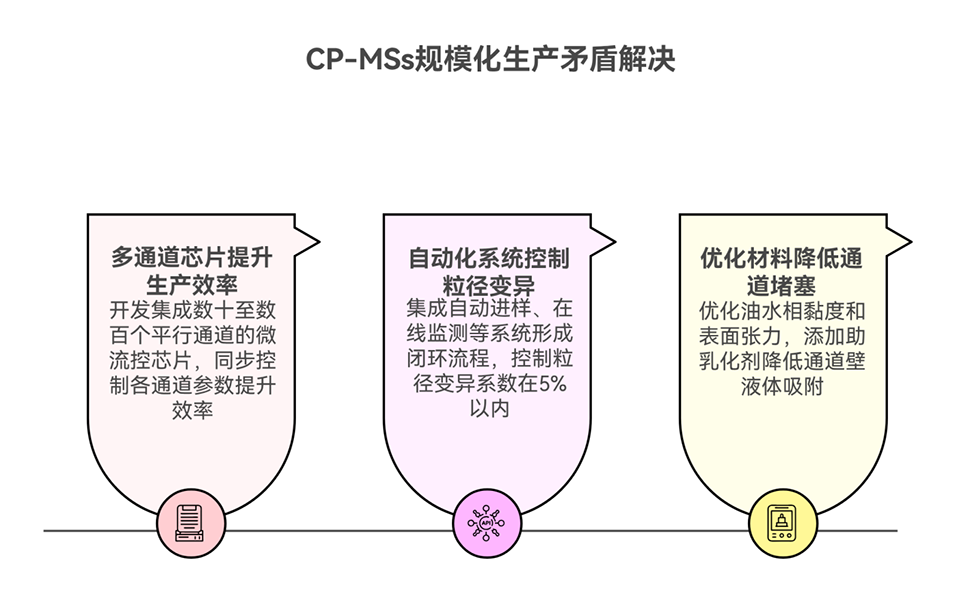
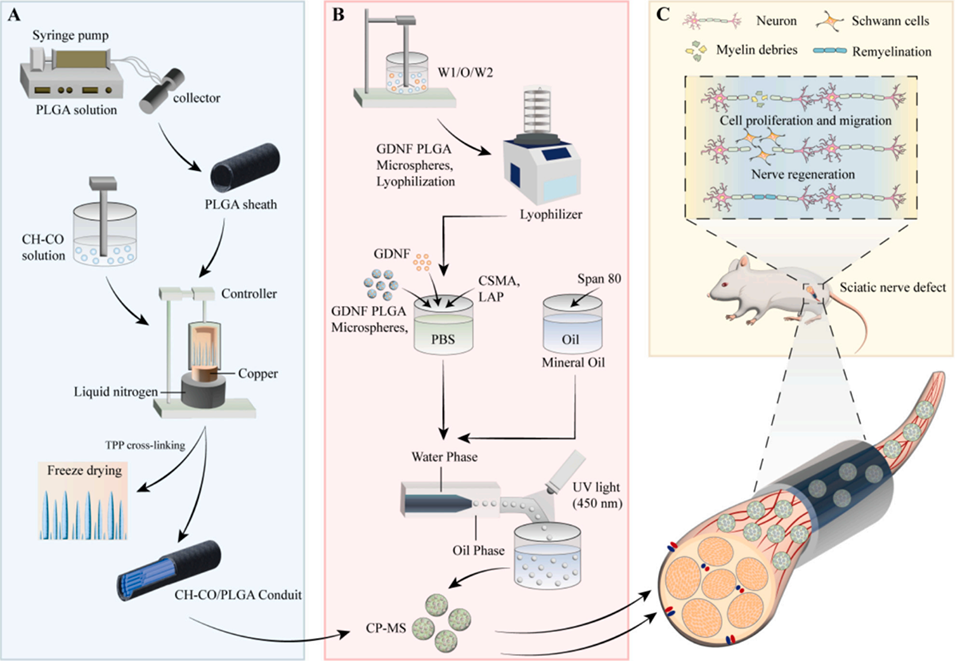
图1. 研究设计示意图。(A)壳聚糖-胶原蛋白(CH-CO)/聚乳酸-羟基乙酸共聚物(PLGA)导管的制备流程;(B)载胶质细胞源性神经营养因子(GDNF)的甲基丙烯酰化壳聚糖/PLGA复合微球(CP-MSs)的制备流程;(C)CH-CO/PLGA导管联合CP-MSs修复大鼠坐骨神经缺损的示意图
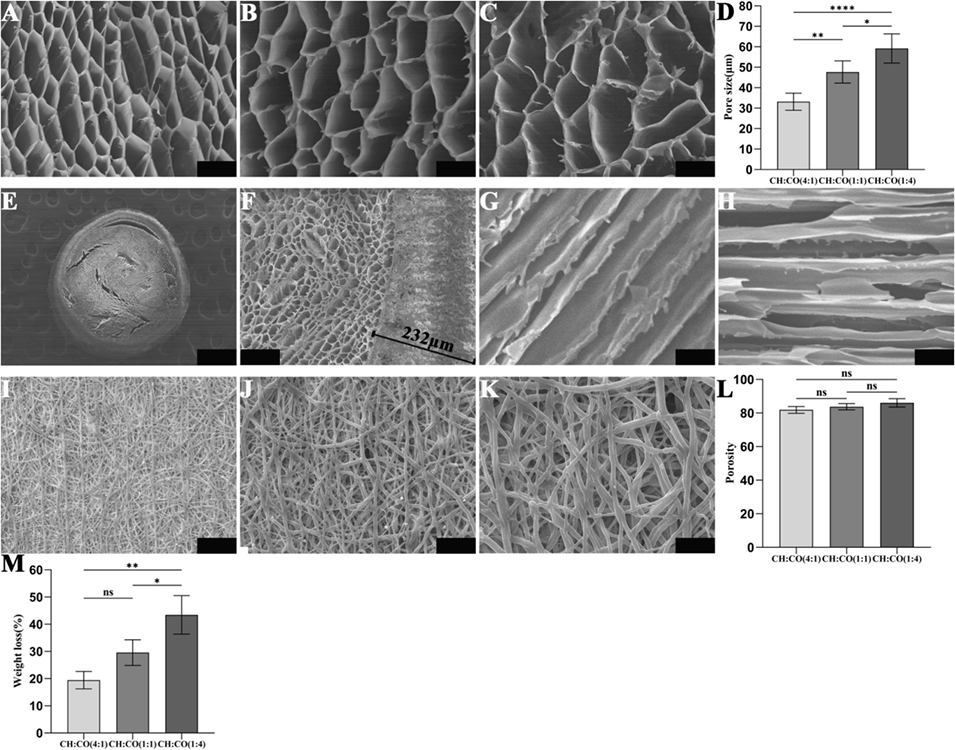
图2. 壳聚糖-胶原蛋白(CH-CO)填充物与PLGA鞘的表征及扫描电子显微镜(SEM)图像
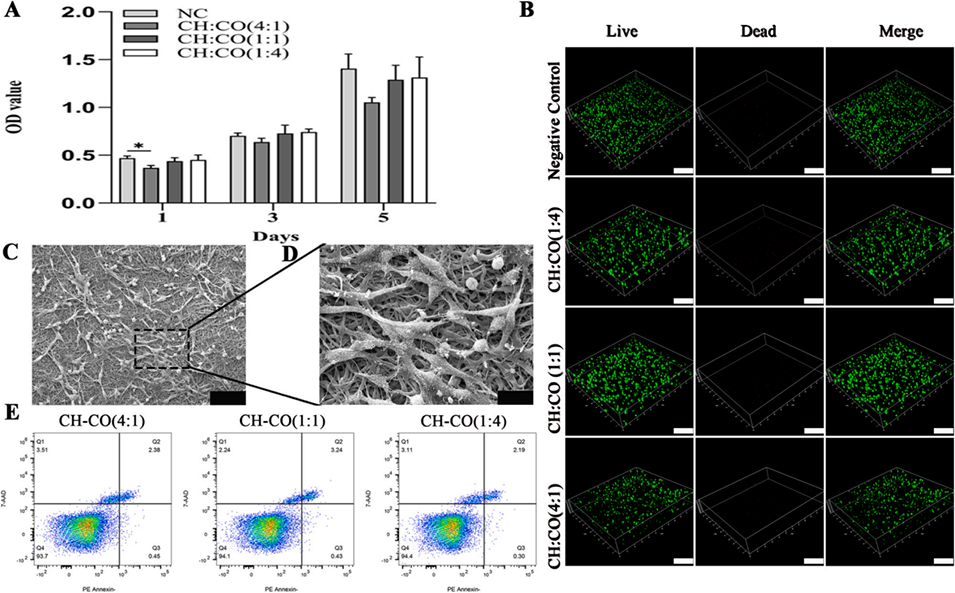
图3. 壳聚糖-胶原蛋白(CH-CO)/PLGA导管的体外生物相容性
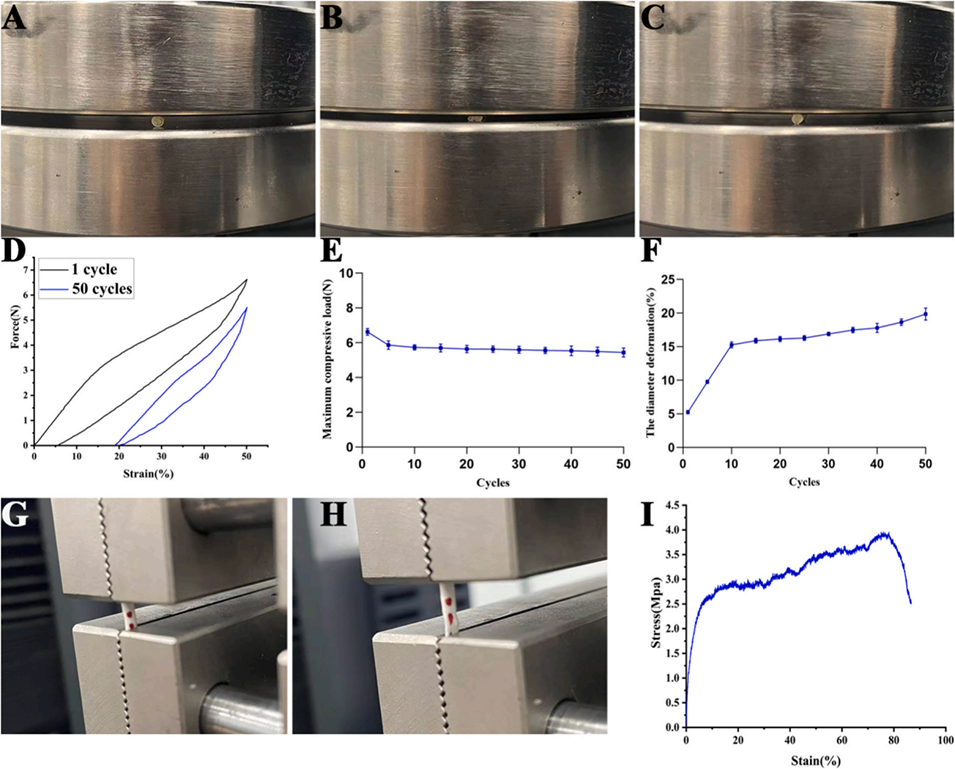
图4. 壳聚糖-胶原蛋白(CH-CO)1:1/PLGA导管及PLGA鞘的力学性能
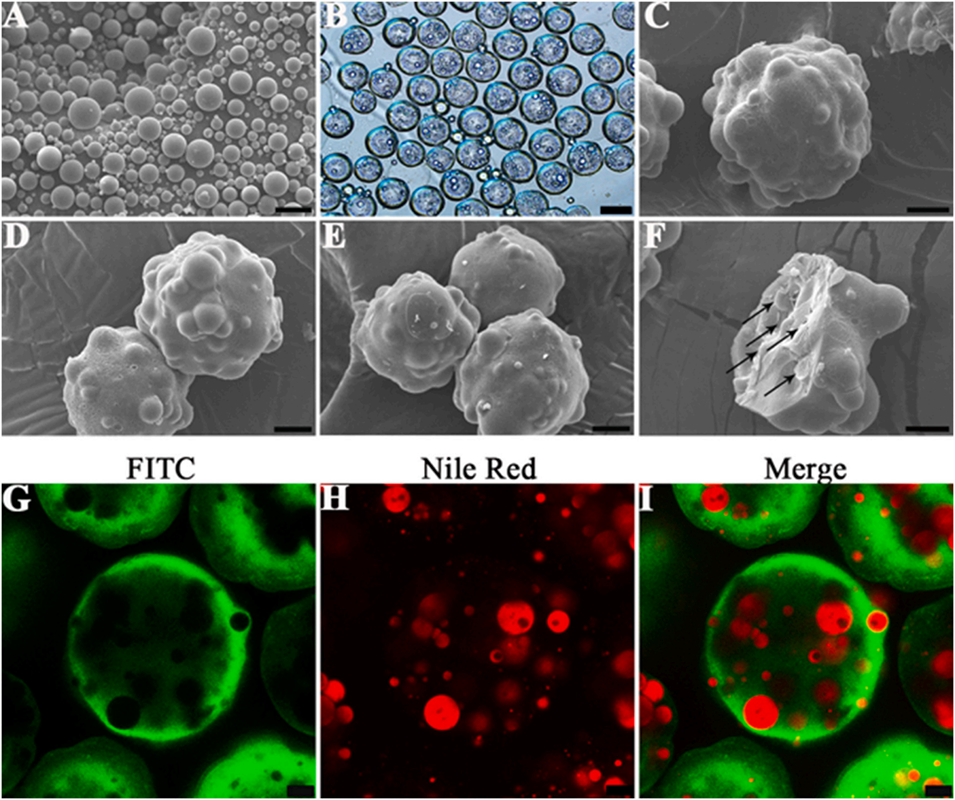
图5. 复合微球(CP-MSs)的表征
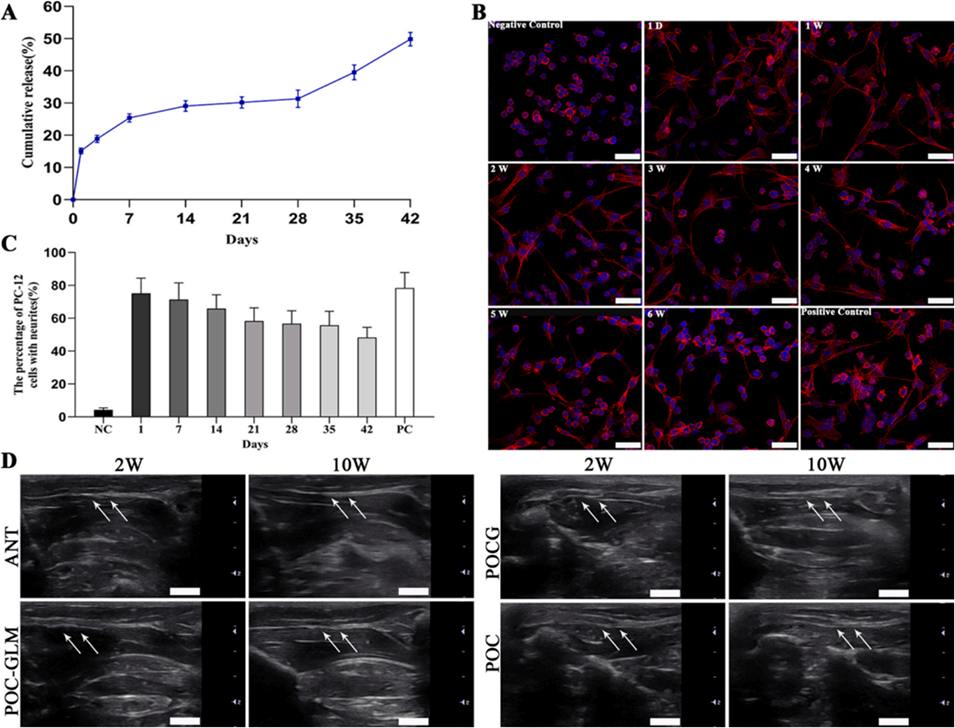
图6.(A)复合微球(CP-MSs,直径73.2±4.5μm)的体外释放曲线,样本量n=5;(B)激光共聚焦显微镜(LSCM)下PC12细胞的形态图像:分别用不含GDNF的培养基(阴性对照)、CP-MSs在1天及1-6周时的释放培养基、含50ng/mL GDNF的培养基(阳性对照)处理,比例尺=50μm;(C)PC12细胞的定量分析显示突起生长,样本量n=5;(D)手术侧坐骨神经与导管的彩色多普勒超声图像(箭头指示导管移植后神经再生区域),比例尺=500μm。数据以平均值±标准差(SD)表示
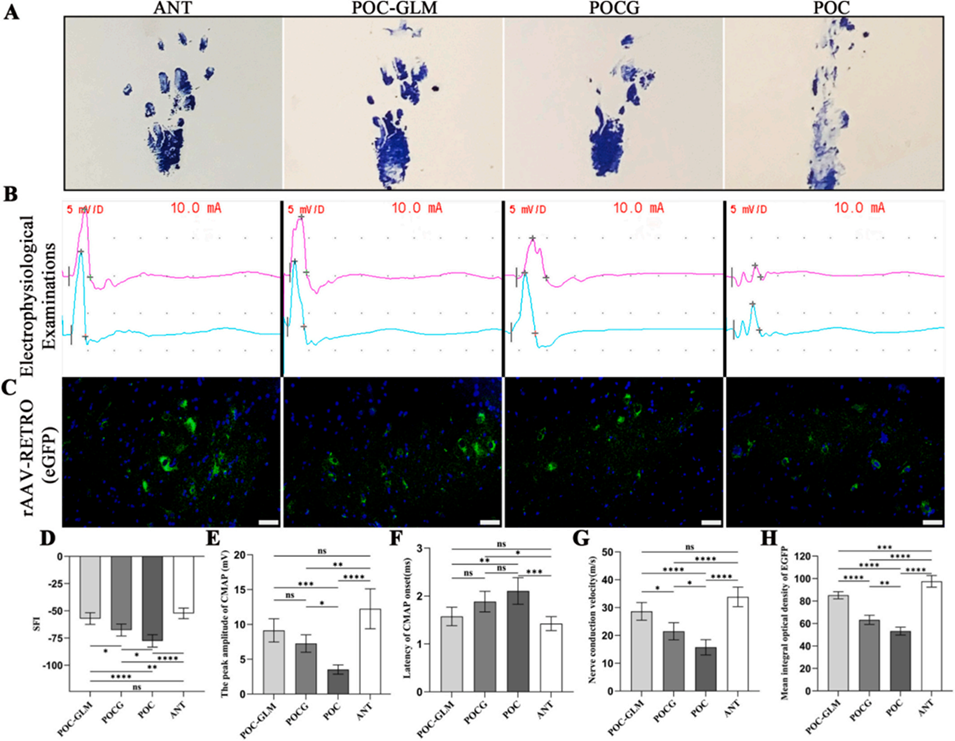
图7. 术后再生坐骨神经的功能恢复评估
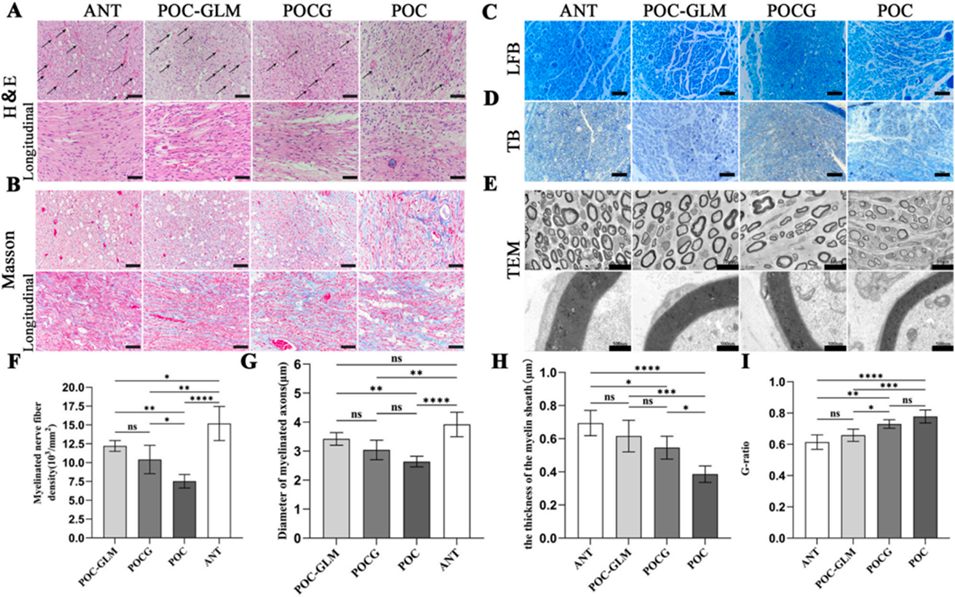
图8. 再生神经的组织形态学评估
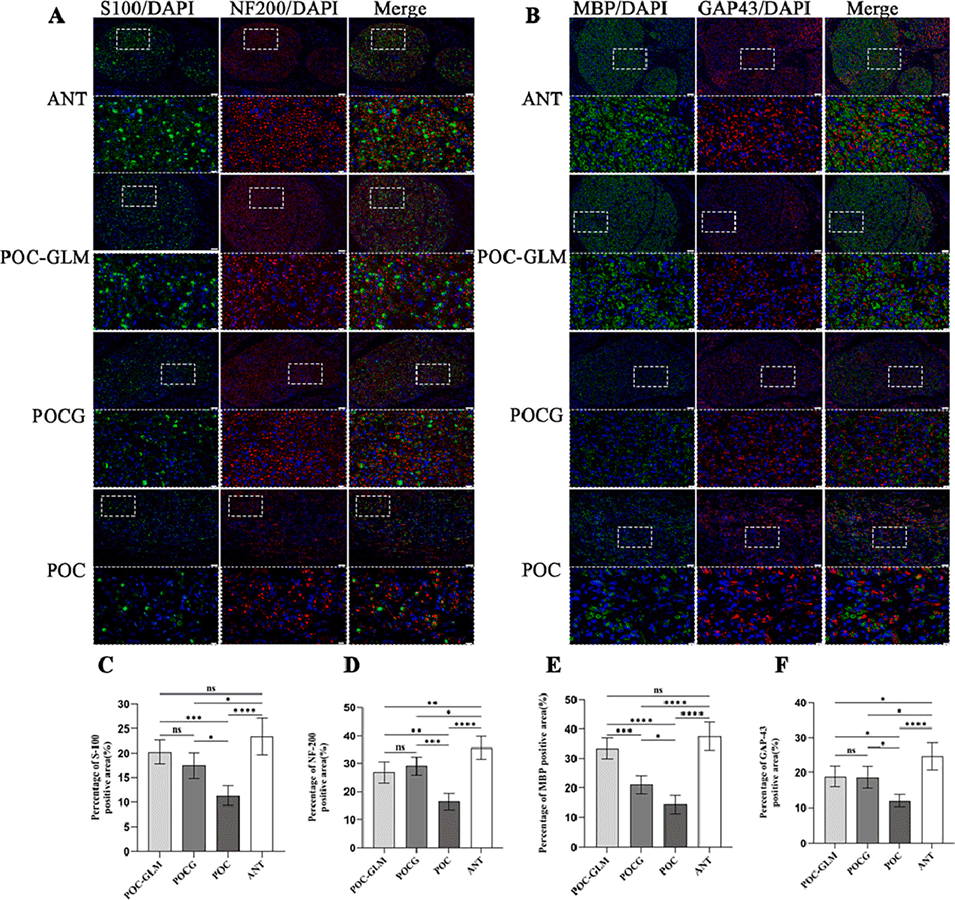
图9. 再生神经的免疫荧光分析
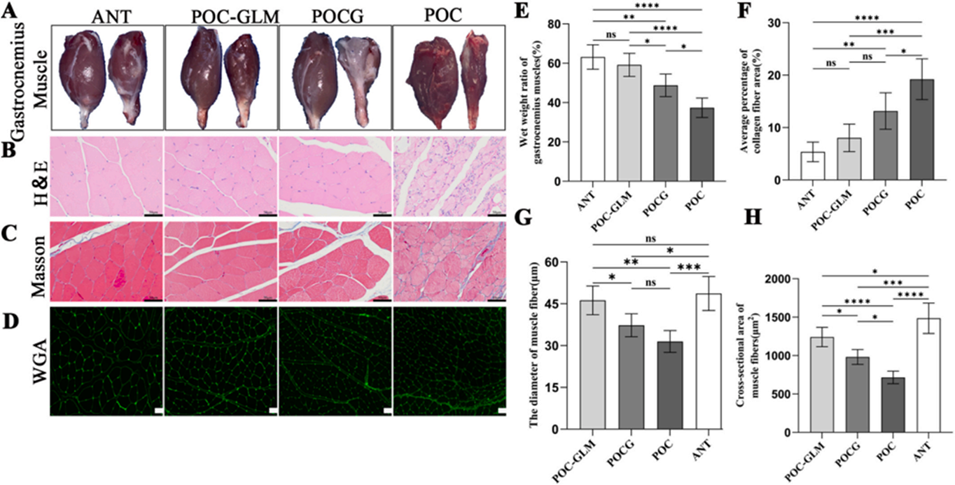
图10. 腓肠肌的组织学与形态学观察
论文链接:https://doi.org/10.1016/j.cej.2025.165574
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














