炎症性肠病(IBD)是一类慢性复发性肠道炎症疾病,主要涵盖克罗恩病与溃疡性结肠炎,患者常伴随腹痛、腹泻、体重下降等症状,严重影响生活质量。目前临床常用治疗手段(如抗炎药、免疫抑制剂)存在疗效有限、副作用显著、药物生物利用度低等问题;同时,具有抗炎潜力的天然抗氧化酶口服时易受胃部酸性环境与消化酶破坏,且在炎症肠道部位滞留不足,难以发挥有效治疗作用。因此,开发安全、稳定且能实现药物靶向递送的新型口服给药系统,成为攻克IBD治疗难题的关键方向。

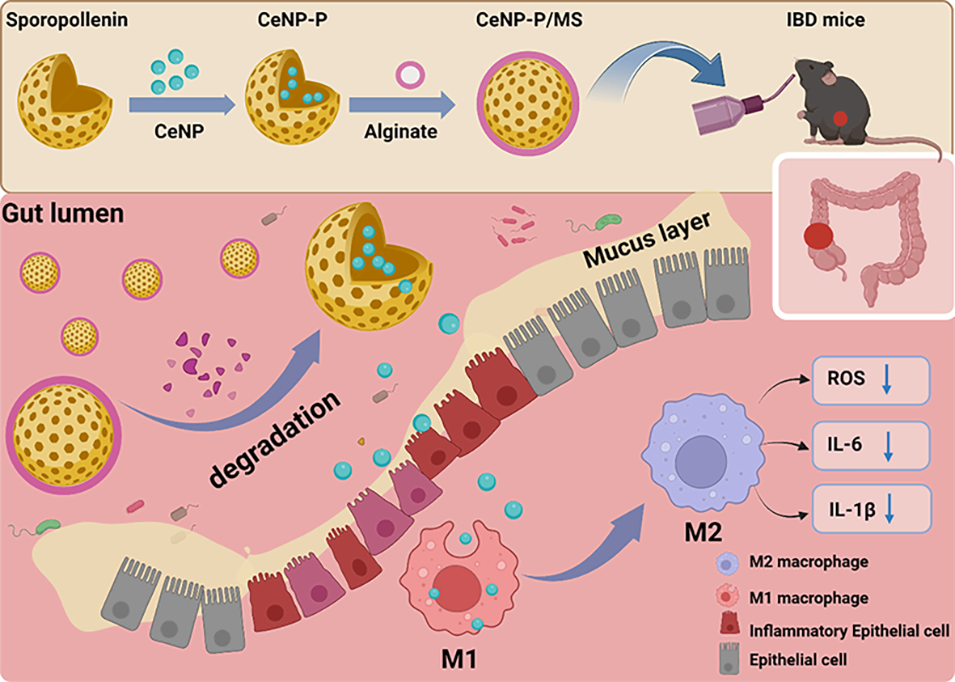
近期,南通大学附属医院顾志峰教授、朱玉娟研究员团队针对上述难题,构建了负载氧化铈纳米酶的食用杂化孢子花粉素微球口服给药系统,该系统可实现药物在肠道的靶向释放与持续作用。相关研究以“Edible Hybrid Sporopollenin Microspheres with Nanozyme for Oral Treatment of Inflammatory Bowel Disease”为题,发表于期刊《ACS Applied Materials & Interfaces》。
本文要点:
1、本研究开发了一种基于孢子花粉素与氧化铈纳米酶(CeNP)的杂化微球口服递送系统(CeNP-P/MS),用于炎症性肠病(IBD)的治疗。
2、该系统利用微流控电喷雾技术将负载CeNP的孢子素封装于微球中,能有效抵御胃酸降解,并在肠道快速释放。
3、释放的CeNP可清除活性氧并抑制促炎细胞因子,发挥抗氧化与抗炎作用。
4、在DSS诱导的IBD小鼠模型中,CeNP-P/MS显著缓解了结肠缩短、体重下降等关键症状,促进肠道屏障修复与黏膜再生,并调节巨噬细胞向抗炎表型极化。
5、该可食用递送系统具有良好的生物相容性与靶向性,为IBD及其他肠道疾病的治疗提供了新策略。
在该研究中,氧化铈纳米酶(CeNP)通过 “两步层级封装” 策略被载入微球(最终形成CeNP-P/MS),核心是先将CeNP负载于孢子花粉素微囊,再通过微流控电喷雾技术将其进一步封装于海藻酸盐微球,具体过程如下:

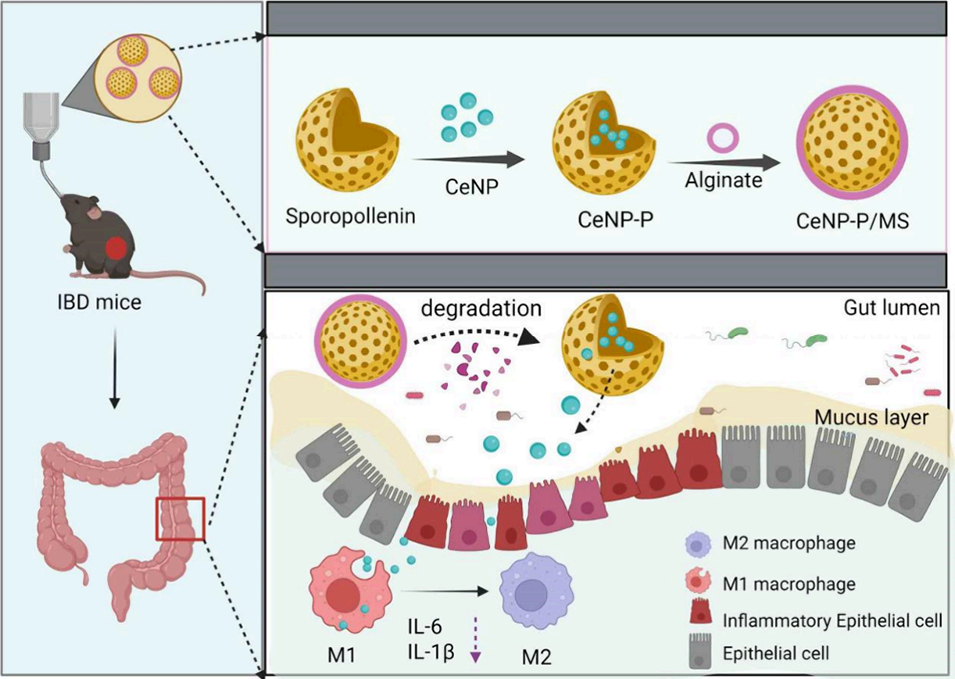
图1. IBD靶向治疗用微米-纳米层级给药系统的制备示意图。生物杂化CeNP-P系统由负载氧化铈纳米酶(CeNP)的孢子花粉素构成,随后通过微流控电喷雾技术将其封装为CeNP-P/MS(负载CeNP-P的微球)。该CeNP-P/MS可实现IBD的口服治疗。
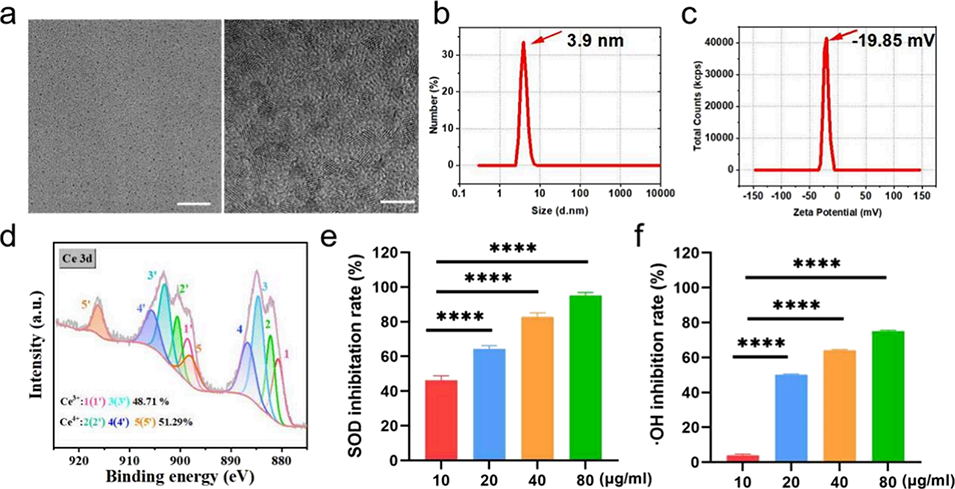
图2. 氧化铈纳米酶(CeNP)的形态与酶活性表征。(a)CeNP的透射电子显微镜(TEM)图像,比例尺:左侧20 nm,右侧5 nm;(b, c)CeNP的粒径分布(b)与zeta电位(c);(d)CeNP的X射线光电子能谱(XPS);(e, f)CeNP的超氧化物歧化酶(SOD)模拟活性与过氧化氢酶(CAT)模拟活性(n=3,n代表实验重复次数)。
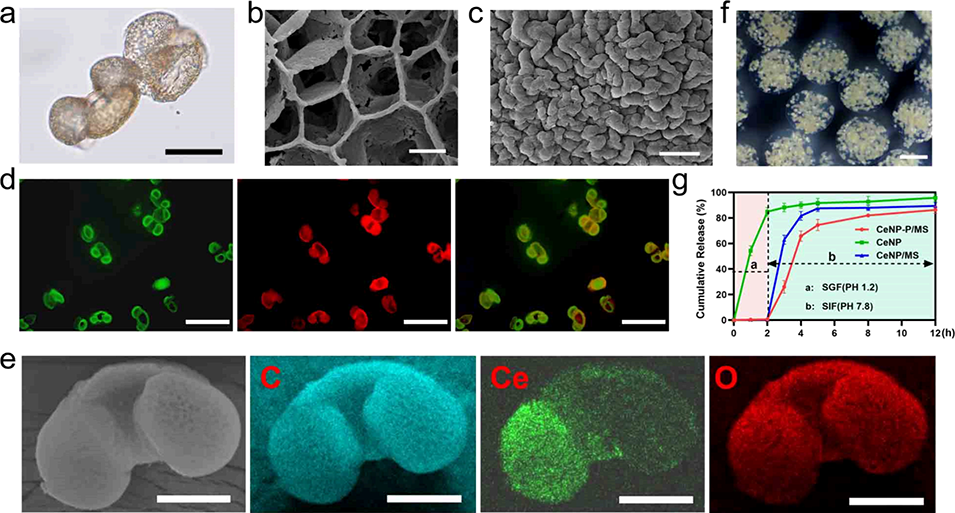
图3. 微米-纳米生物杂化系统的表征。(a)孢子花粉素微囊的明场图像,比例尺20μm;(b, c)孢子花粉素微囊的扫描电子显微镜(SEM)图像,比例尺2μm;(d)异硫氰酸荧光素(FITC)标记的CeNP(绿色)负载于空心松树孢子花粉素微囊(红色)的荧光显微镜图像,比例尺100μm;(e)CeNP-P的SEM-能量色散X射线光谱(EDX)元素映射图,绿色代表Ce元素,红色代表O元素,蓝色代表C元素,比例尺20μm;(f)CeNP-P/MS的明场图像,比例尺200μm;(g)CeNP-P/MS在pH 1.2(模拟胃液)与pH 7.8(模拟肠液)分散体系中CeNP的动态释放曲线。
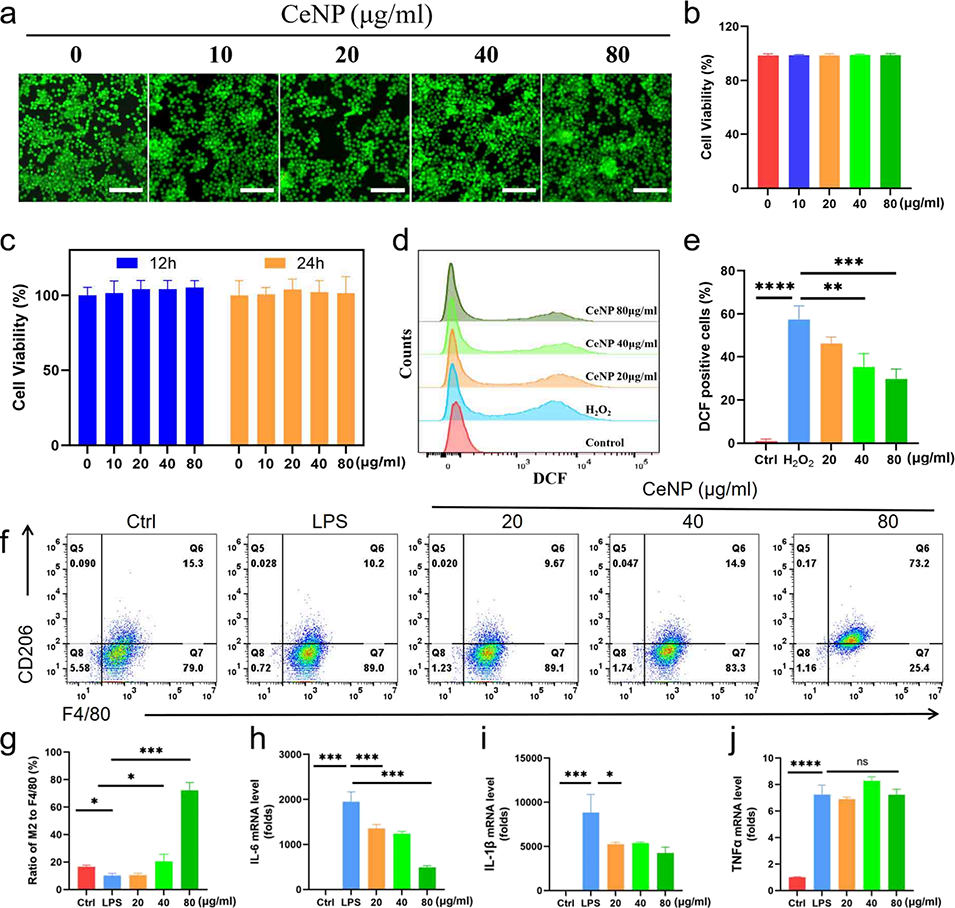
图4. CeNP的抗氧化与抗炎性能。(a, b)细胞活性的活/死染色结果(a)与分析(b),比例尺50μm;(c)Raw 264.7细胞(小鼠巨噬细胞系)与CeNP共孵育12h和24h后的细胞计数试剂盒-8(CCK-8)活性检测结果;(d, e)细胞内活性氧(ROS)水平的流式细胞术检测(d)与定量分析(e),比例尺200μm;(f, g)CeNP作用后F4/80+(泛巨噬细胞标志物)与CD206(M2型巨噬细胞标志物)的流式细胞术(FACS)分析(f)与定量分析(g);(h-j)CeNP作用后白细胞介素-6(IL-6,h)、白细胞介素-1β(IL-1β,i)与肿瘤坏死因子-α(TNF-α,j)的mRNA表达水平。所有数据均以“平均值±标准差”表示(n=3),统计学显著性标注:P<0.05、**P<0.01、***P<0.001。
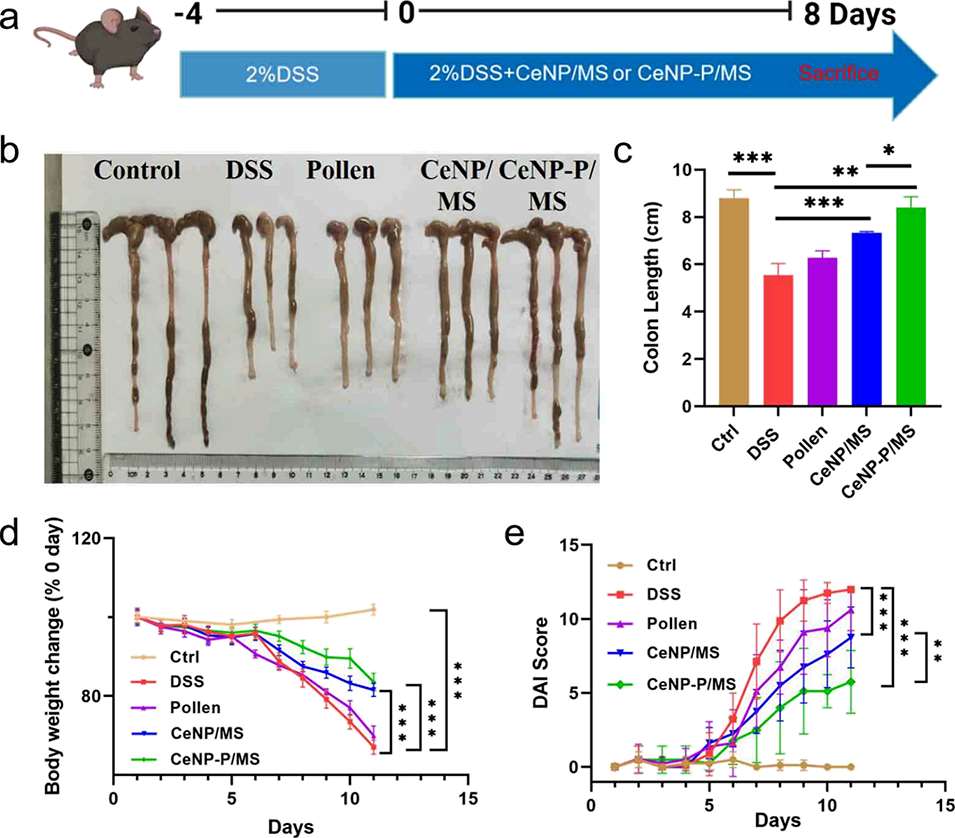
图5. CeNP-P/MS对葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠的治疗效果。(a)体内实验时间线;(b)不同处理组小鼠大肠的大体外观图像;(c)不同处理组小鼠肠长度的定量分析;(d)急性结肠炎小鼠经不同处理后的相对体重变化;(e)每日疾病活动指数(DAI,用于评估结肠炎严重程度)评分。
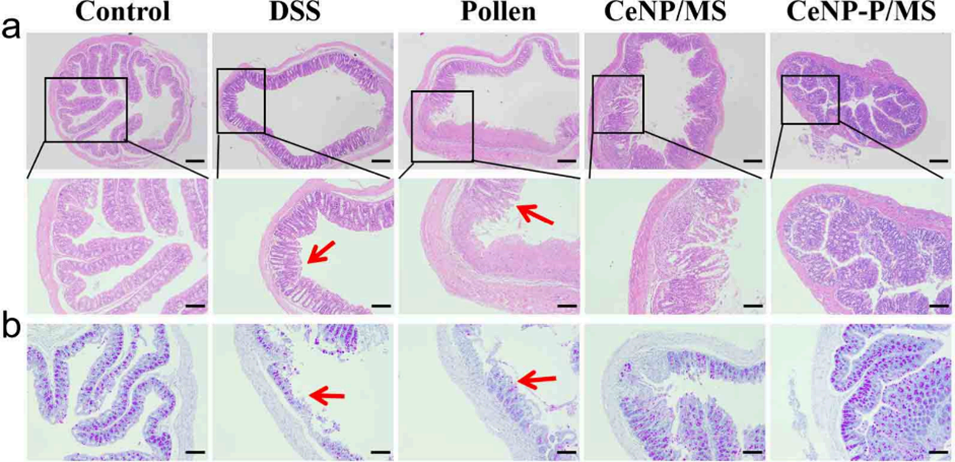
图6. CeNP-P/MS治疗后肠道组织的表征。(a)不同处理组小鼠大肠的苏木精-伊红(H&E)染色结果,箭头指示黏膜层坏死与隐窝结构紊乱,比例尺:左侧400μm,右侧300μm;(b)不同处理组小鼠肠道的过碘酸-希夫(PAS)染色结果,图像为代表性切片,酸性黏蛋白呈蓝色,中性黏蛋白呈品红色,箭头指示杯状细胞缺失与黏蛋白含量减少,比例尺400μm。
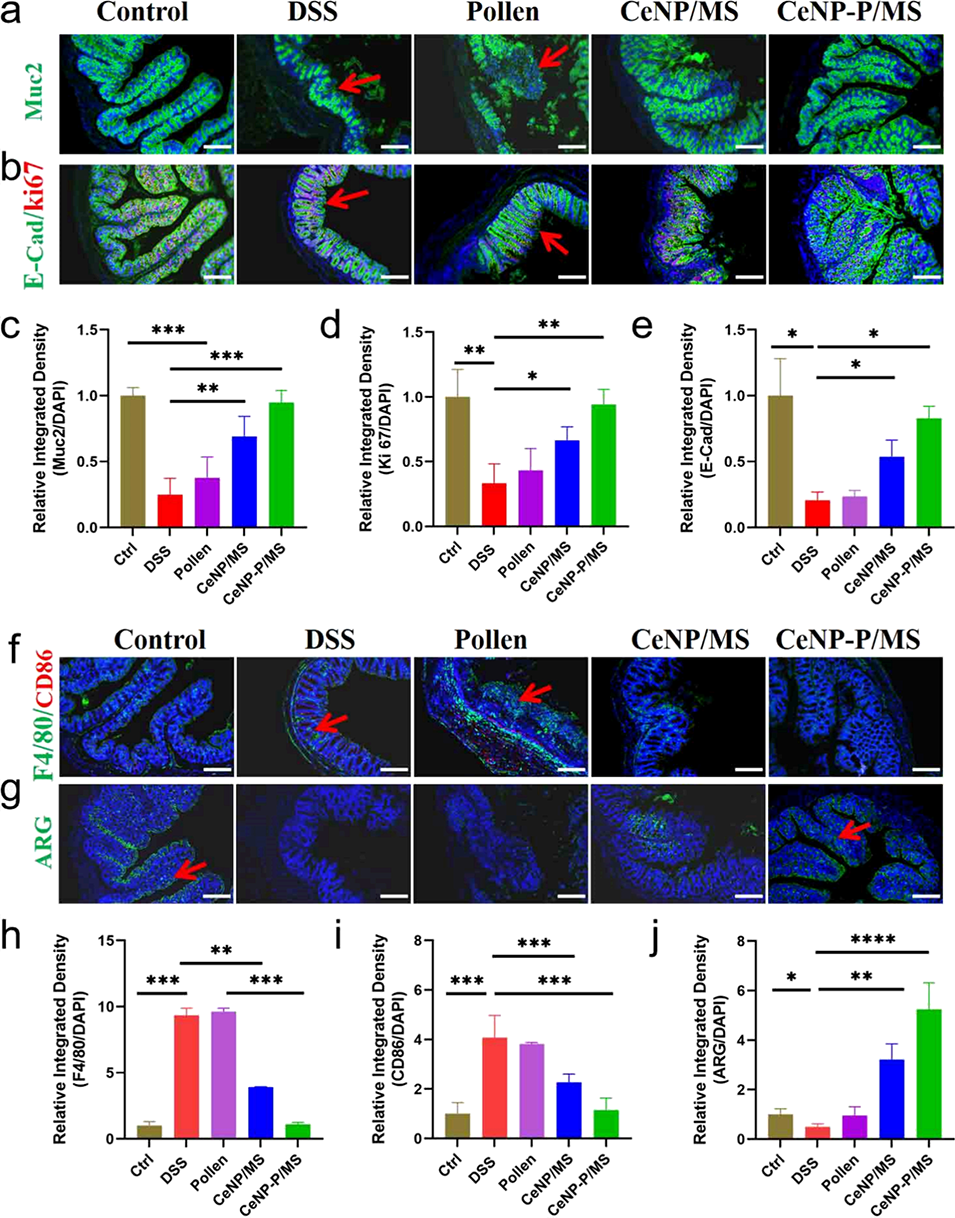
图7. CeNP-P/MS治疗后肠道组织的表征。(a, c)不同处理组小鼠肠道中黏液屏障标志物黏蛋白2(Muc2)的免疫染色结果(a)与定量分析(c),绿色代表Muc2或E-钙黏蛋白(E-Cad),红色代表Ki67(细胞增殖标志物),蓝色代表细胞核;(b)不同处理组小鼠肠道中Ki67与E-钙黏蛋白的免疫染色结果;(d, e)肠道组织中Ki67与E-钙黏蛋白荧光信号的定量分析;(f, g)不同处理组小鼠肠道中巨噬细胞标志物的免疫荧光染色结果,绿色代表F4/80或精氨酸酶(ARG,M2型巨噬细胞标志物),红色代表CD86(M1型巨噬细胞标志物),蓝色代表细胞核;(h-j)不同表型巨噬细胞荧光信号的定量分析。所有图像比例尺均为400μm。
论文链接:https://doi.org/10.1021/acsami.5c08167
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














