
导读:
口服多糖铁复合物(UCP-Fe(III))易在胃酸环境中降解,导致生物利用度降低。鉴于此,浙江工商大学潘伟春教授、牛付阁副教授团队成功开发了一种具有核壳结构的海藻酸钠/壳聚糖水凝胶微球(PAC),该微球可通过pH响应性实现UCP-Fe(III)的胃部保护与肠道缓释,有效提升其口服生物利用度。相关研究以“pH-Responsive Sustained-Release Hydrogel Microspheres for the Protection, Delivery and Release of Oral Polysaccharide Iron”为题,发表于期刊《Journal of Agricultural and Food Chemistry》。
本文要点:
1、本研究开发了一种具有pH响应性的海藻酸钠/壳聚糖核壳水凝胶微球,用于UCP-Fe(III)的定向递送。
2、实验结果表明,提高海藻酸钠(SA)浓度可增强体系黏度和储能模量,改善微球机械稳定性。
3、在2.0% SA条件下,UCP-Fe(III)的包封率达94.41%,同时微球的硬度和咀嚼性也显著增强,这归因于较高的SA浓度促进了更致密的交联网络形成。
4、微球在模拟胃液(pH 2.0)中溶胀率低(467.33–588.50%),释放少(2小时仅12.14–23.48%);而在模拟肠液(pH 7.4)中迅速溶胀(800–962.17%),6小时内释放率达87.60–95.16%,表现出良好的pH响应与缓释特性。
PAC微球的pH响应性依赖于SA和CS的化学结构随pH变化的特性,具体机制如下:
1、胃部保护机制(pH2.0,SGF环境):
SA的羧基(-COO-)在酸性条件下质子化为-COOH,分子间静电斥力减小,网络收缩;
CS的氨基(-NH₂)质子化为-NH₃⁺,与SA的-COOH形成更稳定的聚电解质复合物,进一步致密网络结构;
双重作用使微球溶胀率低(33-588.50%),仅释放12.14-23.48%的UCP-Fe(III),避免其过早水解。
2、肠道缓释机制(pH7.4,SIF环境):
碱性条件下,SA的-COOH重新电离为-COO⁻,静电斥力显著增大,网络扩张;
CS的-NH₃⁺去质子化为-NH₂,与SA的静电作用减弱,网络孔隙增大;
微球溶胀率大幅提升(800-962.17%),UCP-Fe(III)通过扩散与网络溶蚀逐步释放,6小时内释放率达60-95.16%,实现缓释。
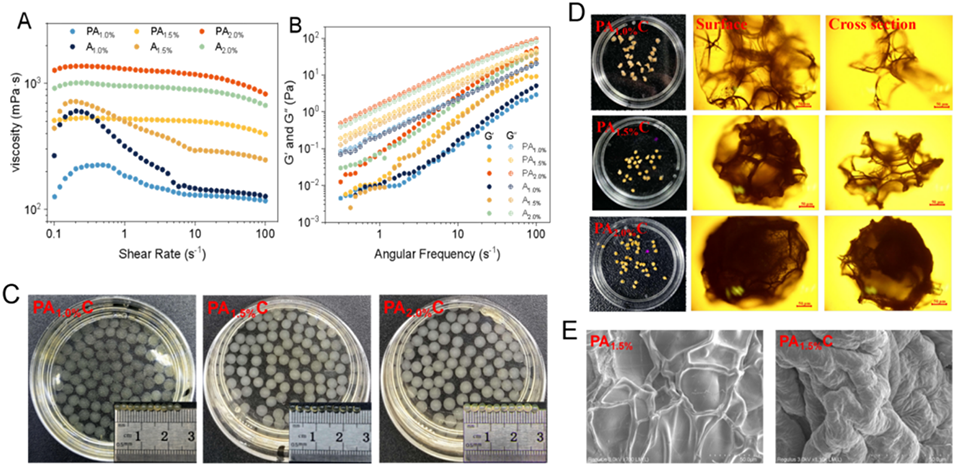
图1. SA浓度对水凝胶微球宏观形成与微观结构的影响。(A)不同浓度下,SA与UCP-Fe(III)混合体系的黏度变化。(B)不同浓度下,SA与UCP-Fe(III)混合体系的储能模量(G′)与损耗模量(G″)变化。(C)新鲜制备的PAC水凝胶微球外观。(D)冷冻干燥后PAC水凝胶微球的表面及截面光学显微镜图像(比例尺=50μm)。(E)PA1.5%与PA1.5%C冷冻干燥微球的SEM图像(放大倍数×500)。
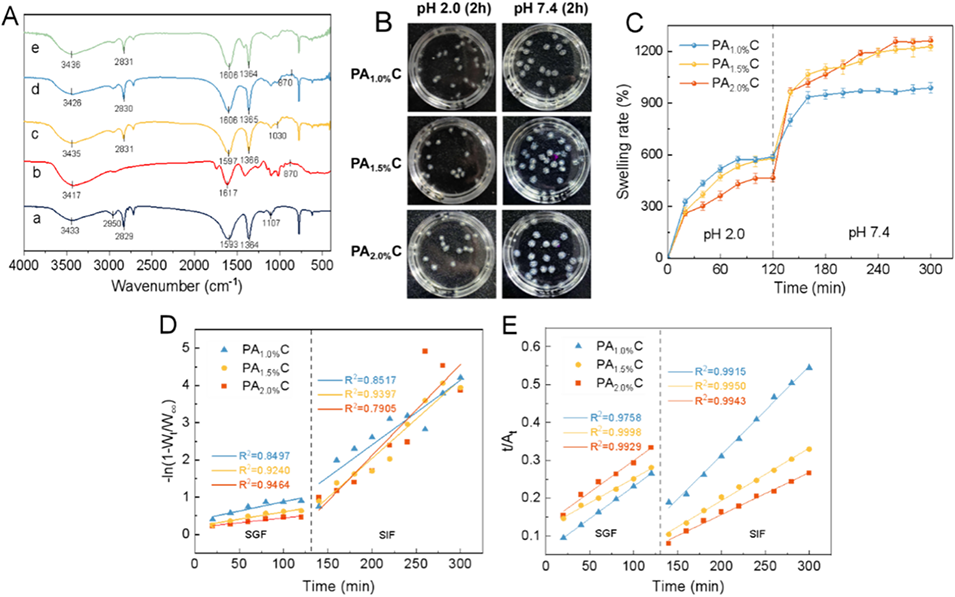
图2. PAC水凝胶微球的分子相互作用及pH响应性溶胀行为。CS(a)、UCP-Fe(III)(b)、SA(c)、PA1.5%C水凝胶微球(d)与A1.5%C水凝胶微球(e)的FTIR光谱(A)。PAC水凝胶微球在模拟胃液(SGF)与模拟肠液(SIF)中的溶胀行为:(B)微球在不同pH(2.0和7.4)模拟胃肠液中的外观变化及(C)溶胀率。PAC水凝胶微球溶胀动力学拟合曲线:(D)一级动力学拟合曲线,(E)二级动力学拟合曲线。
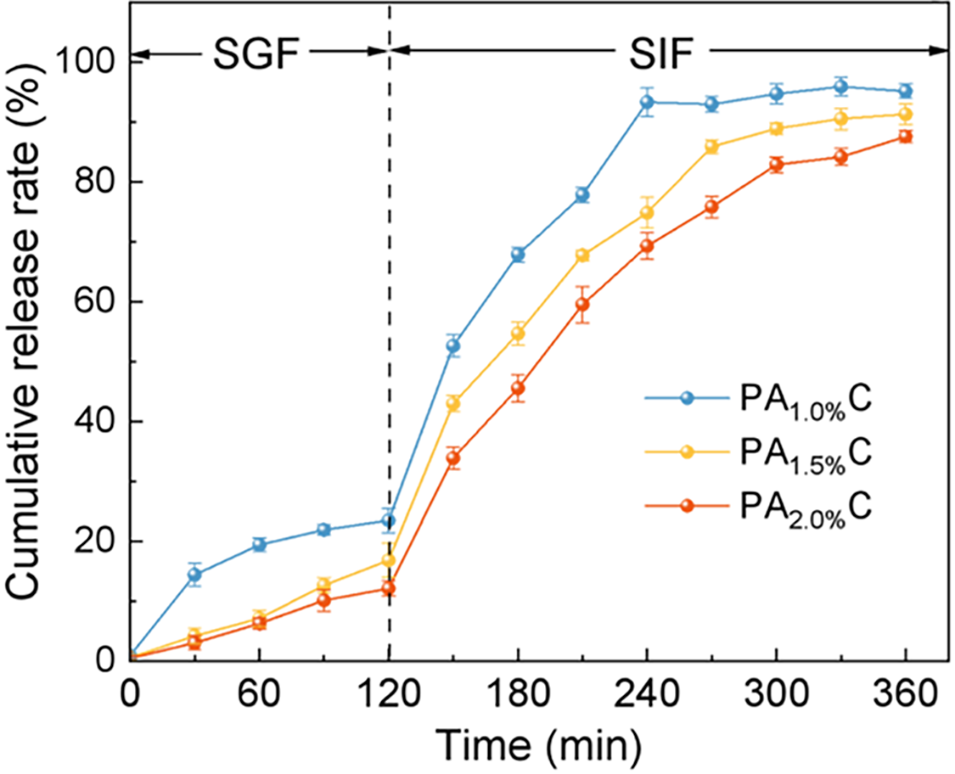
图3. PAC水凝胶微球的体外模拟消化与释放行为。
论文链接:https://doi.org/10.1021/acs.jafc.5c09576
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














