脂质纳米颗粒(LNPs)在疫苗研发、癌症治疗等领域展现出巨大应用潜力,是新一代基因递送的核心载体。然而,LNPs的配方设计涉及脂质组合、流速参数等众多变量,传统实验筛选方法效率低、成本高,严重制约了其研发进程。

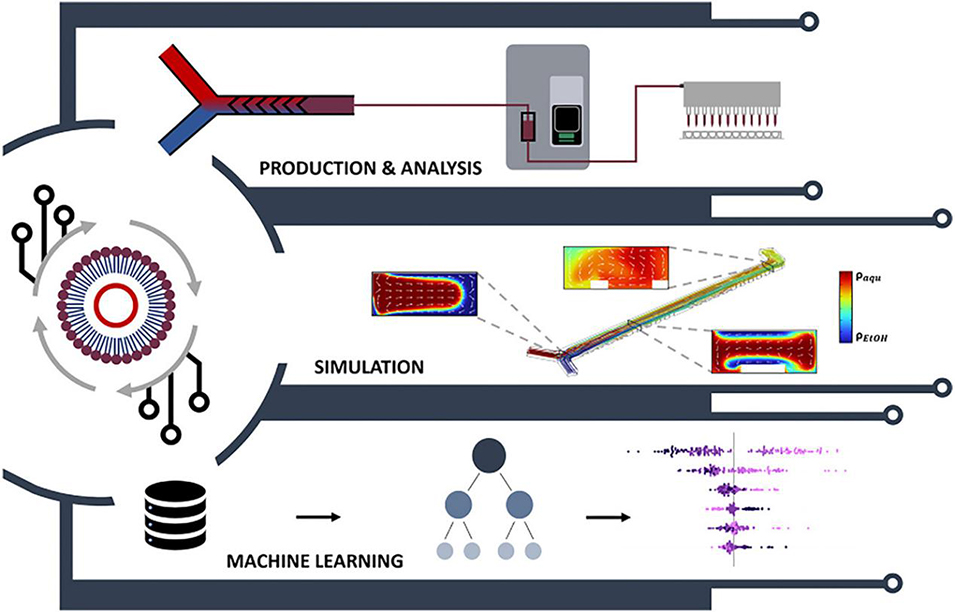
为解决这一难题,德国维尔茨堡大学、亚琛工业大学研究团队将计算流体动力学(CFD)模拟、机器学习与微流控技术相结合,开发出可自动优化脂质纳米颗粒(LNP)制备的自调节系统,该系统能精准调控LNP关键质量属性且无需人工干预,有效解决了传统LNP配方筛选成本高、效率低的问题。相关研究以“Self-regulating microfluidic system for lipid nanoparticle production”为题发表于期刊《Journal of Controlled Release》。
本文要点:
1、本研究提出了一种结合计算流体动力学模拟与机器学习的自调节微流控系统,用于自动化优化脂质纳米颗粒(LNP)的制备。
2、通过模拟人字形微混合器内的流体混合行为,分析了总流速和流速比对混合时间的影响,并实验验证了其对LNP粒径的作用。
3、利用自动化平台制备并表征了297个LNP样本,基于所收集的表征数据训练随机森林(RF)模型,成功预测了颗粒尺寸和包封率(EE)等关键质量属性。
4、通过沙普利加法解释(SHAP)分析确定总流速是影响粒径的最关键变量,脂质浓度和N/P比是影响EE的核心因素。同时构建分类模型,可快速筛选出“优质” LNPs(粒径< 120nm且EE>80%),准确率达88%。
5、将仿真与机器学习结果整合到微流控系统,以目标粒径为输入,系统自动预测初始配方参数,若制备的LNPs粒径偏离目标,最多3次循环即可使95%的LNPs达到目标粒径范围,无需人工干预。
该研究的创新点体现在哪些方面?
1、多尺度计算与实验的深度融合
结合计算流体动力学模拟与机器学习,从物理机制和数据驱动两个角度共同优化脂质纳米颗粒的制备过程。
通过CFD模拟揭示了微流控混合器中流体混合的动态过程,特别是混合时间对LNP尺寸的影响。
2、自调节微流控系统的实现
开发了一套具备反馈调节功能的微流控平台,能够根据实时测量的LNP尺寸自动调整总流速,实现“目标尺寸导向”的自动化制备。
系统在无人干预的情况下,最多经过3次尝试即可达到目标尺寸范围。
3、机器学习模型的可解释性与实用性
使用随机森林模型预测LNP的尺寸和包封率,并通过SHAP分析揭示各参数(如TFR、N/P比、PEG含量)对关键质量属性的影响。
不仅构建回归模型,还开发了分类模型,用于快速判断LNP是否满足“良好”标准。
4、对不同RNA载体的适应性研究
系统比较了Poly-A与eGFP mRNA作为模型载体时LNP制备的差异,强调了载体特性对最优工艺参数的影响,提示未来需针对不同mRNA定制工艺。
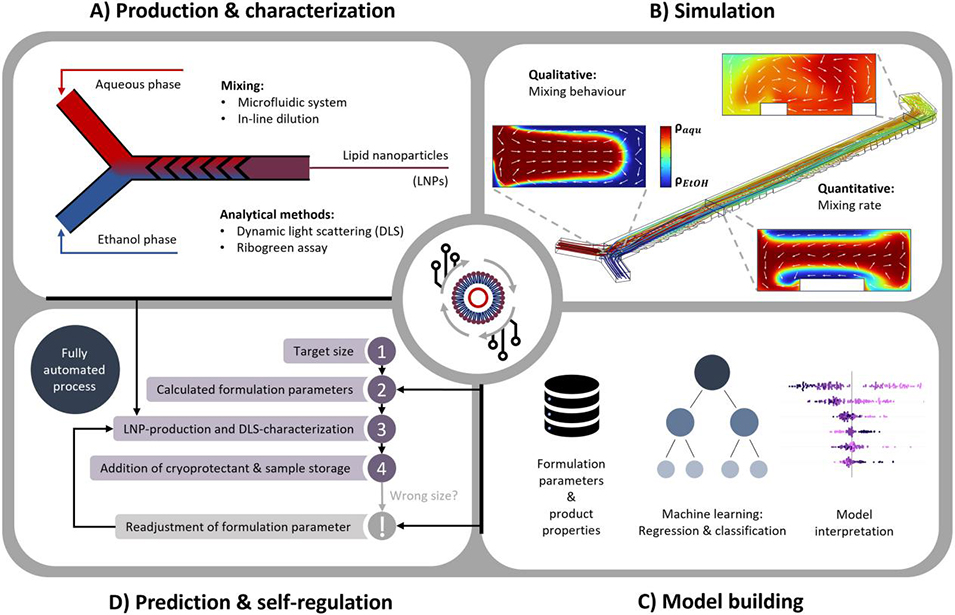
图1. 结合模拟与机器学习的自动化LNP制备与表征流程概览
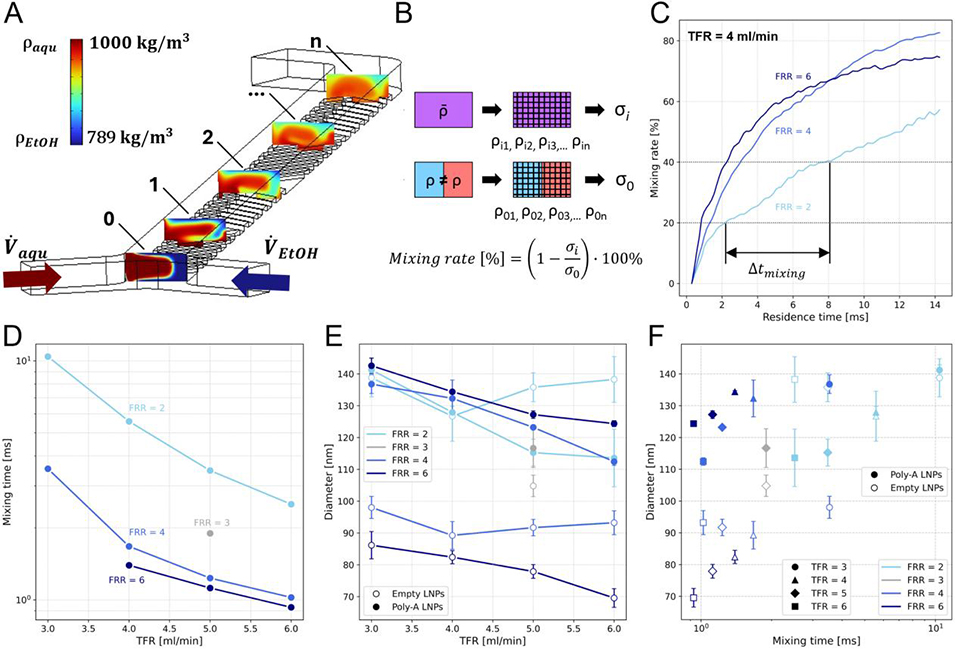
图2. 微流控人字形混合器混合模拟结果
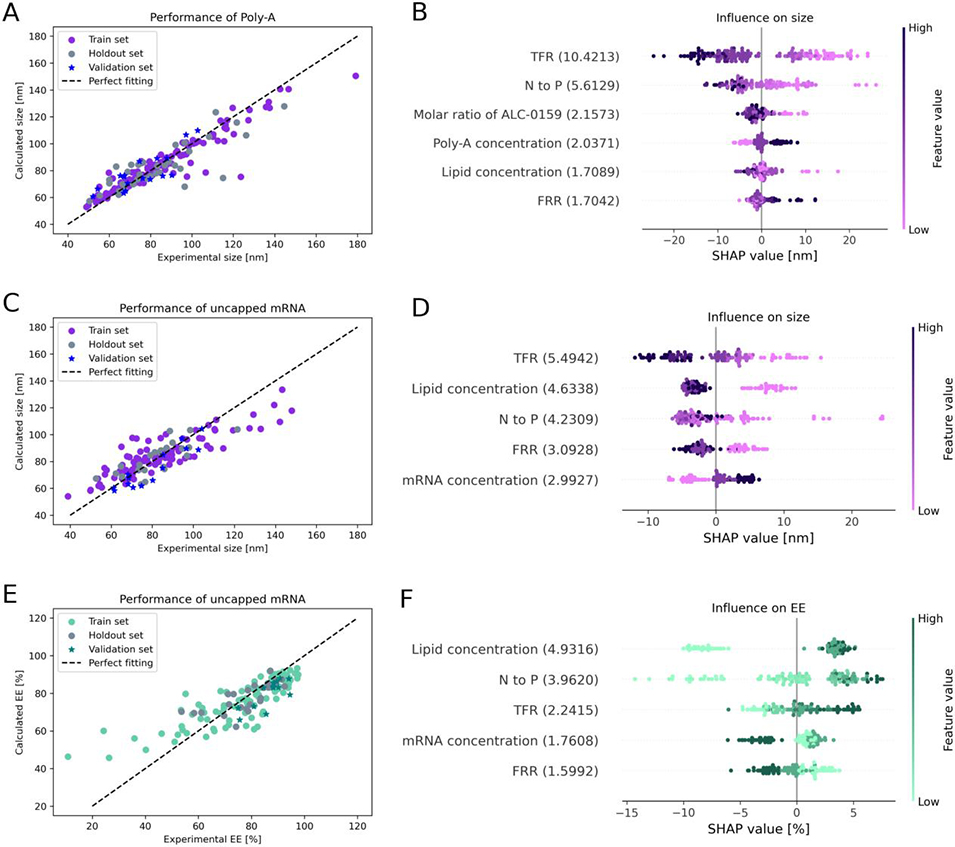
图3. 随机森林(RF)回归模型性能及特征重要性
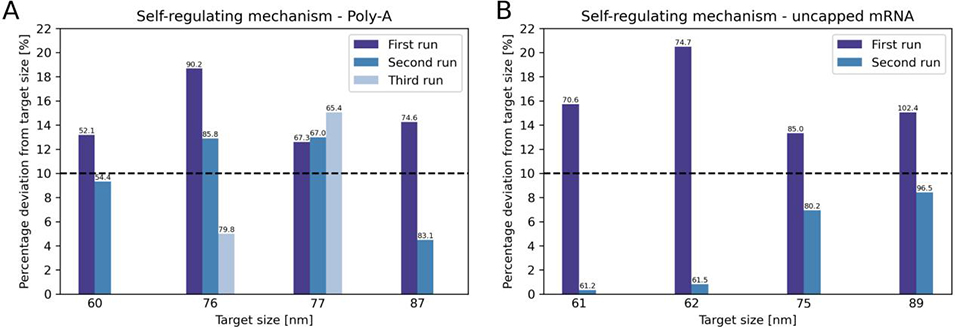
图4. 自调节机制制备结果
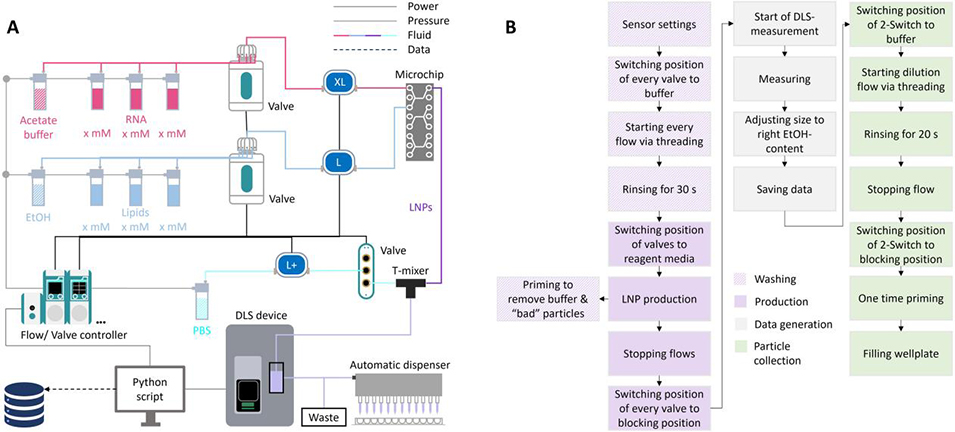
图5. 自动化LNP生产装置示意图
论文链接:https://doi.org/10.1016/j.jconrel.2025.114370
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














