脂质纳米颗粒(LNP)在基因治疗、免疫治疗及疫苗等领域应用广泛,但不同临床场景需定制脂质组成,且潜在LNP制剂数量庞大(超10¹⁵种),需大规模筛选验证。传统LNP制剂方法存在明显瓶颈:液体处理器易产生批次差异和颗粒异质性,现有微流控平台通量低(仅15-20种/小时)、需手动制备储备液,且难以实现从发现阶段到生产阶段的规模化衔接,严重限制了早期LNP制剂的筛选效率与临床转化进程。
近期,有研究人员开发了一种新型自动化、并行化的微流控平台LIBRIS,实现了脂质纳米粒库的高通量、可定制化制备,生成通量达每小时约1000种不同配方。该平台通过集成微流控芯片与自动化收集系统,不仅极大提升了筛选效率,还能在从发现到生产的全流程中保持混合条件一致,为脂质纳米粒的规模化研发与应用提供了关键技术支撑。相关研究以“Automated and Parallelized Microfluidic Generation of Large and Precisely Defined Lipid Nanoparticle Libraries”为题目,发表在期刊《ACS Nano》上。
本文要点:
1、本研究开发了名为LIBRIS的自动化、并行化微流控平台,可高效生成大规模、精确定义的脂质纳米颗粒(LNP)库,解决了传统LNP制备吞吐量低的瓶颈。
2、该平台每小时可生成约1000种不同LNP配方,速度较传统微流控方法快100倍,通过光刻编码流体电阻和动态压力调节,实现脂质成分比例的精准调控。
3、结合硅-玻璃微流控芯片与定制板式机器人处理系统,可自动收集产物至透析盒,支持从10μL到升级规模的生产,且保持混合条件一致。
4、研究人员对96种LNP配方进行了理化性质表征和体外转染效率测试,核心候选物在体内验证中表现优异,与现有优化配方相当。
5、该平台加速了LNP的早期发现与临床转化,可用于基因治疗、免疫治疗和疫苗开发等领域,同时为机器学习模型提供大规模训练数据,助力新型LNP配方的智能化设计。
LIBRIS平台如何实现LNP制剂的高通量与精准性?
高通量源于8个并行LNP生成器+动态压力控制,单次压力设置可生成8种制剂,压力响应时间<150ms,每4-5秒即可完成1种制剂收集;精准性依赖光刻编码流体电阻,可实现~1%的化学计量比分辨率,结合硅-玻璃芯片的结构稳定性,8个生成器的混合效率和流速比一致性高(R²=0.96),确保制剂理化特性可重复。
LIBRIS平台对纳米药物研发的核心贡献及未来应用场景是什么?
其核心贡献在于打破了LNP制剂生成的通量瓶颈,实现从10mL/h(发现阶段)到10L/h(生产阶段)的规模化衔接,解决了传统方法“发现与生产脱节”的问题;
未来应用场景包括——①新型LNP制剂高通量筛选(尤其是临床相关脂质组合);②为机器学习模型提供大规模、高质量的LNP组成-性能数据;③加速基因治疗、mRNA疫苗等纳米药物的研发周期,降低研发成本。
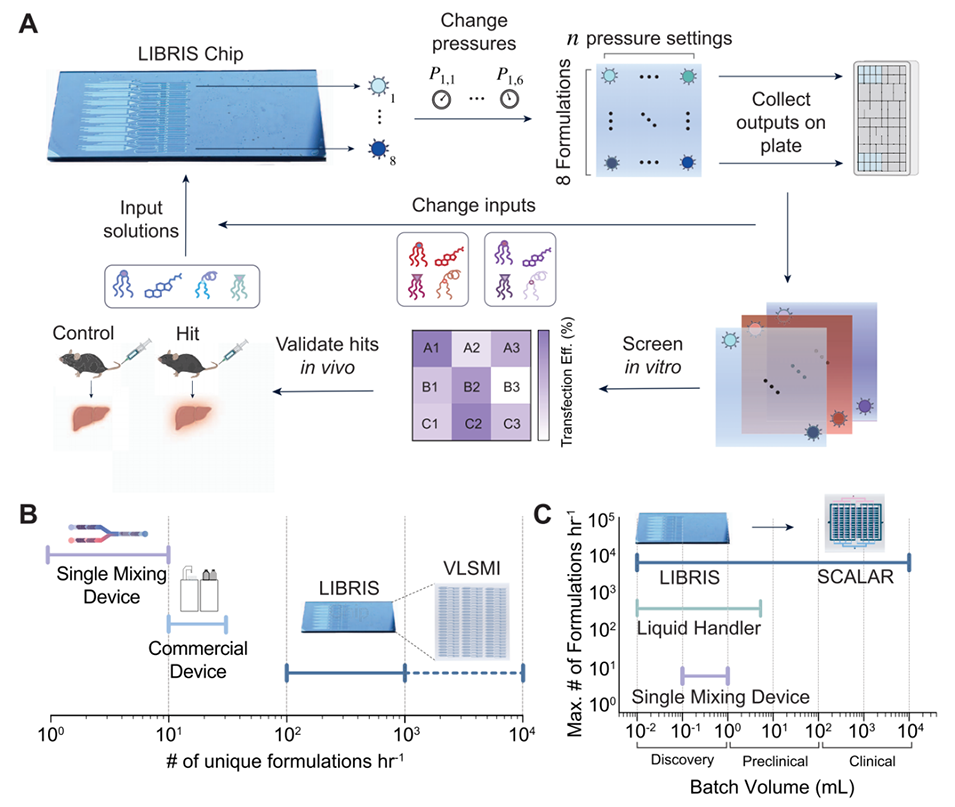
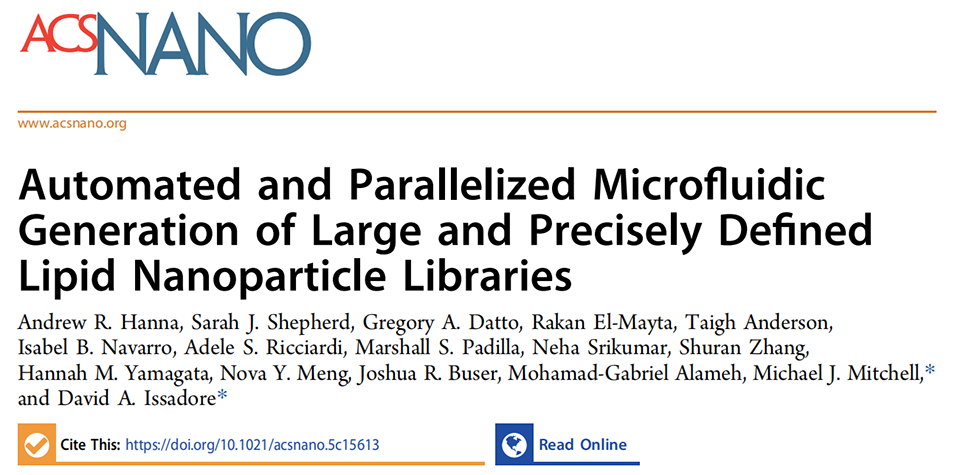
图1. 平台概览与性能对比。(A)展示利用LIBRIS平台迭代生成和筛选LNP库的整体流程,涵盖输入试剂、压力调控、产物收集及体内外筛选验证环节。(B)对比LIBRIS与其他商用微流控LNP制备设备的每小时独特配方生成量,LIBRIS最高可达10³级,且可通过超大规模微流控集成(VLSMI)进一步扩展。(C)呈现并行化微流控混合的规模不变性,以包含多个相同混合单元和电阻的SCALAR芯片为例,对比其他LNP制备混合技术在发现、临床前、临床阶段的批量体积适配能力。
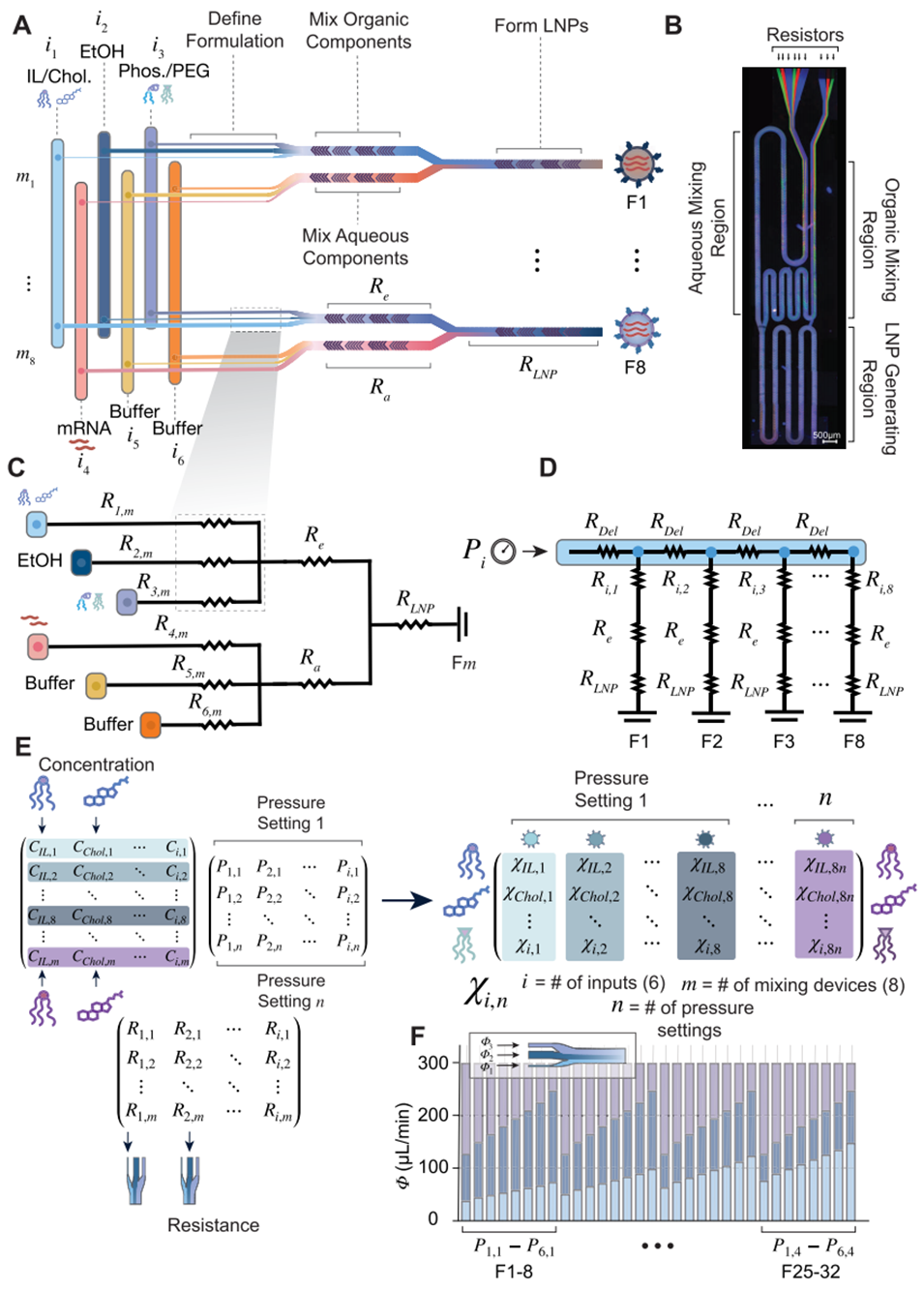
图2. LIBRIS芯片设计与制造。(A)芯片示意图,6个流体输入口(i1-6)的流体通过差异化编码电阻(Rᵢ,ₘ)分配至8个LNP生成器(m1-8),不同组合生成8种独特配方(F1−F8)。(B)单个混合单元的标注图像,展示有机相混合区、水相混合区及最终LNP生成区的结构。(C)单个设备的电阻网络电路图,(D)单个流体输入口的电阻网络电路图,明确电阻对流体分配的控制逻辑。(E)通过调节输入压力(Pᵢ,ₙ)和利用光刻定义电阻,结合不同脂质浓度组合,可生成8n规模的LNP库(n为压力设定次数)。(F)所有压力条件下,每个LNP生成器中乙醇相和水相的总流速保持一致,确保混合条件稳定。
图3. 芯片混合效率与流速验证。(A)制备完成的LIBRIS芯片实物图。(B)荧光染料流经芯片的成像图,i₁含离子化脂质和胆固醇,i₃含磷脂和PEG脂质,直观展示流体流动与混合过程。(C-E)分别量化芯片乙醇相、水相及组合混合区的混合效率,通过单因素方差分析(ANOVA)验证不同混合单元间混合效率无显著差异(P值均为1.0)。(F-G)通过成对距离分析,对比各混合单元的假设流速比与实际流速比。(H)曼特尔检验验证流速比的预测值与实际值相关性极强(R²=0.96,P=0.001)。
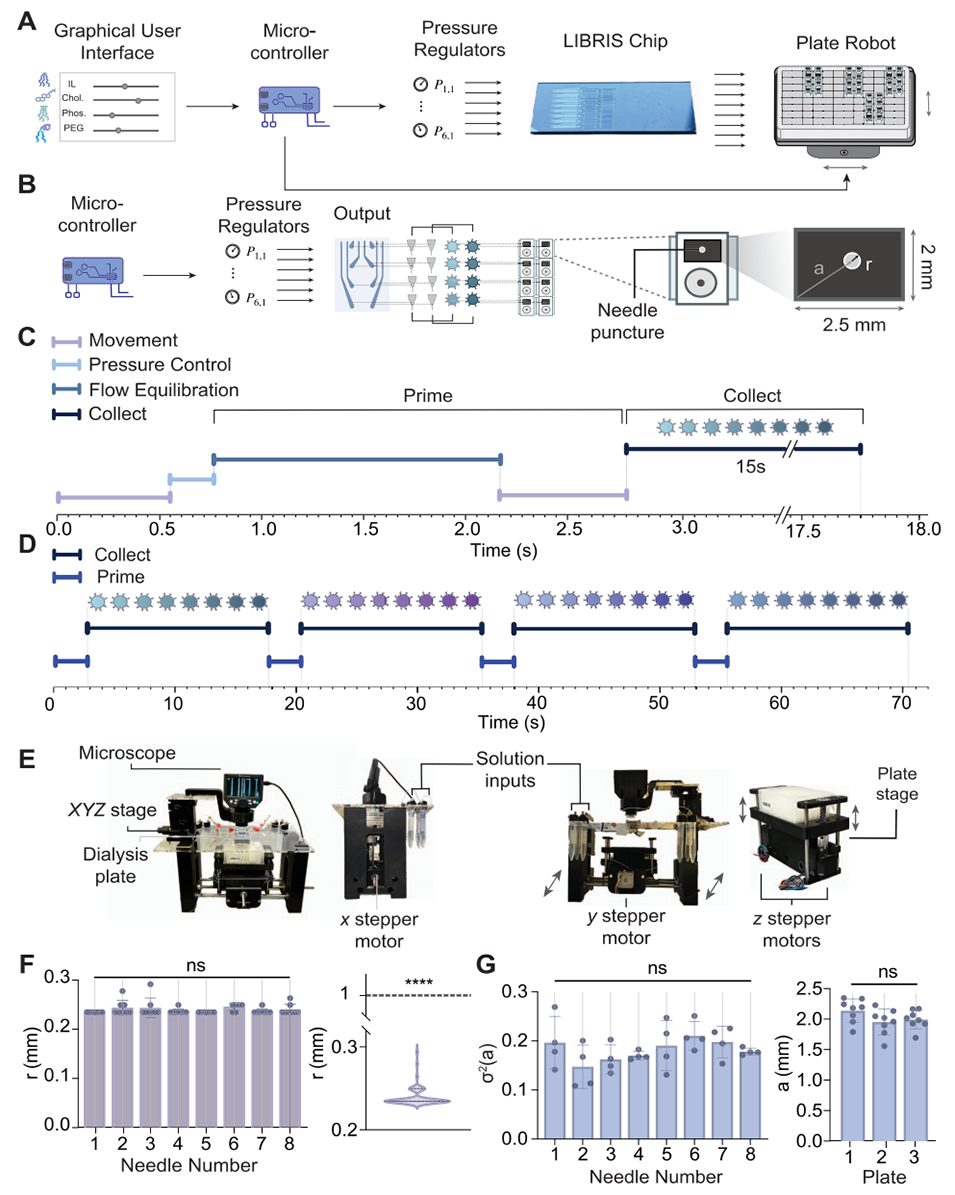
图4. 定制板机器人接口相关特性。(A)单次收集流程概览,用户启动设置后,微控制器同步协调板运动与压力调节。(B)单组8种LNP的生成与收集生命周期,包括初始化、废液丢弃、产物收集等步骤。(C)单组8种LNP的2.75秒废液周期时序图,(D)收集32种LNP需约70秒的时序分布。(E)板式机器人的标注图像,展示显微镜、溶液输入口、板台及XYZ步进电机等组件。(F)同一板上20次重复运动的收集精度测试,穿刺半径远低于1mm可接受范围,且不同收集位置间无显著差异。(G)三块不同板上20次重复运动的收集一致性测试,穿刺标记方差及针在透析盒内的绝对位置无显著差异。
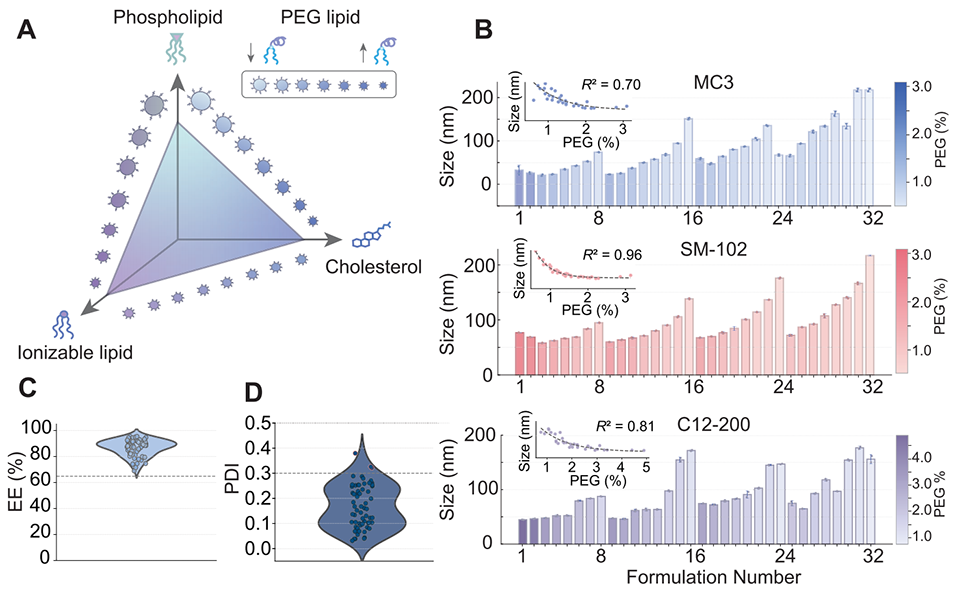
图5. LNP库的理化性质表征。(A)LNP库的设计空间示意图,每组脂质中离子化脂质(IL)与胆固醇摩尔百分比呈正相关,且均与磷脂、PEG脂质摩尔百分比呈负相关,PEG浓度升高会导致LNP粒径减小。(B)动态光散射(DLS)测得的各配方粒径数据,插图显示粒径随PEG摩尔百分比呈指数衰减(三种IL对应的P值均<0.0001)。(C-D)分别展示封装效率(EE%)和多分散指数(PDI)分布,95/96种颗粒的封装效率、93/96种颗粒的PDI均符合理化性能基准。

图6. LNP库的体内外性能验证。(A)96种LNP转染HepG2细胞后mCherry阳性细胞比例的热图,筛选出转染效率最高和最低的C12−200型LNP进行体内验证。(B)各组小鼠给药6小时后主要器官的活体成像(IVIS)图,展示肝脏(Li)、心脏(H)、肺(Lu)、脾脏(Sp)、肾脏(Ki)的荧光素酶表达情况,以PBS为对照。(C)肝脏总发光强度的定量分析,单因素方差分析显示F4(高转染效率候选物)的体内表达量较F24(低转染效率候选物)高约2倍,且与已优化的基础配方性能相当。
论文链接:https://doi.org/10.1021/acsnano.5c15613
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














