
导读:
牙周炎牙槽骨丢失源于持续的炎症和氧化微环境,其会损害再生修复过程。为应对这一挑战,西南医科大学附属口腔医院陶刚/何芸/蔡蕊团队开发了一种仿生分层丝素蛋白微球系统(Cu/Ce-TA@HA-SF),该系统通过三层结构整合抗菌、抗氧化、抗炎、成骨、血管生成等多功能,可恢复氧化还原稳态并促进牙周骨再生,在大鼠牙周炎模型中实现了炎症消退、血管生成和牙槽骨再生的协同作用,为慢性牙周炎治疗提供了新型多功能平台。相关研究以“A Biomimetic Layered Silk Fibroin Microsphere Modulating Redox Homeostasis and Enhancing Osteogenic Differentiation for Synergistic Periodontal Regeneration”为题目,发表于期刊《Small》。
本文要点:
1、本研究开发了一种仿生、空间分层的丝素蛋白(SF)基微球系统(Cu/Ce-TA@HA-SF),该系统可恢复氧化还原稳态,并作为骨填充材料支持牙周骨再生。
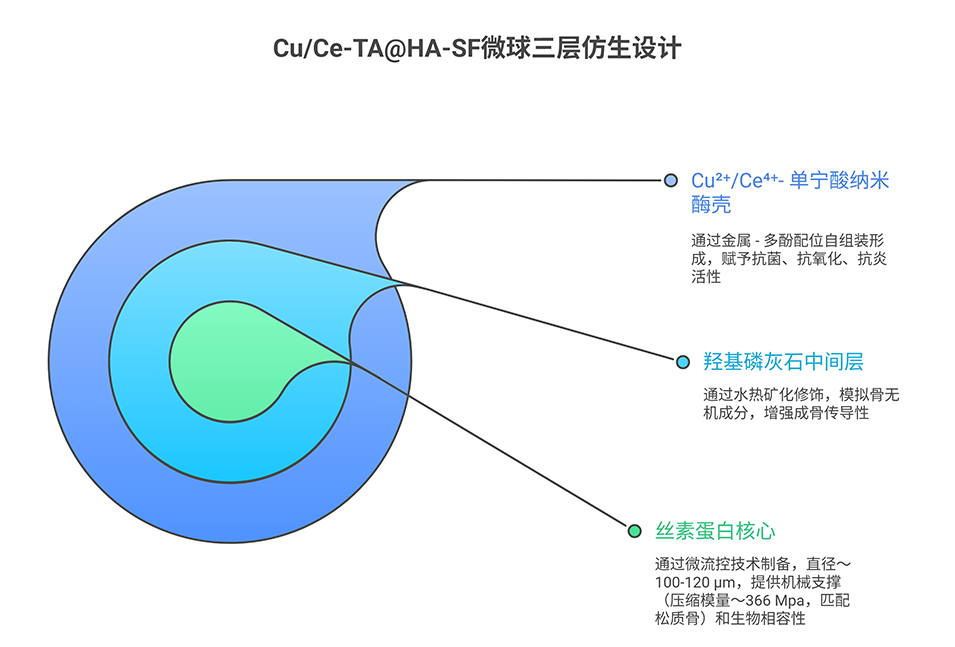
2、该微球具有三层结构:通过微流控技术制备的SF内核保证了均一性和可调节的力学性能,在再生过程中提供动态结构支撑并适配不规则缺损部位;内核周围的羟基磷灰石(HA)层可增强骨传导性;外层的铜离子/铈离子-单宁酸(TA)纳米酶壳则赋予其抗菌和活性氧(ROS)清除功能。
3、纳米酶外层具有过氧化氢酶(CAT)样和超氧化物歧化酶(SOD)样活性,能有效清除ROS、恢复线粒体功能并维持人牙周膜干细胞(hPDLSC)的活力。
4、值得注意的是,该微球通过抑制NLRP3/Caspase-1/GSDMD信号通路,可抑制ROS诱导的焦亡。同时,氧化还原调节通过激活Nrf2信号通路和抑制NF-κB信号通路来调控免疫反应,从而抑制M1型巨噬细胞极化并促进M2型巨噬细胞表型转化。
5、在体内实验中,Cu/Ce-TA@HA-SF微球在大鼠牙周炎模型中实现了炎症消退、血管生成和牙槽骨再生的协同作用。这种多功能、分层设计的微球为氧化还原驱动的免疫调节和功能性牙周再生提供了一种有前景的策略。
与传统牙周炎治疗材料相比,Cu/Ce-TA@HA-SF微球的创新点和临床应用优势是什么?
① 创新点:首次将“丝素蛋白-羟基磷灰石-双金属纳米酶”进行层状组装,实现“抗菌、抗氧化、抗炎、促血管生成、促成骨”五大功能集成,突破传统材料功能单一的局限;机制上同时靶向redox平衡、免疫调节和细胞焦亡三大病理通路,而非仅针对单一环节。
② 临床优势:具备可注射性(适配微创治疗),直径100-120μm可填充不规则骨缺损;生物相容性优异(溶血率<5%),降解可控(人工唾液中缓慢降解);体内实验证实能减少骨丢失并促进再生,无需联合多种药物,简化治疗方案,为临床牙周炎相关牙槽骨缺损修复提供了“一站式”解决方案。
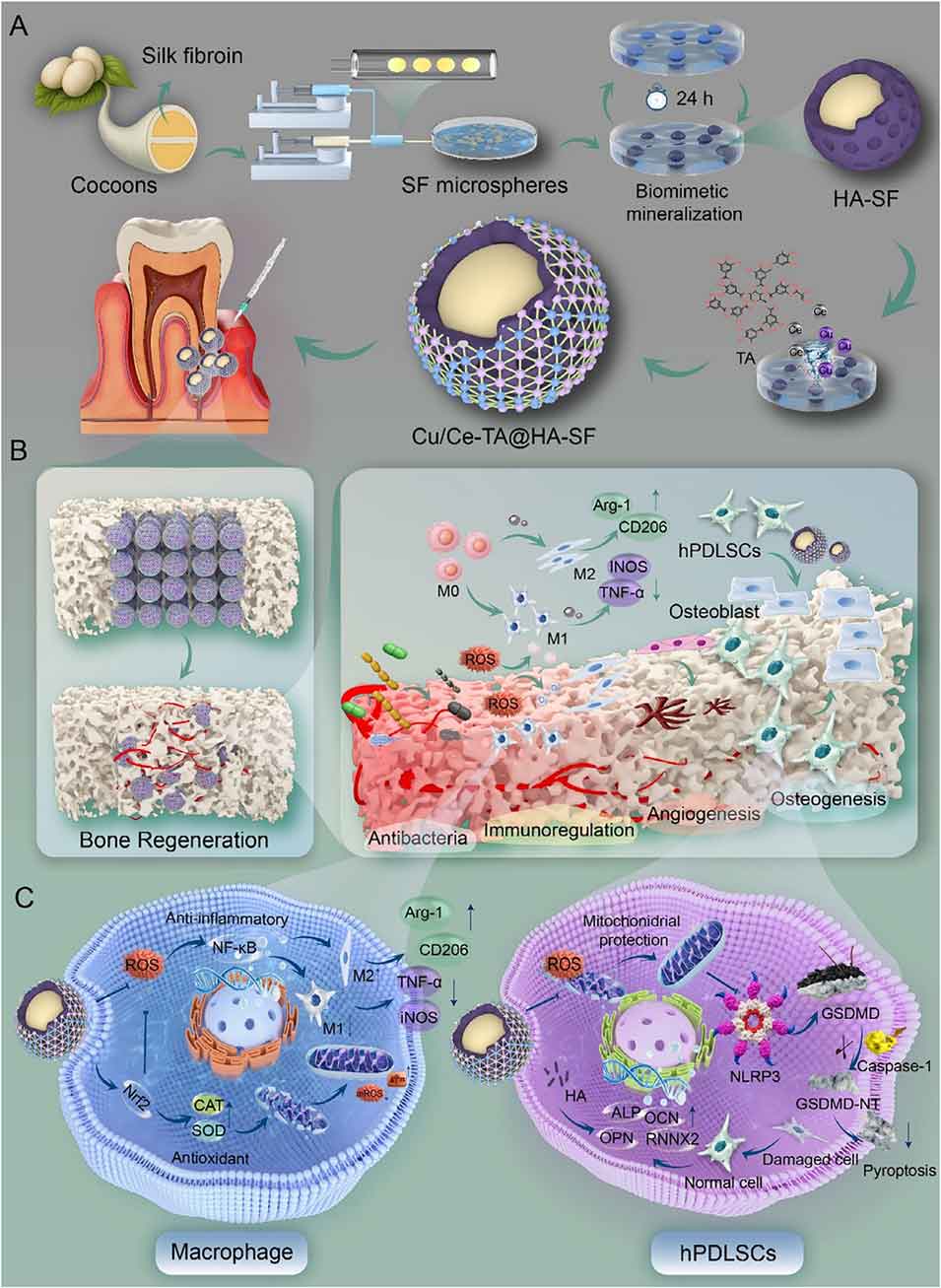
图1. Cu/Ce-TA@HA-SF微球的制备流程及应用示意图
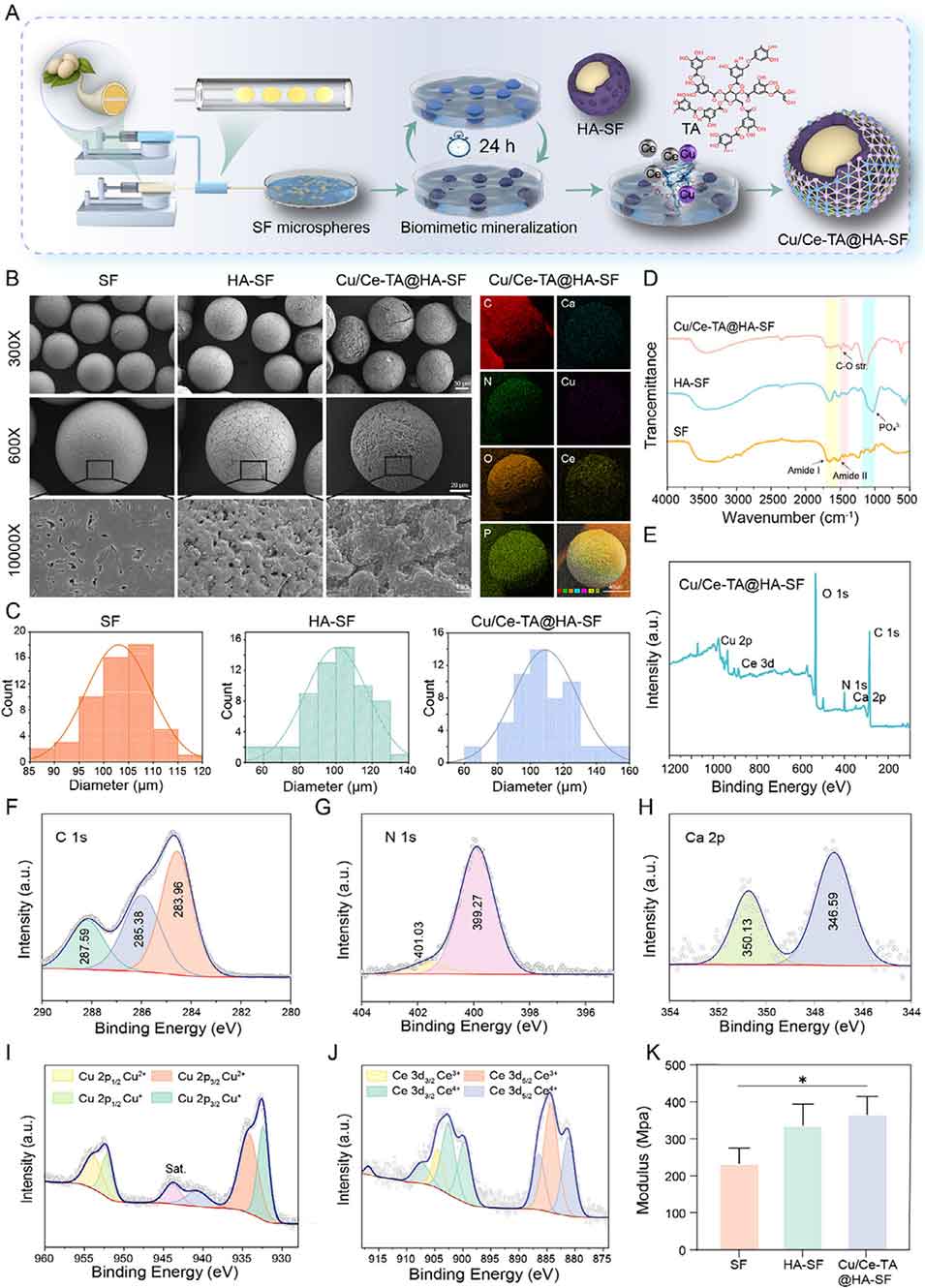
图2. Cu/Ce-TA@HA-SF微球的表征结果
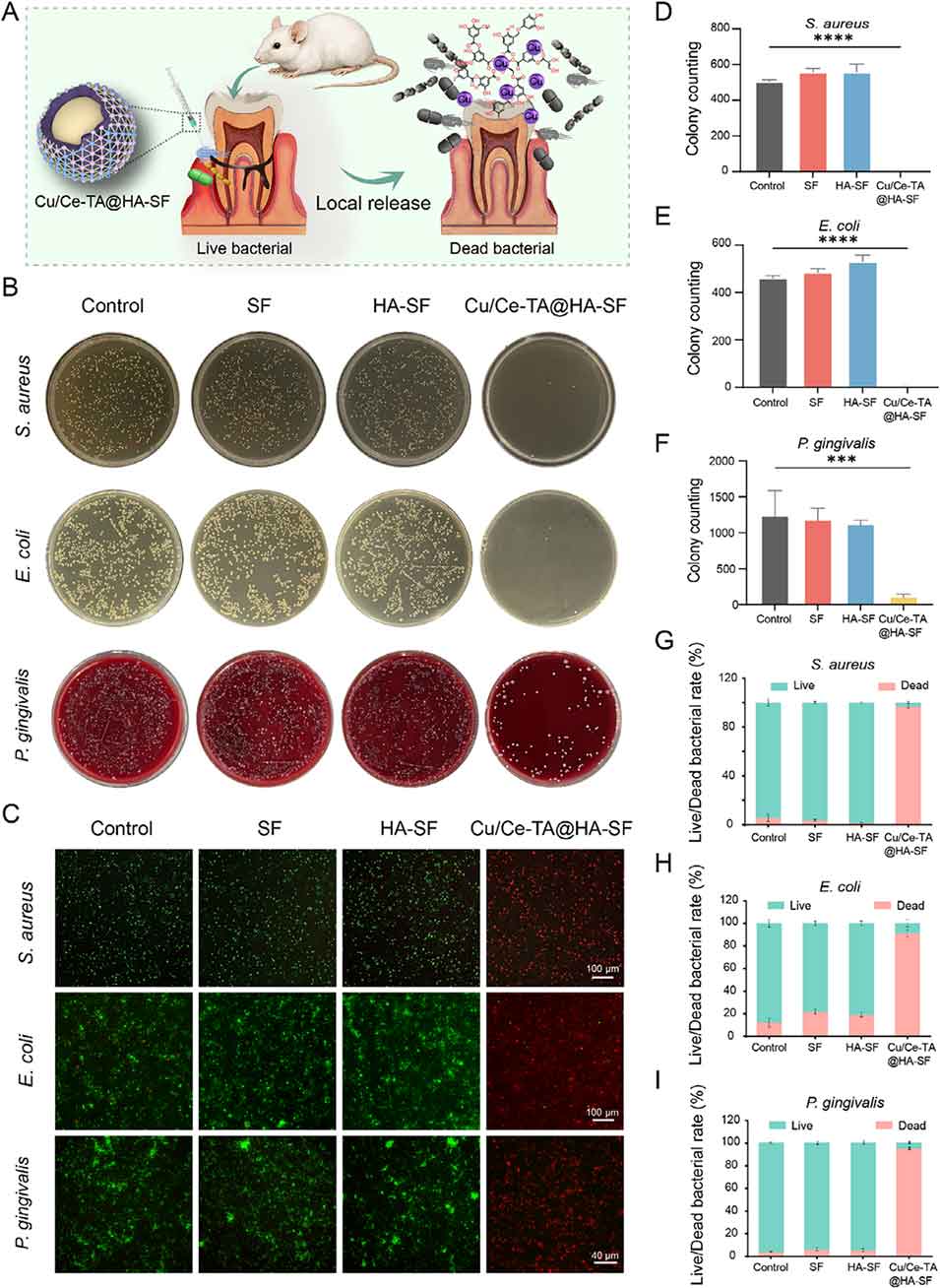
图3. Cu/Ce-TA@HA-SF微球的抗菌性能
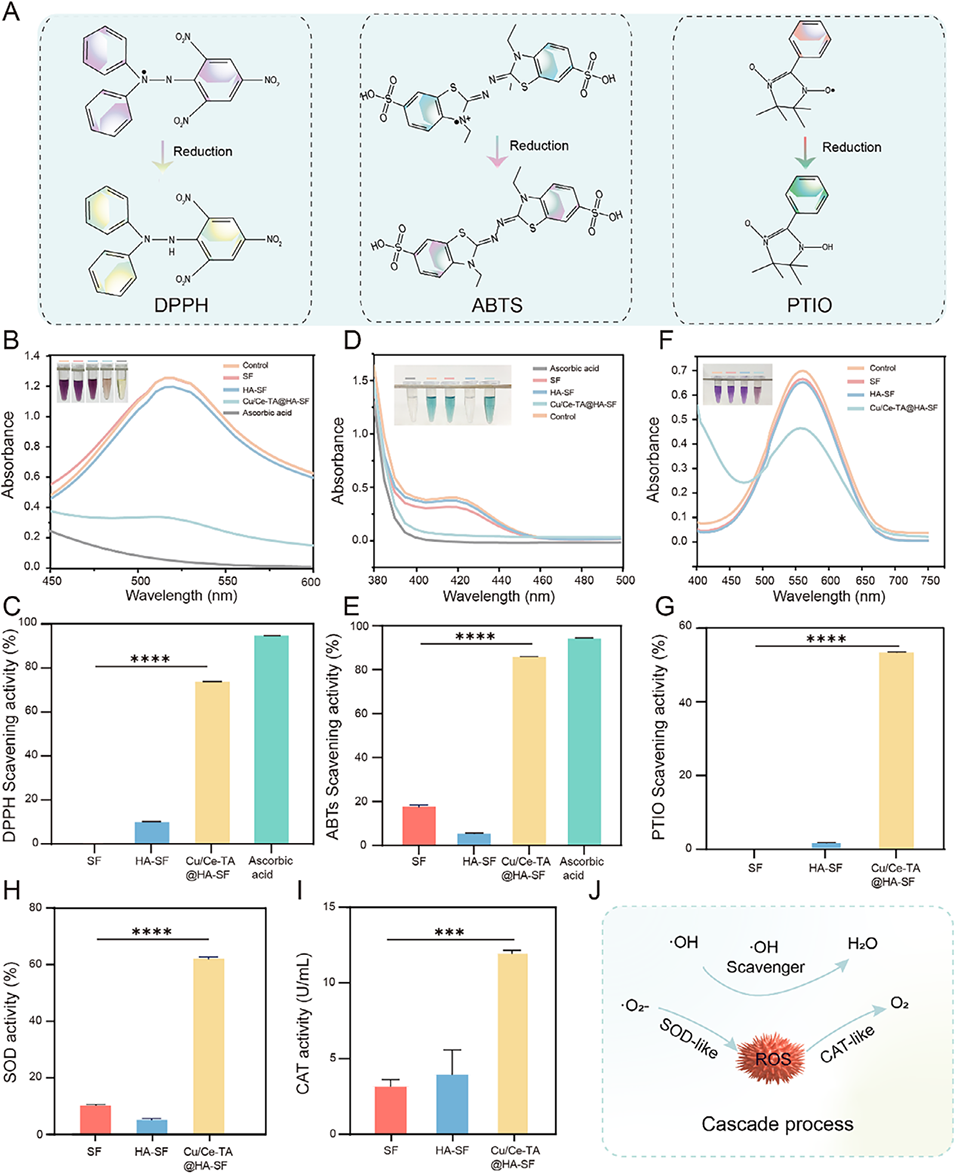
图4. Cu/Ce-TA@HA-SF的体外抗氧化活性及酶模拟活性
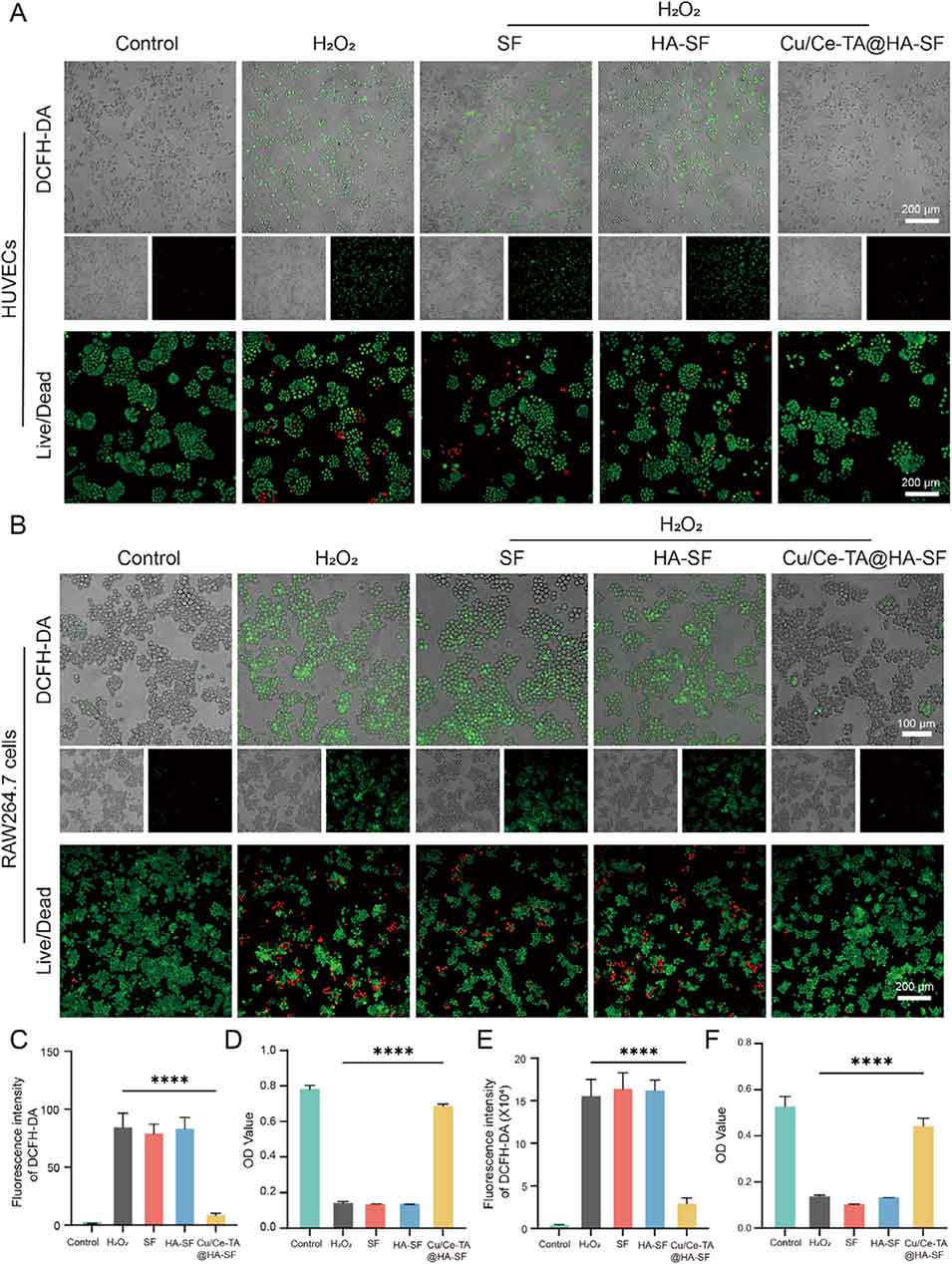
图5. 微球在过氧化氢诱导的氧化应激条件下清除细胞内活性氧(ROS)的效果
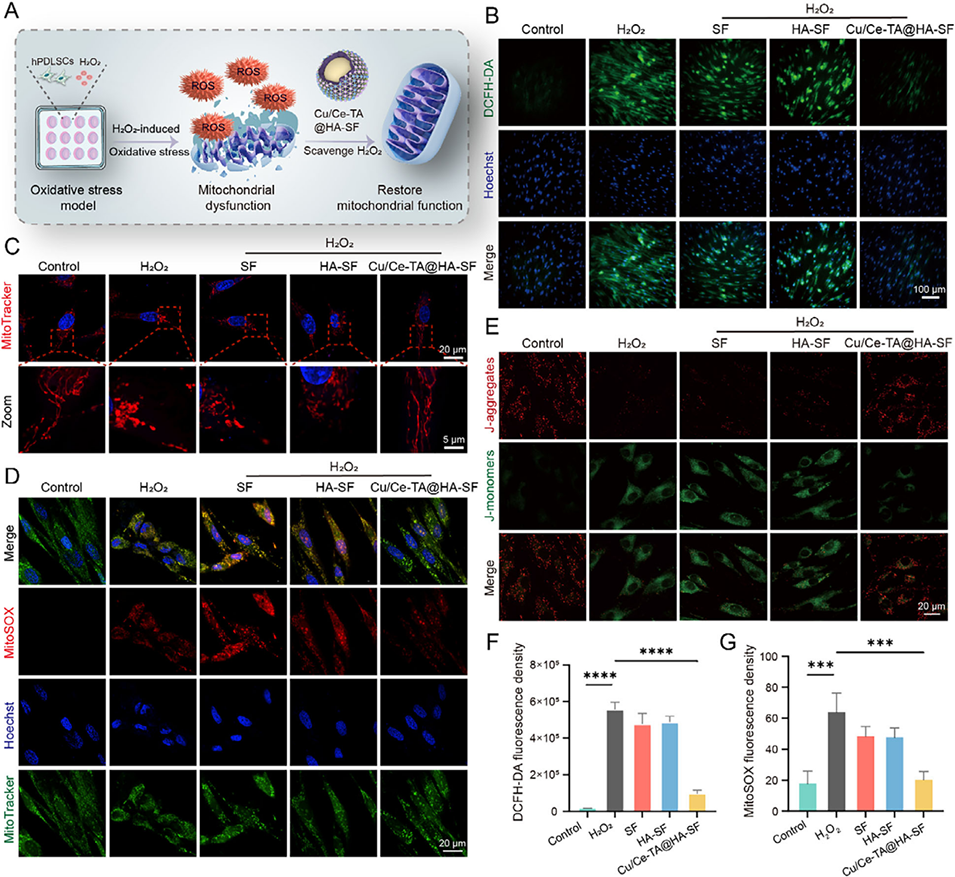
图6. Cu/Ce-TA@HA-SF减轻过氧化氢诱导的人牙周膜干细胞(hPDLSCs)损伤及线粒体功能障碍
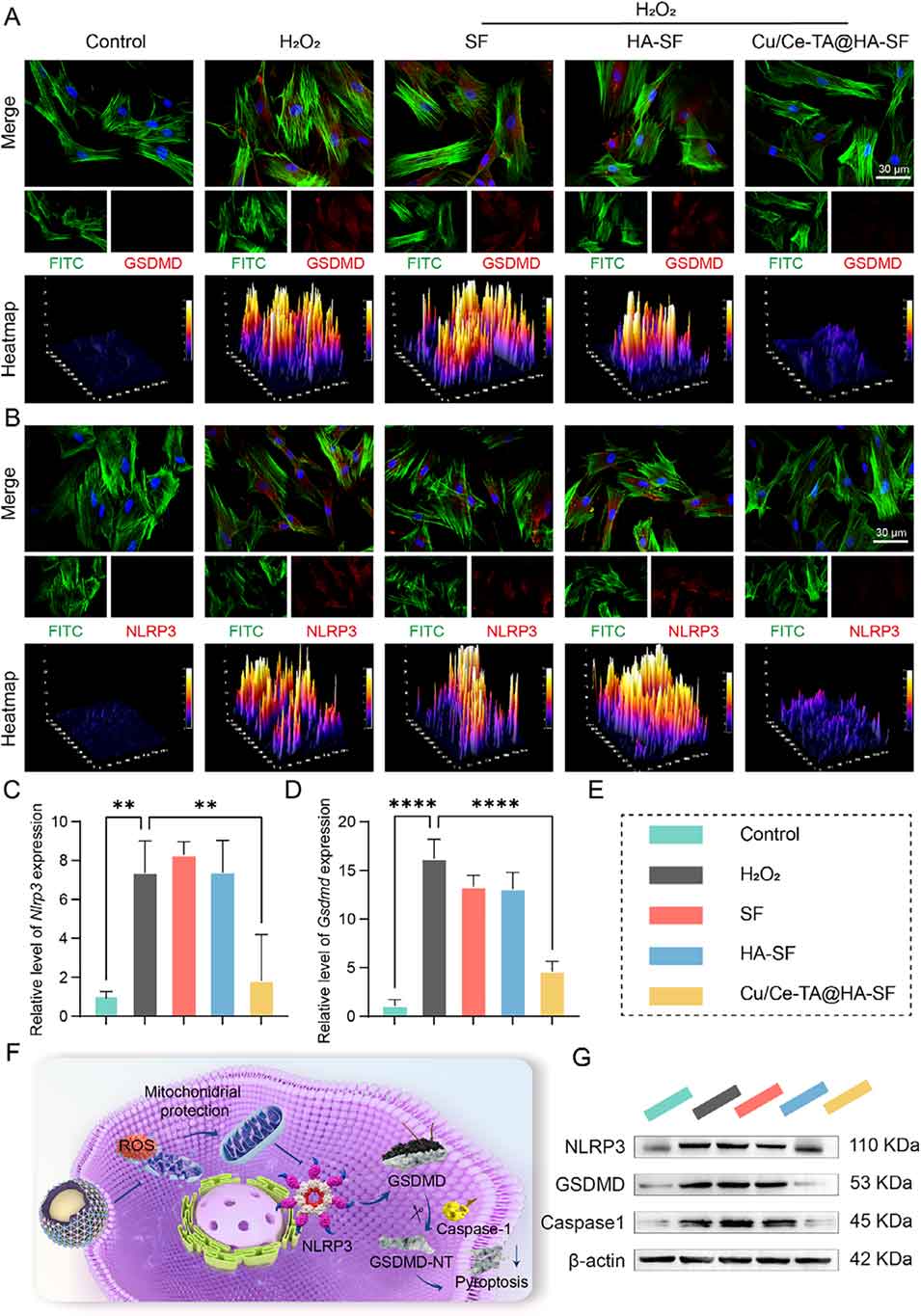
图7. Cu/Ce-TA@HA-SF在氧化应激条件下抑制细胞焦亡的作用
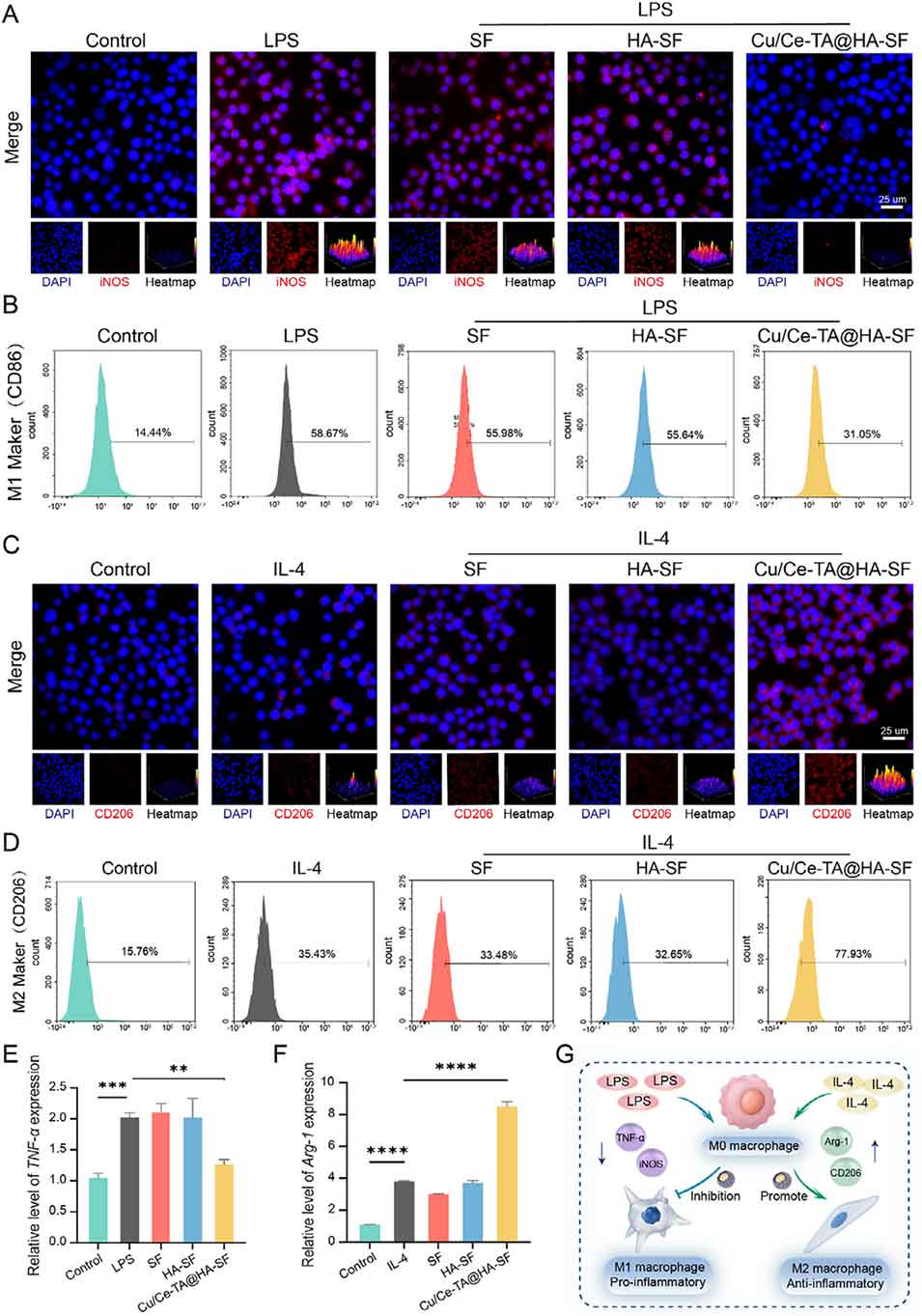
图8. Cu/Ce-TA@HA-SF对巨噬细胞极化的调控作用
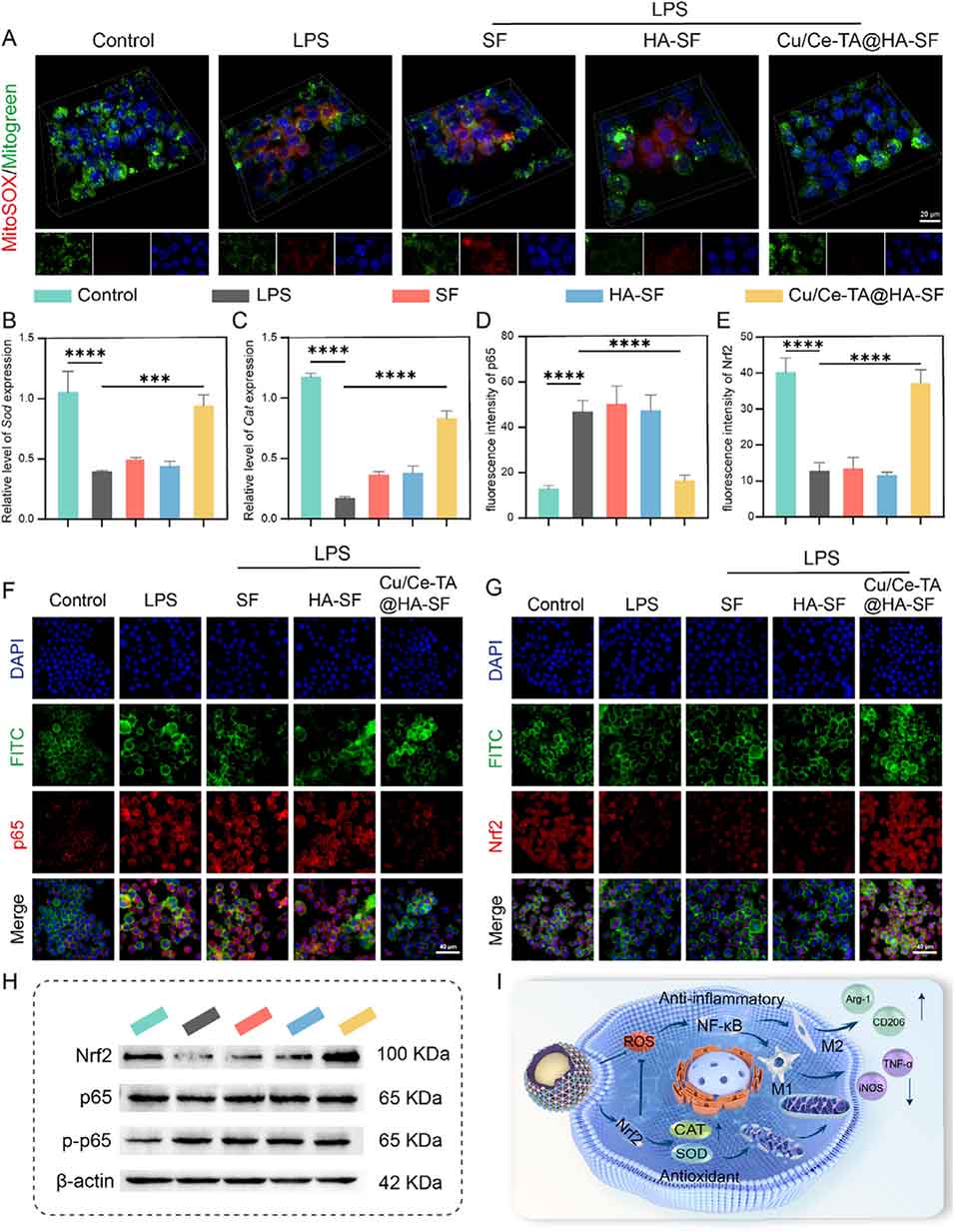
图9. Cu/Ce-TA@HA-SF通过调控Nrf2/NF-κB通路在体外发挥抗氧化及抗炎作用
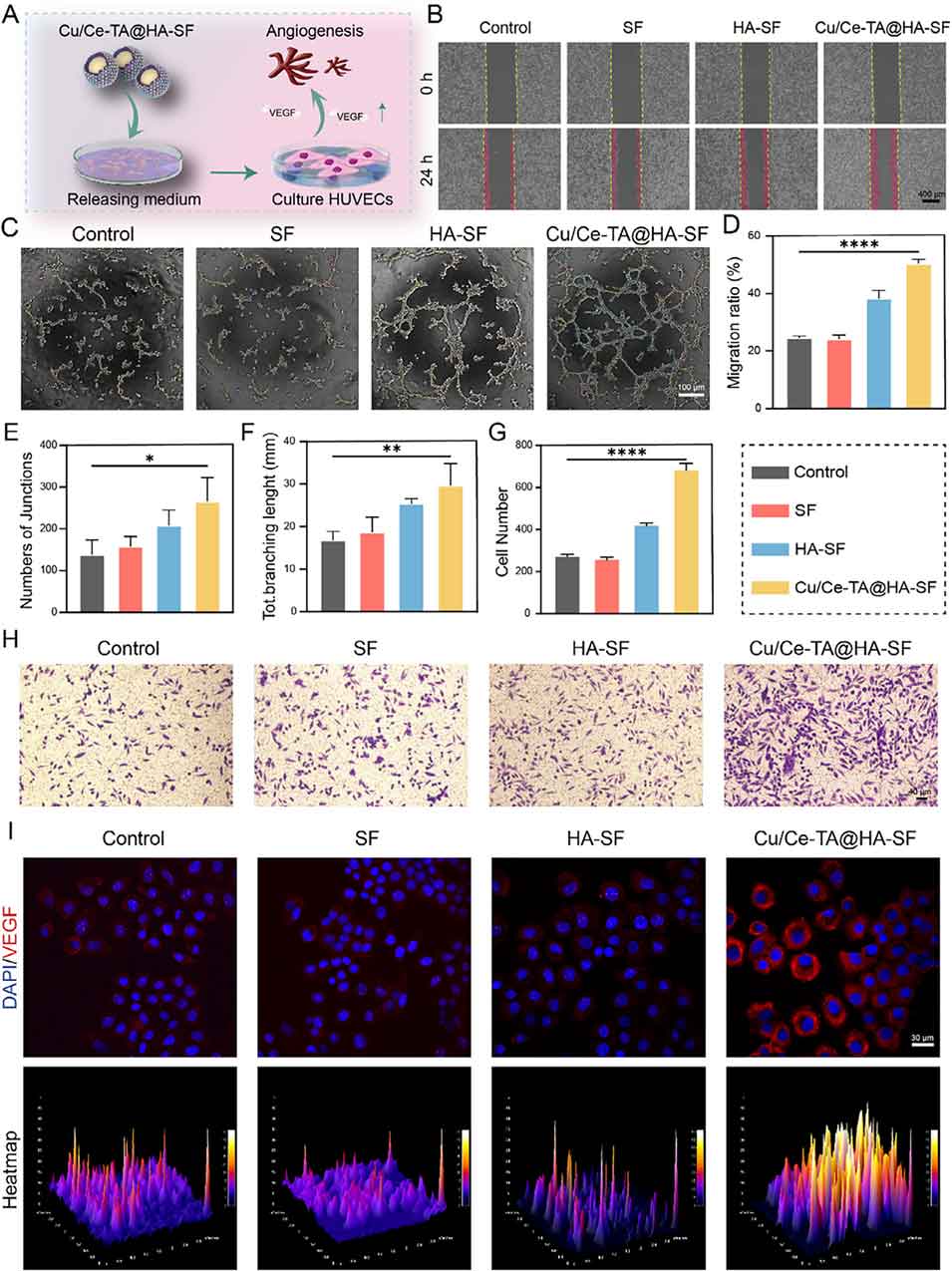
图10. 丝素蛋白(SF)、羟基磷灰石-丝素蛋白(HA-SF)及Cu/Ce-TA@HA-SF的体外血管生成活性
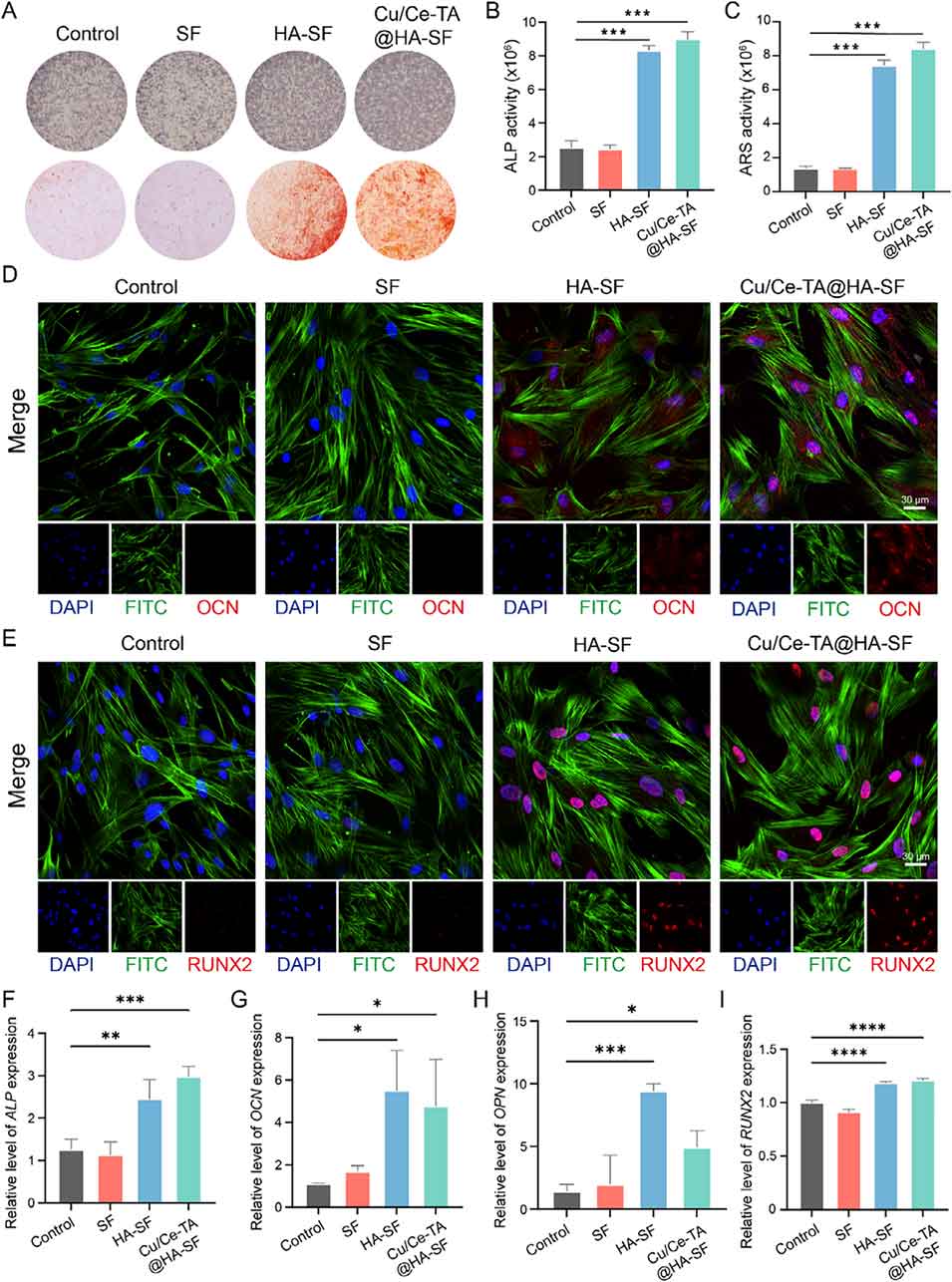
图11. 正常培养基中Cu/Ce-TA@HA-SF的成骨能力评价
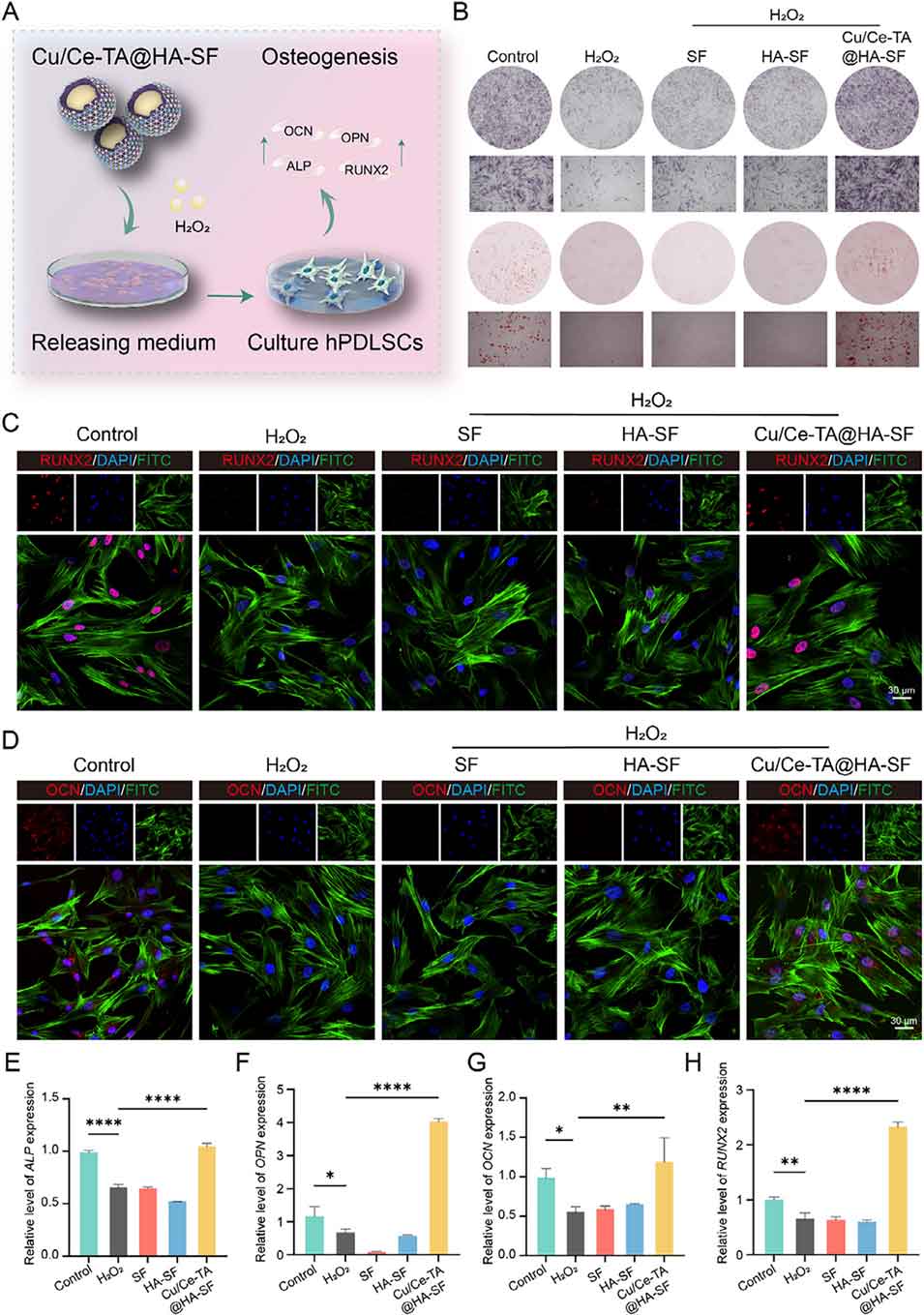
图12. 氧化应激条件下Cu/Ce-TA@HA-SF增强hPDLSCs成骨分化的作用
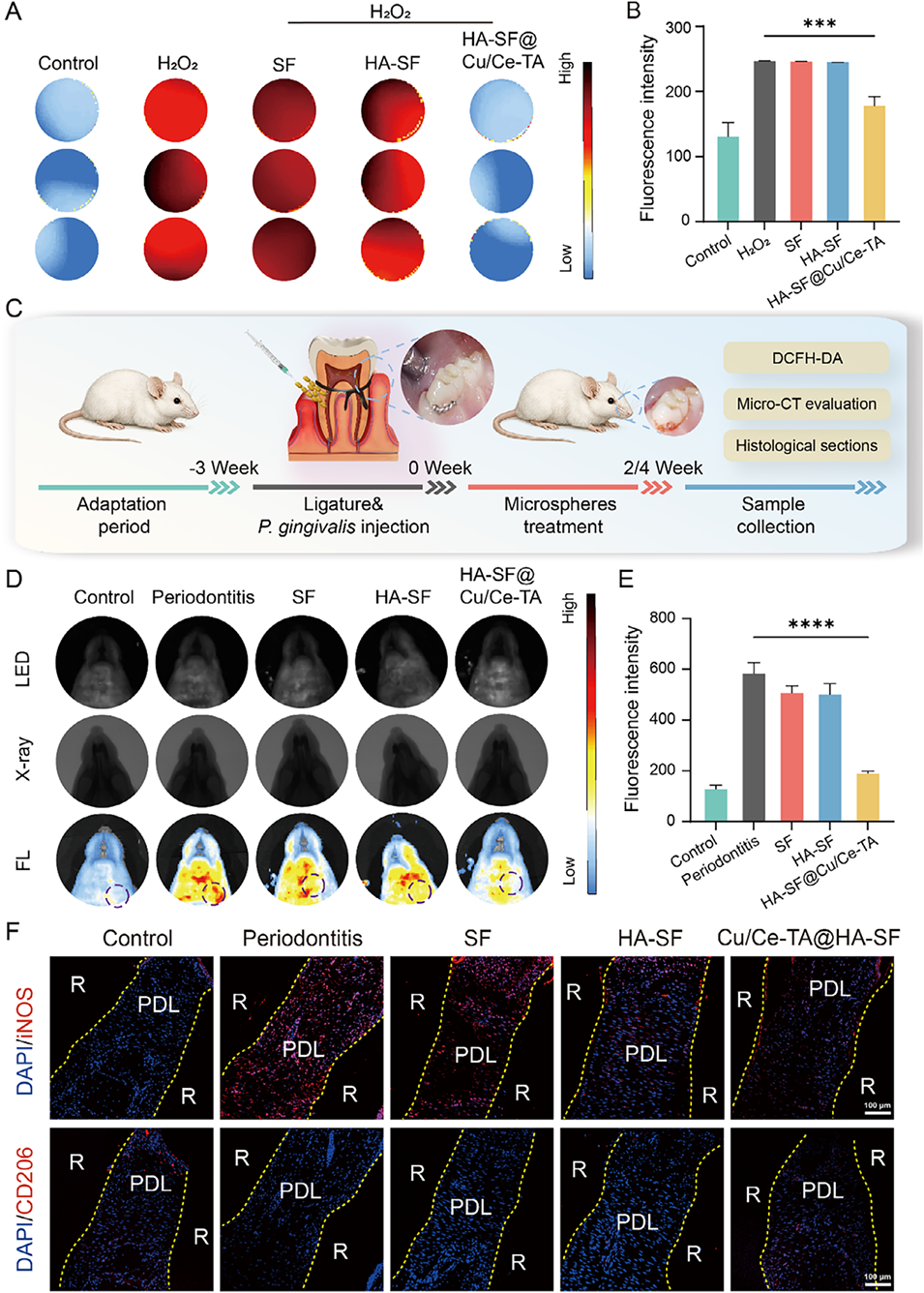
图13. Cu/Ce-TA@HA-SF微球对大鼠牙周炎模型的抗炎活性
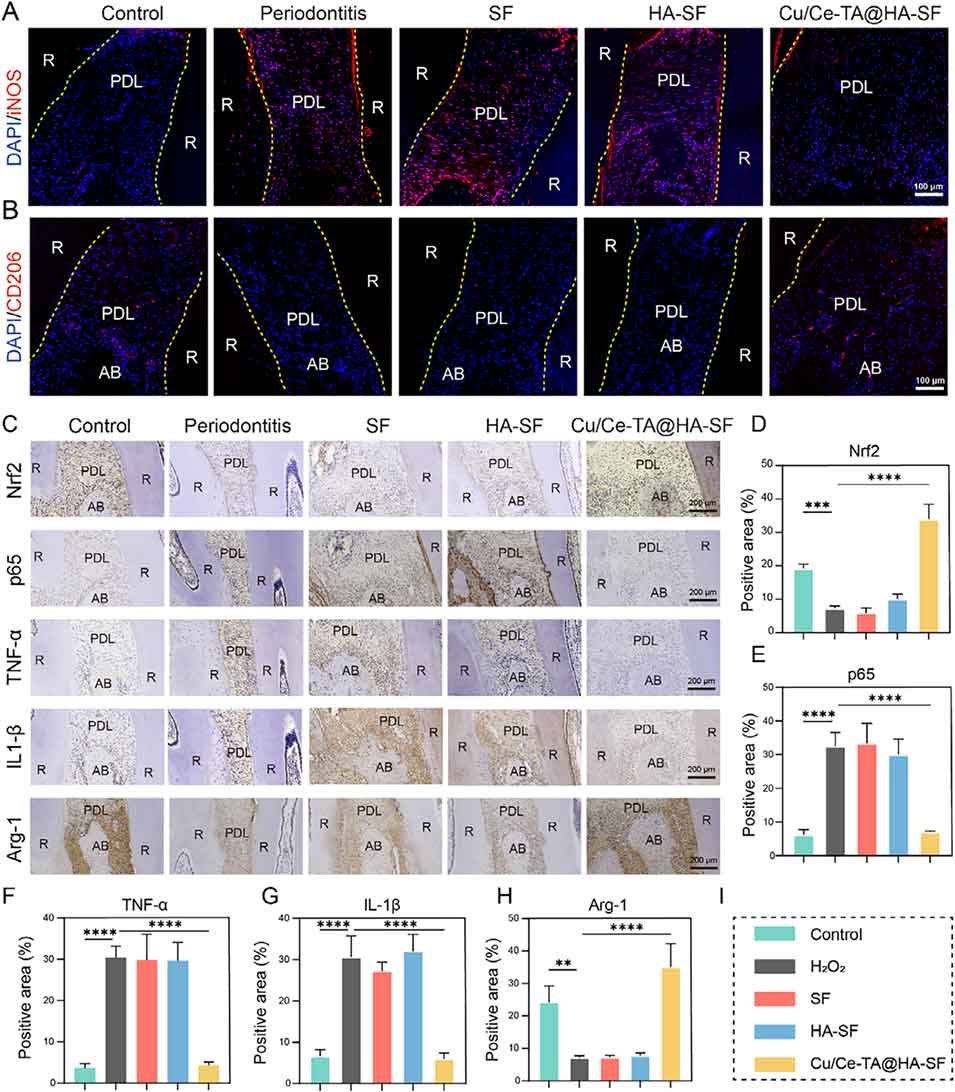
图14. 微球治疗后4周的免疫调控效果
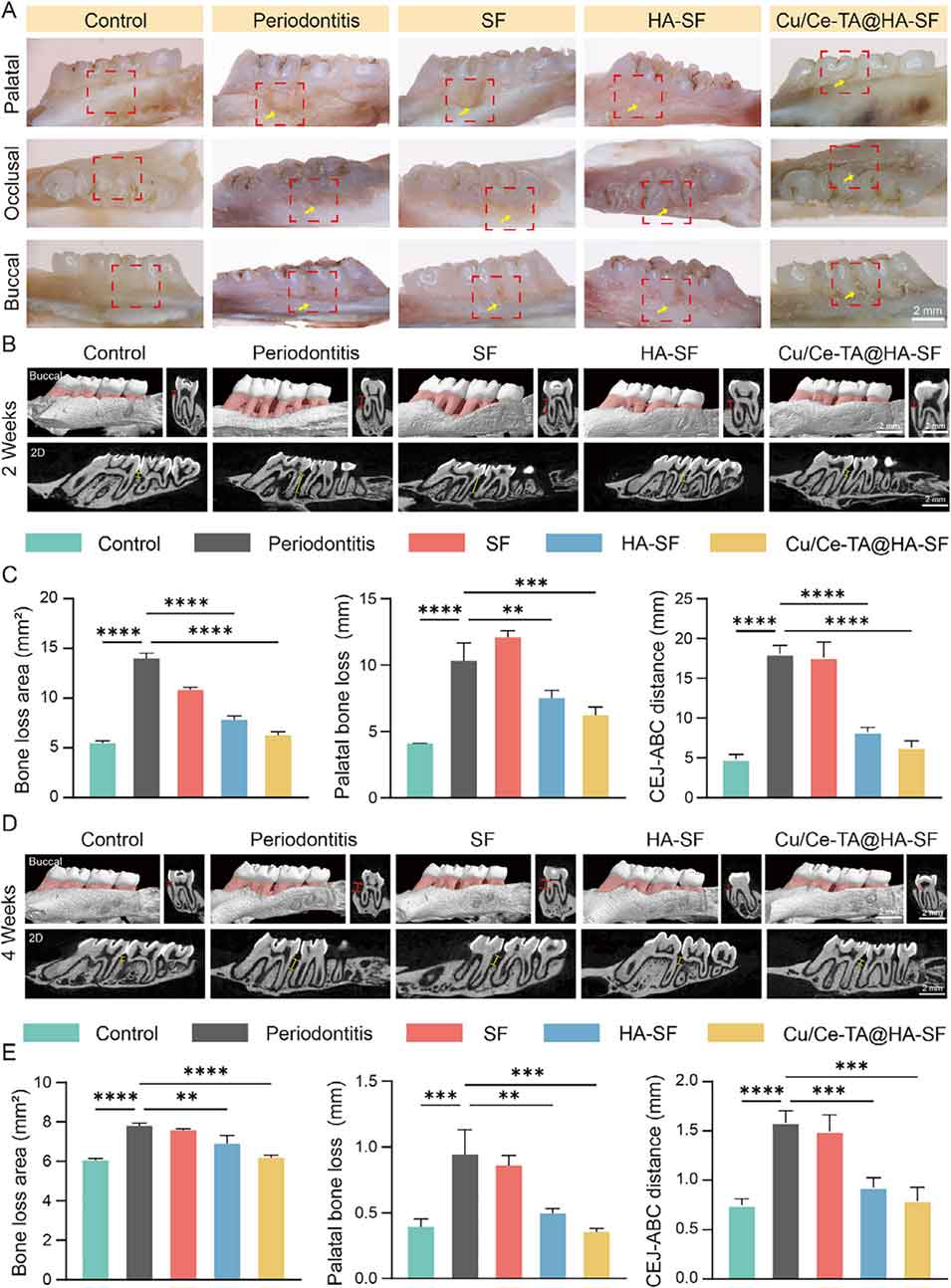
图15. Cu/Ce-TA@HA-SF微球在大鼠牙周炎模型中的体内骨再生能力
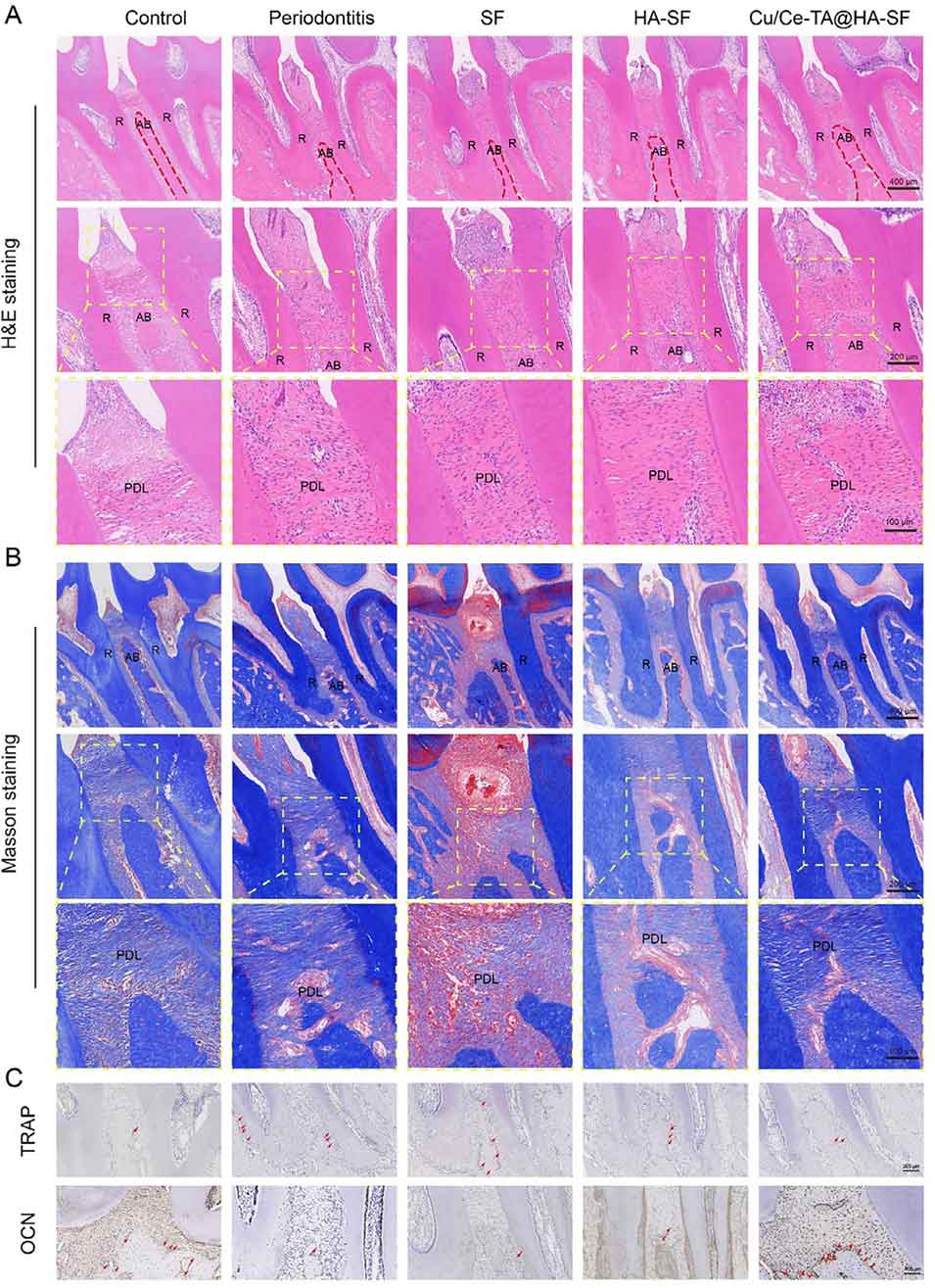
图16. 微球治疗2周后体内骨再生的评估结果

图17. Cu/Ce-TA@HA-SF治疗4周后体内骨再生的组织学评价
论文链接:https://doi.org/10.1002/smll.202510869
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)
上一篇:自动化并行微流控平台,用于大规模精准构建脂质纳米颗粒库
下一篇:暂无














