
导读
近期,大连医科大学附属第二医院李先承教授团队设计并制造了具有18,000个亲水微孔的微流控芯片来建立单细胞培养阵列,并将其用于肾癌干细胞扩增。相关研究以“Selective Expansion of Renal Cancer Stem Cells Using Microfluidic Single-cell Culture Arrays for Anticancer Drug Testing”为题发表在《Lab on a Chip》上。
本文要点:
1、该研究采用微流体单细胞培养阵列,利用肿瘤干细胞的抗凋亡和自我更新特性来扩增肾癌干细胞。
2、Caki-1、786-O和ACHN细胞的球体形成率分别为8.74±0.53%、12.02±1.43%和4.98±1.68%,表明肾癌干细胞成功扩增。
3、通过免疫荧光、流式细胞术、连续传代和体外分化测定证实,扩增的细胞表现出干细胞特征。
4、与分化的肾癌细胞相比,肾癌干细胞对酪氨酸激酶抑制剂索拉非尼和舒尼替尼的敏感性降低,表明对传统抗癌药物的反应有限。
5、该研究表明微流体单细胞培养阵列可以促进癌症干细胞的药物测试,为开发肿瘤干细胞靶向疗法铺平道路。
全文总结/概括:
在这项研究中,微流控单细胞培养阵列是通过以下步骤设计和制备的:
1、设计微流控芯片:研究人员设计了一个微流控芯片,包括六个平行的细胞培养模块,每个模块有3000个微孔。这个设计可以容纳大量的单细胞培养,并且可以进行多组实验。
2、制备微流控芯片:采用传统的SU-8光刻-聚二甲基硅氧烷(PDMS)浇铸工艺制备微流控芯片。通过光刻技术在硅片上制备微流道,然后使用PDMS浇铸成型。最后,将两层PDMS层粘合在一起形成整个微流控芯片。
3、表面涂层处理:对微流控芯片的内表面进行表面涂层处理,以提高其亲水性,有利于细胞的分散和培养。
4、细胞培养:将肾癌细胞悬浮液引入微流控芯片,通过流体控制和微孔设计,实现单细胞的捕获和培养。
通过以上步骤,研究人员成功设计并制备了用于选择性扩增肾癌干细胞的微流控单细胞培养阵列。这种设计和制备方法为研究提供了一个有效的工具,用于扩增和研究肾癌干细胞的特性和行为。
使用微流控单细胞培养阵列选择性扩增肾癌干细胞都有哪些潜在应用呢?
1、药物筛选:通过扩增肾癌干细胞,可以更准确地评估抗癌药物对这些干细胞的疗效,有助于发现更有效的针对肾癌干细胞的治疗药物。
2、干细胞研究:提供了研究肾癌干细胞行为和特性的有效平台,有助于深入了解肾癌干细胞的生物学特征和潜在的治疗靶点。
3、个性化医学:为了实现个性化治疗,扩增肾癌干细胞可以帮助医生更好地了解患者的肿瘤特征,从而制定更为精准的治疗方案。
4、疾病建模:通过扩增肾癌干细胞,可以建立更真实的肾癌模型,有助于研究肾癌的发病机制和疾病进展过程。
因此,微流控单细胞培养阵列选择性扩增肾癌干细胞在肾癌治疗和研究中具有重要的应用前景。
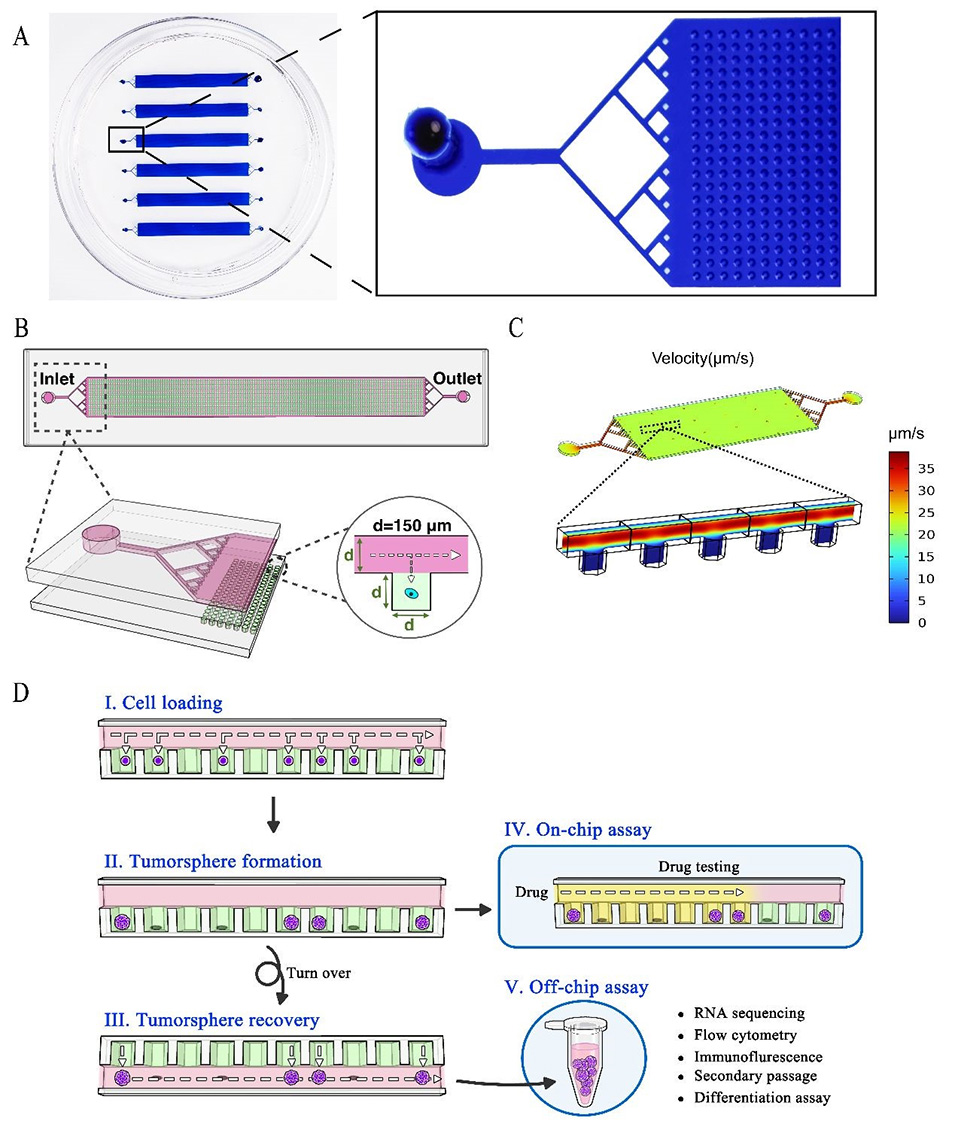
图1.微流控芯片结构和操作流程示意图。
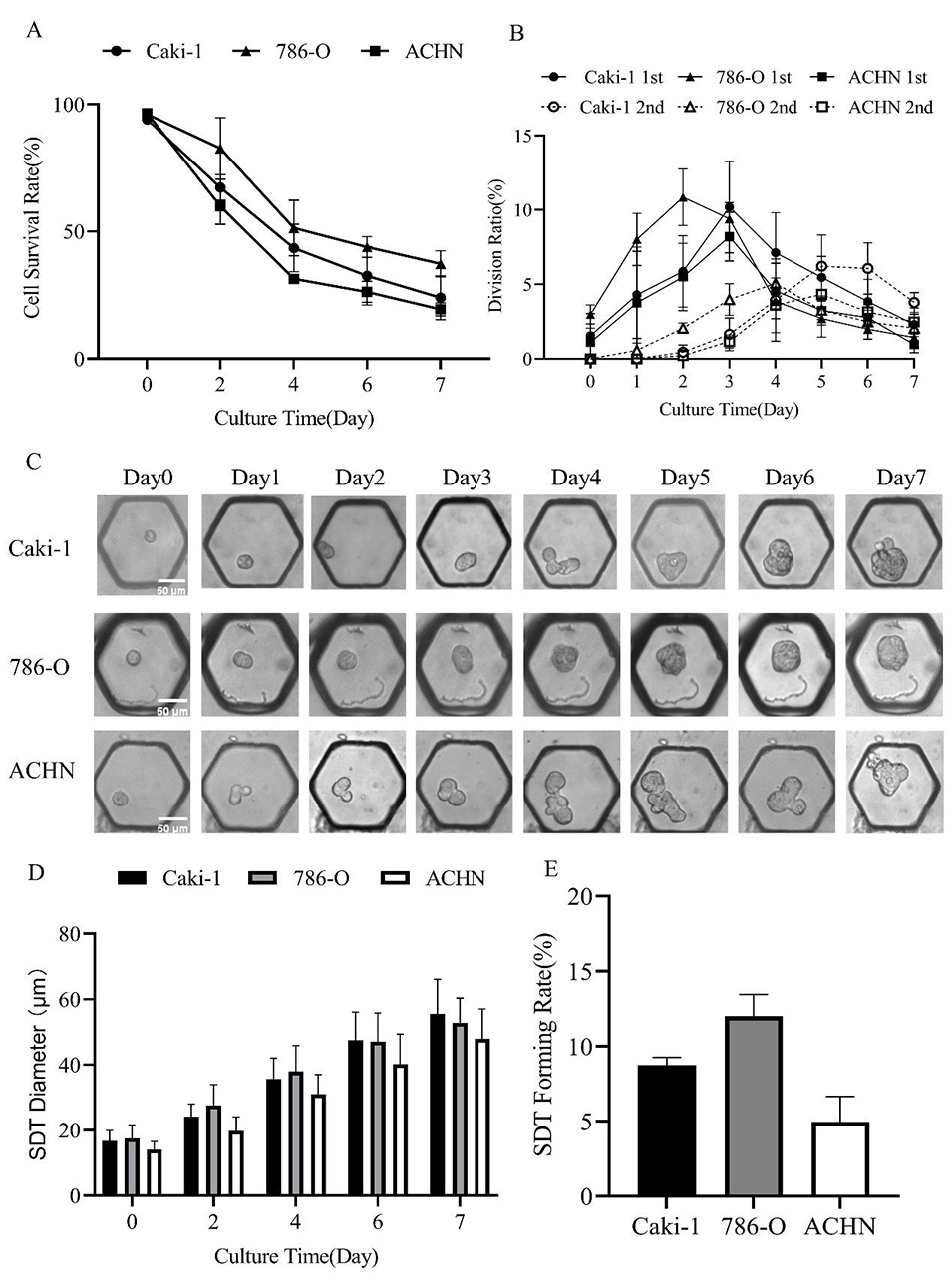
图2.微流控单细胞培养用于选择性扩增肾癌细胞。
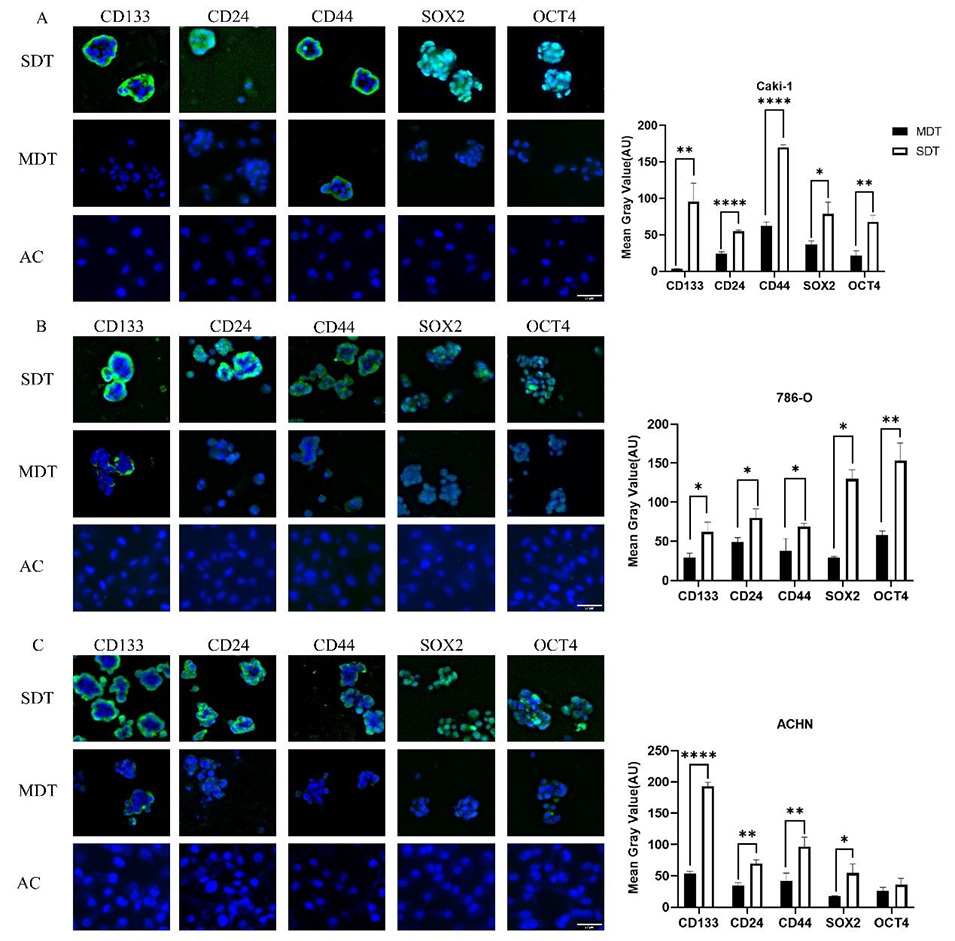
图3.免疫荧光检测从SDT、MDT和AC培养物中获得的各种肾癌细胞(A.Caki-1、B.786-O、C.ACHN)中干细胞标志物的表达。干细胞标志物CD133、CD24、CD44、SOX2和OCT4在SDT组的表达水平明显高于MDT组。AC组未检测到荧光,因此未列入直方图。比例尺:50μm。*p<0.05,**p<0.01,****p<0.0001。
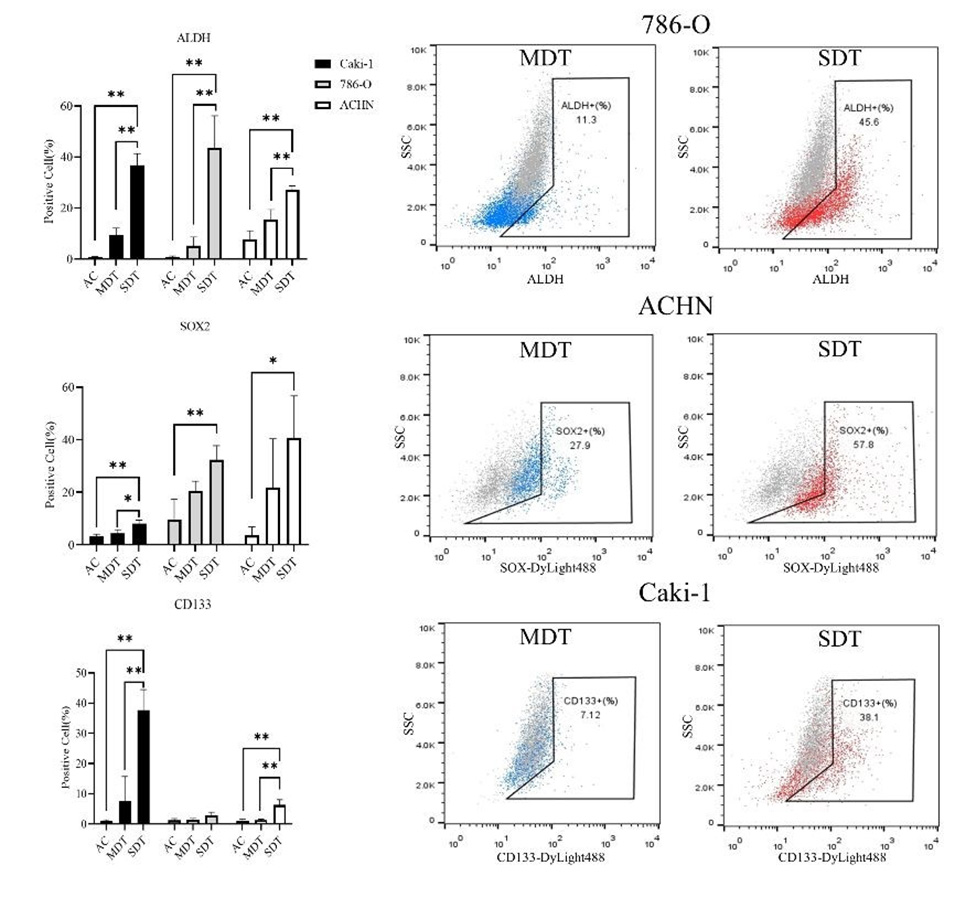
图3.免疫荧光检测从SDT、MDT和AC培养物中获得的各种肾癌细胞(A.Caki-1、B.786-O、C.ACHN)中干细胞标志物的表达。干细胞标志物CD133、CD24、CD44、SOX2和OCT4在SDT组的表达水平明显高于MDT组。AC组未检测到荧光,因此未列入直方图。比例尺:50μm。*p<0.05,**p<0.01,****p<0.0001。
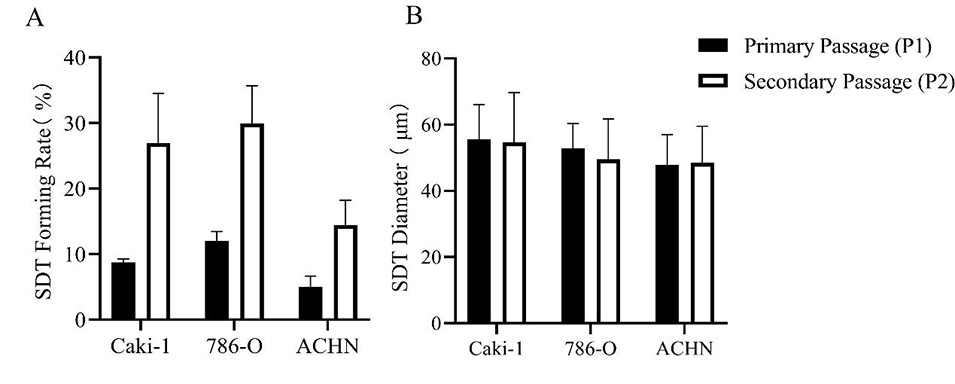
图5.SDT细胞的序列传代。
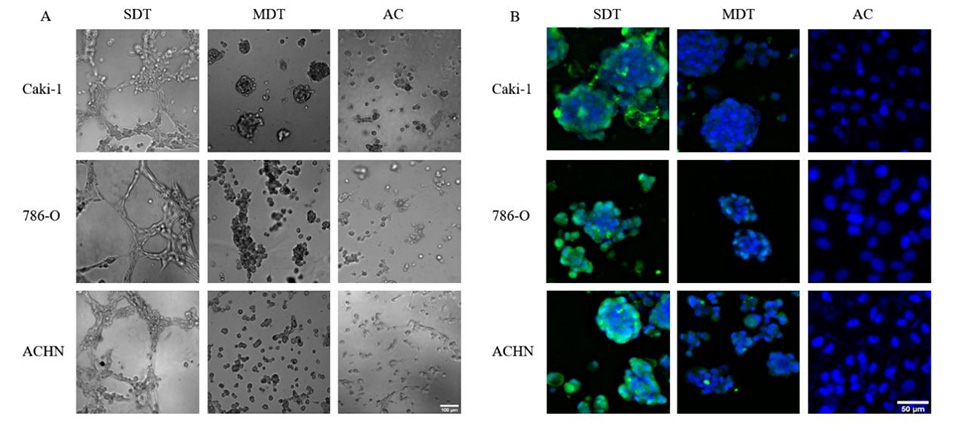
图6.从不同培养物(SDT、MDT、AC)获得的肾癌细胞被诱导分化为血管内皮细胞。
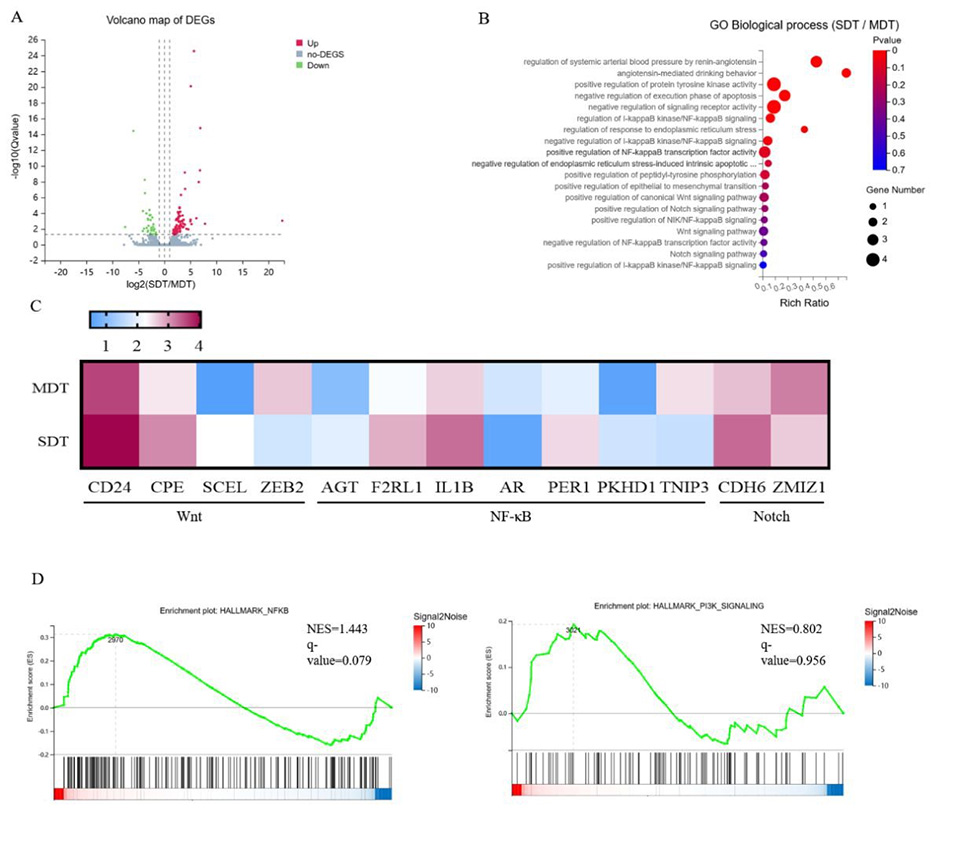
图7.RNA测序显示肾癌干细胞的基因表达特征。
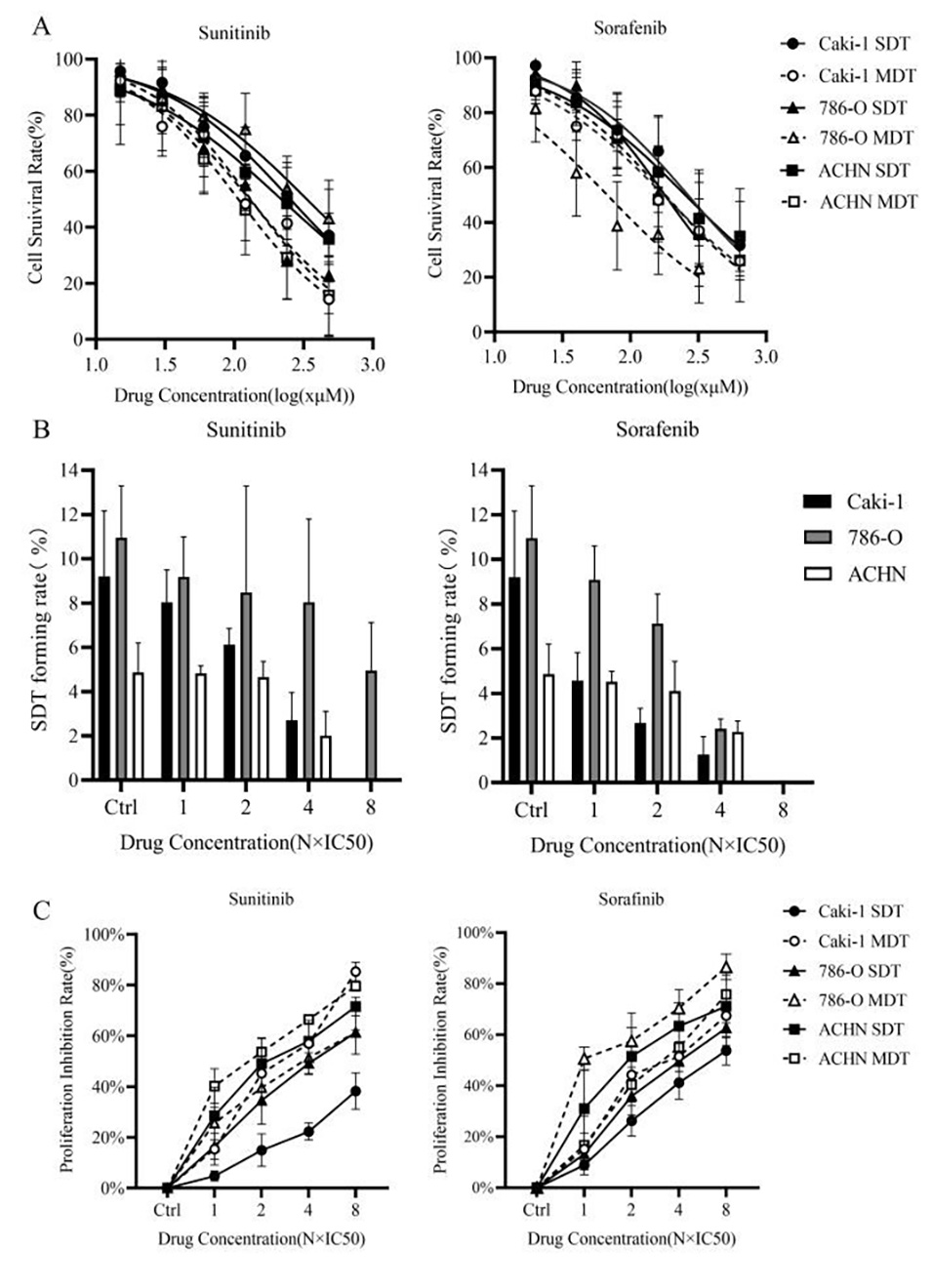
图8.Caki-1、786-O和ACHN SDT细胞对常规药物的反应。
论文链接:https://doi.org/10.1039/D3LC00922J
上一篇:暂无














