高效分离生物颗粒通常是生物技术、细胞生物学和生物医学分析中至关重要的第一步。荧光激活细胞分选和磁激活细胞分选等基于标记的方法已成功用于这一目的。但它们存在设备昂贵、耗时的缺点,而且标记可能对下游分析产生影响。与之相反,像密度梯度离心和膜分离这样的无标记方法通常用于从异质生物样品中分离目标生物颗粒。然而,它们存在低纯度、回收率和生存率等固有问题。介电泳(DEP)粒子分离具有无标记、易控制和低损伤的优点。由液态金属合金(LMA)制成的侧壁微电极继承了厚电极的额外优势,可产生强大的 DEP 力。然而,现有的基于 LMA 电极的设备无法在紧凑的空间内集成大型阵列电极,从而严重限制了流速和产量。

近期,清华大学王文会副教授&合肥工业大学黄亮副教授团队利用毛细管爆破阀(CBV)的被动控制能力,提出了一种在微流控设备中集成高密度厚 LMA 电极的简便、多功能方法。在微流体通道中共同设计了具有精心设计的爆破压力的 CBV,通过简单的手推注射就能自组装 LMA 电极阵列。阵列电极配置带来了累积 DEP 偏移效应。具体来说,本研究展示了如何在一个紧凑的芯片中制造 5000 对侧壁电极,从而使 DEP 偏转的吞吐量提高 10 倍。研究人员应用这种 5000 对电极的装置成功分离了人外周血单核细胞(PBMC)和 A549 细胞的混合样品,流速为 70 µL min-1。预计这项工作将极大地促进 LMA 电极阵列的制造,并为 DEP 分离应用提供一个坚固耐用的多功能平台。
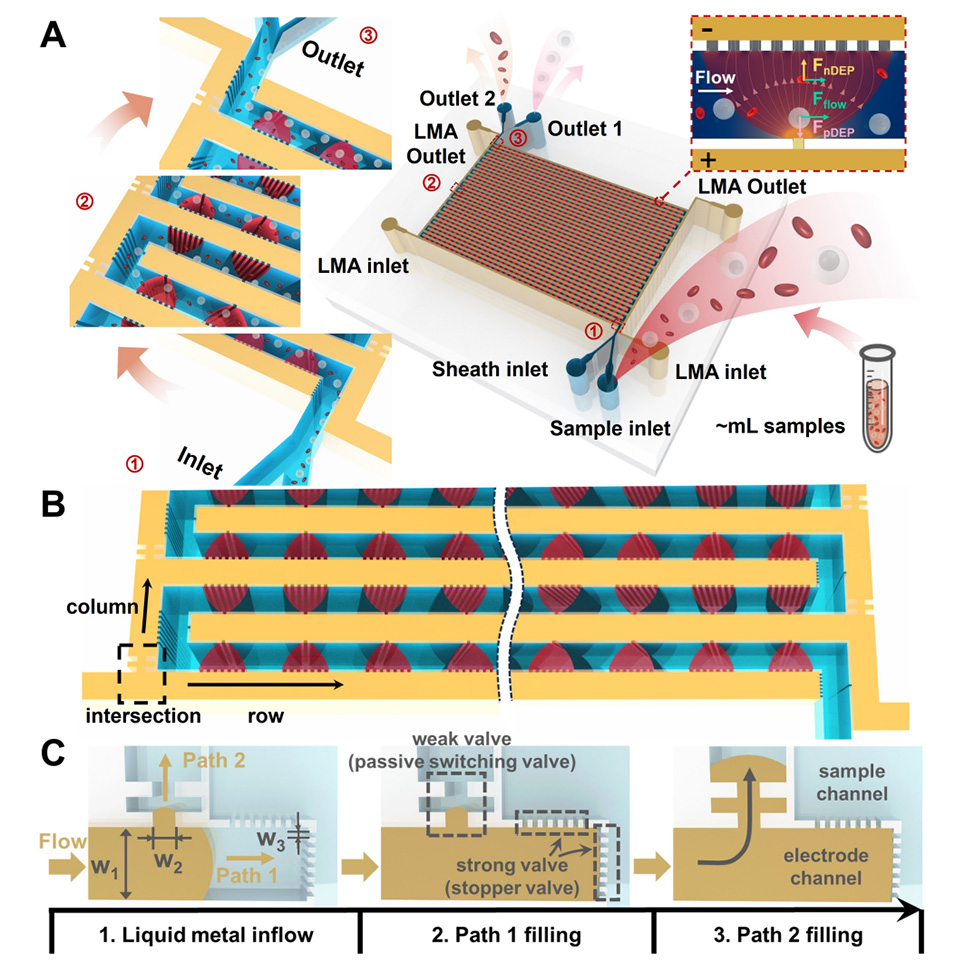
图1.采用大阵列厚液态金属电极进行粒子分离的微流体装置概念图。
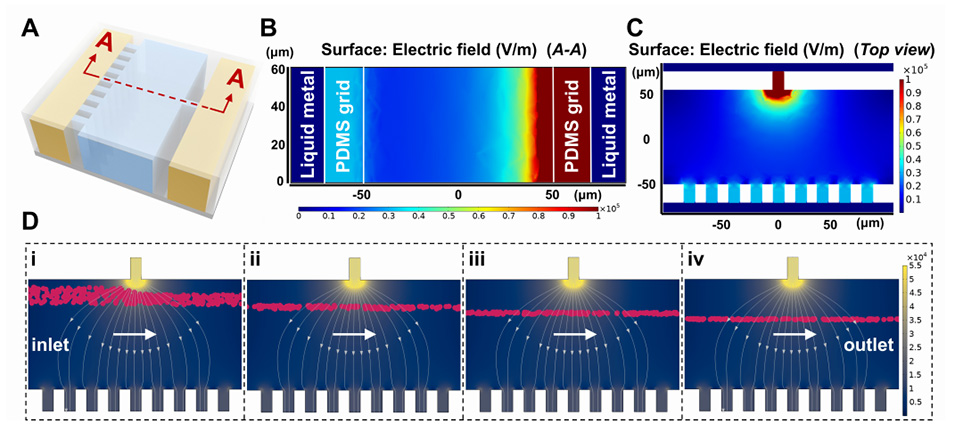
图2.电场分布和粒子轨迹的模拟结果。
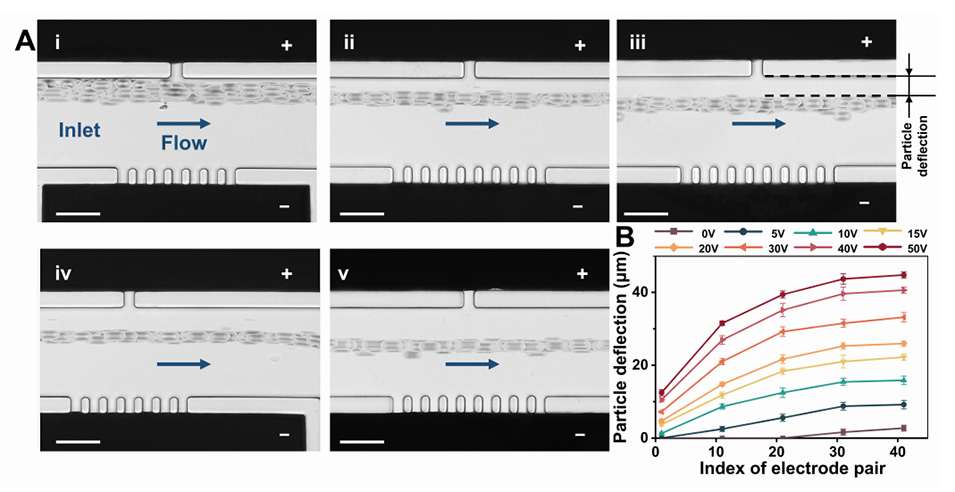
图3.样品流速为1µL/min时,10µm-PS粒子的渐进DEP偏移。
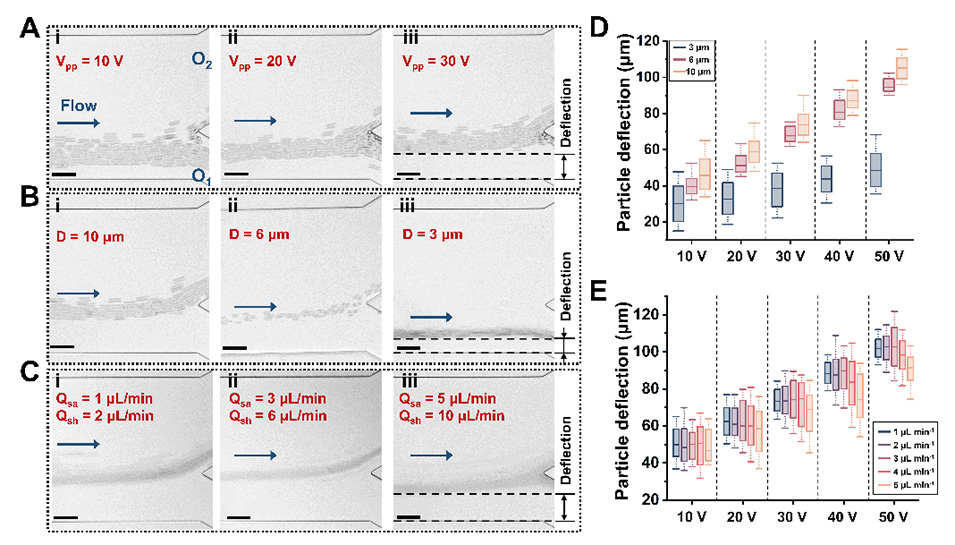
图4.不同(A)DEP电压、(B)颗粒大小和(C)样品流速下出口处颗粒轨迹的叠加图像。比例尺:50µm。箱线图说明了在10-50Vpp和100kHz条件下,不同(D)样品大小和(E)流速下的粒子偏转情况。样品大小约为300。

图5.使用50对电极装置分离PS珠和HeLa细胞。
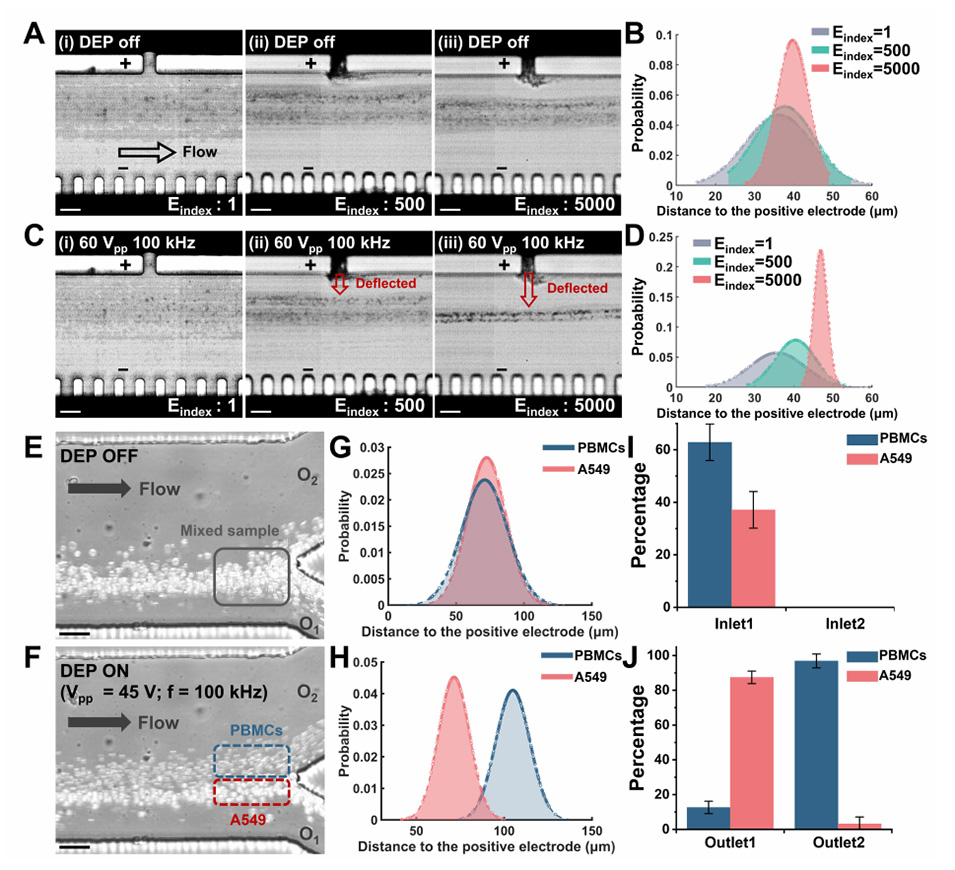
图6.使用5000对电极装置进行高通量DEP分离。
在高通量微流控设备中使用液态金属合金(LMA)构建厚电极具有以下几个优点:
1.导电性:LMA具有出色的导电性,可在微通道中产生强大的电场。这就实现了高效的介电泳(DEP)粒子操纵和分离。
2.流动性和易于图案化:LMA的流动性和易图案化性使其成为共同制造和自对准厚电极和样品微通道的理想材料。这简化了制造过程,并允许创建复杂的电极图案。
3.结构紧凑:LMA电极可集成到微流控设备中,占地面积小,可在有限空间内实现高密度电极阵列。这有助于实现高通量颗粒分离,同时优化空间利用率。
4.高通量能力:使用LMA电极可在垂直方向上保持更均匀的电场分布,使DEP力作用于整个微通道空间中的颗粒。这就提高了颗粒分离的吞吐量。
5.多功能性和坚固性:LMA电极为DEP分离应用提供了一个坚固耐用的多功能平台,可根据尺寸和介电特性高效分离各种生物颗粒。
总之,在高通量微流控设备中使用LMA构建厚电极可综合利用电气、机械和操作方面的优势,提高DEP粒子分离的效率和效果。
论文链接:https://doi.org/10.1002/adma.202310212














