传统的水产基质标准物质加标方法难以控制基质中的药物含量,尤其是对于含有多种药物的基质而言。鱼糜常用于水产品基质标准物质的制备,但其粘性大,操作困难。药物负载能力是影响基质标准物质有效性的关键因素。

近期,中国水产科学研究院刘欢研究员团队提出了一种基于微流控技术的新型加标方法,以同时提高七种喹诺酮类药物在鱼糜基质中的负载能力。相关研究以“Improving and controlling the drug loading capacity of seven quinolones in minced fish matrix based on microfluidics”为题目,发表在期刊《International Journal of Biological Macromolecules》上。
本文要点:
1、本研究提出了一种基于微流控技术的新型加标方法,以同时提高七种喹诺酮类药物在鱼糜基质中的负载能力。
2、将新鲜草鱼组织研磨、精滤、离心并在蒸馏水中复溶形成液体样品,随后将其与海藻酸钠溶液(1%)以1:1.2的比例混合。
3、向混合溶液中添加等浓度的7种喹诺酮类药物,利用微流控技术制备均匀的鱼胶微球。
4、结果表明,7种喹诺酮类药物的回收率在82.54%~114.17%之间,与传统方法相比,这些喹诺酮类药物的载药量显著提高。
5、此外,可以精确控制基质中的药物浓度。基质中7种喹诺酮类药物的浓度与其初始浓度之间存在较强的线性关系,可为其他基质标准物质的开发提供参考。
全文总结/概括:
微流控技术在制备鱼糜基质标准物质中相比传统方法有哪些优势?
1、提高药物负载能力:微流控技术能够确保药物与鱼肉组织在凝胶微球中充分混合,从而提高基质中的药物负载能力。
2、精确控制药物浓度:微流控技术能够精确控制基质中的药物浓度,这对于分析化学中的仪器校准、分析方法验证和质量控制等任务至关重要。
3、制备均匀的凝胶微球:微流控技术可以制备出尺寸一致的凝胶微球,这有助于确保相同重量的样品中包含相同数量的凝胶微球,从而保持药物含量的一致性。
4、解决传统方法的局限性:传统的药物添加方法(如药物浴法和喷雾法)在制备含有多种药物的基质标准物质时存在一些限制,例如难以保证不同批次之间的一致性和稳定性,以及难以实现多种药物在基质中的均匀分布。微流控技术通过流体剪切力制备均匀的凝胶微球,有效解决了这些问题。
5、提高重复性和样品的均匀性:微流控方法制备的凝胶微球显示出更好的重复性和样品均匀性,这对于确保分析结果的准确性和可靠性非常重要。
6、避免药物损失:鱼糜凝胶微球中的海藻酸钙网络结构具有药物锁定功能,可减少冻干过程中的药物流失,从而提高药物负载能力。
微流控技术如何确保鱼糜基质中药物分布的均匀性?
1、精确控制流体混合:微流控技术通过精确调控微尺度流体,利用流体动力学的优势,实现药物溶液与鱼糜基质的均匀混合。
2、制备尺寸一致的凝胶微球:微流控芯片能够产生大小一致的凝胶微球,确保每个微球中的药物含量相同,从而提高整体的药物分布均匀性。
3、优化实验条件:通过优化SA(海藻酸钠)浓度、混合比例等实验条件,确保凝胶微球的物理化学性质,如弹性、硬度和含水量,从而促进药物的均匀吸收。
4、荧光标记验证:通过在混合溶液中添加荧光素钠,制备凝胶微球后,使用显微镜观察荧光素的分布,验证了药物在凝胶微球中的均匀分布。
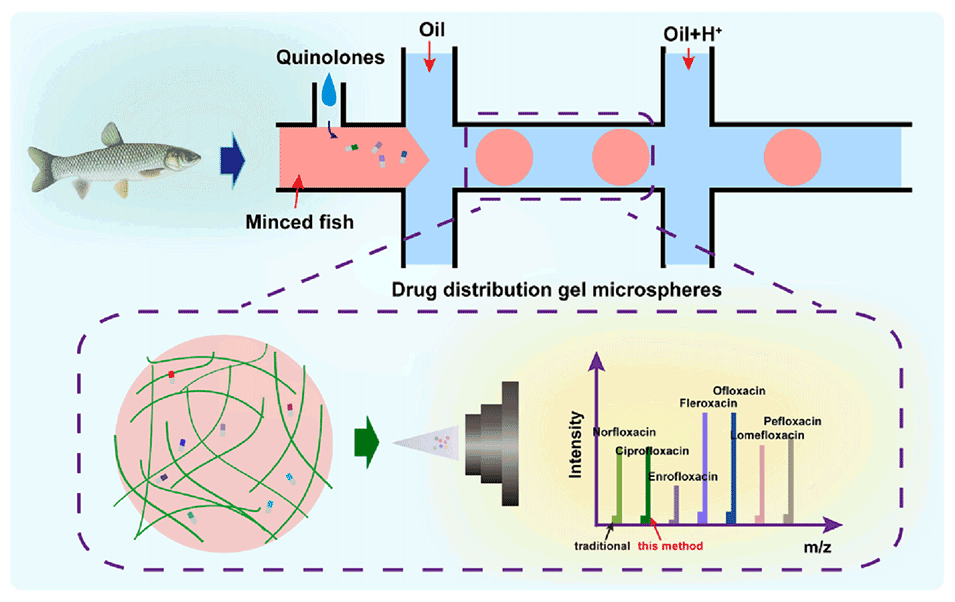
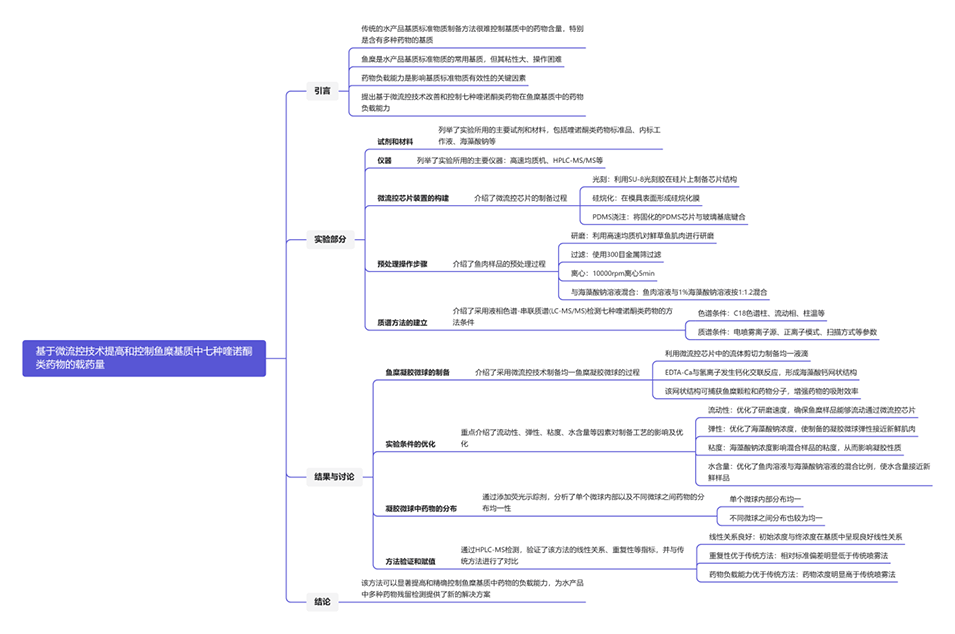
图1.鱼糜凝胶微球的制备示意图。在微流控芯片中通过流体剪切制备均匀的鱼糜凝胶微球,并通过高效液相色谱质谱法检测药物浓度。
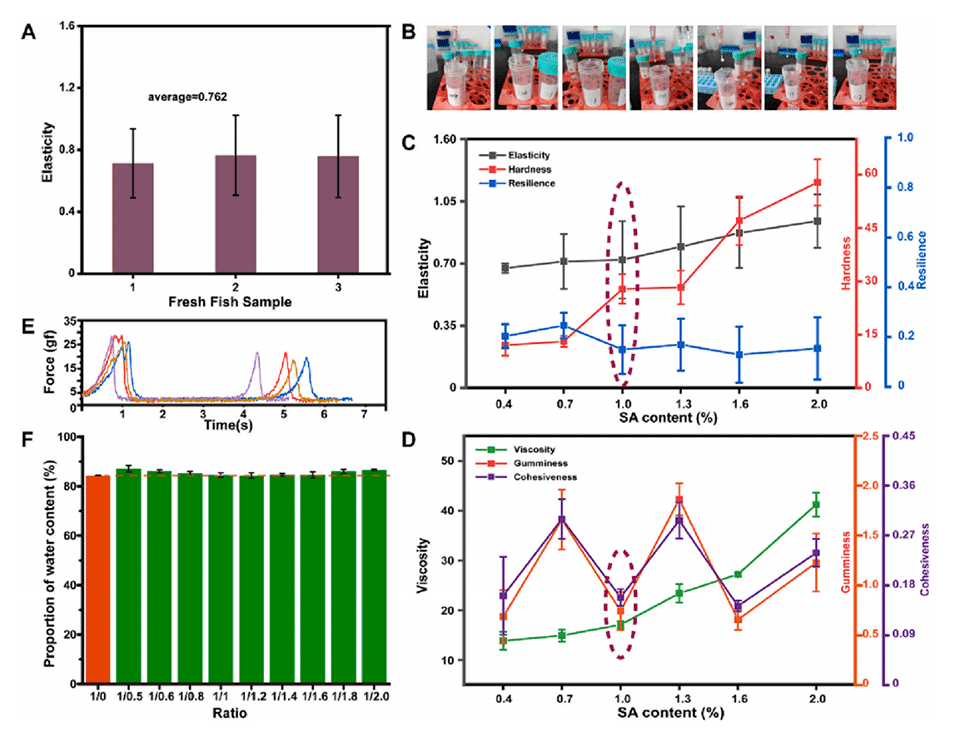
图2.鱼糜凝胶特性的表征。

图3.鱼胶微球的表征图。
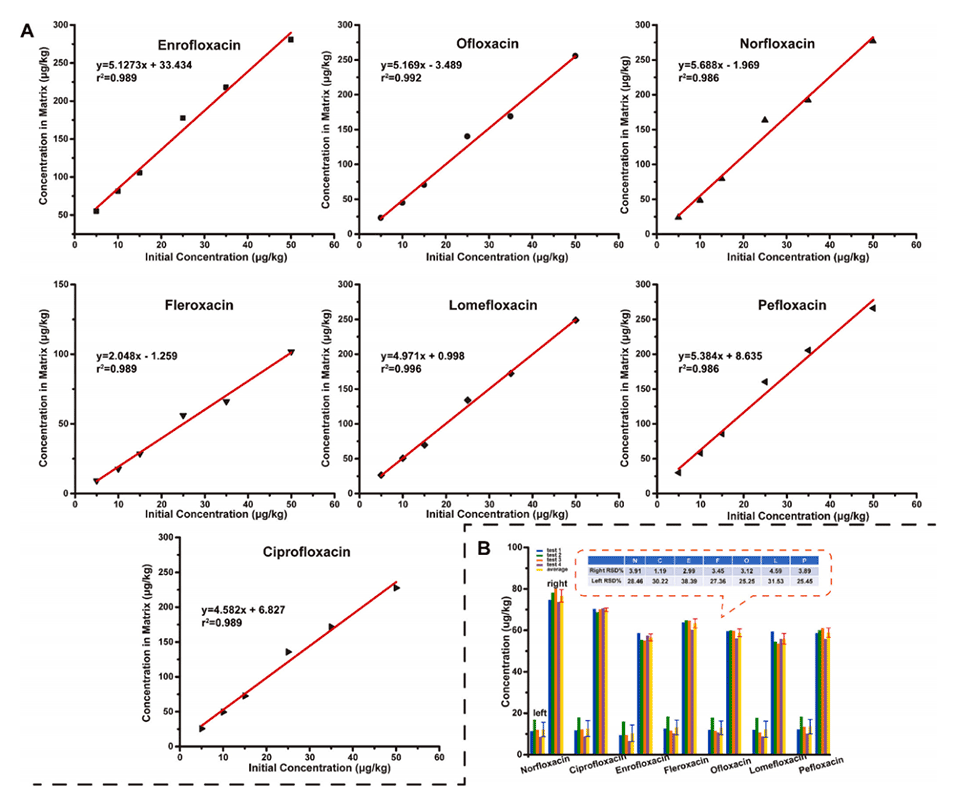
图4.可控性和再现性验证。
原文链接:https://doi.org/10.1016/j.ijbiomac.2024.131188














