
导读:
近期,四川大学巨晓洁教授&褚良银教授团队开发了一种基于液滴微流控的简单而高效的方法,用于可控制备具有优异生物相容性和可调理化特性的单分散透明质酸(HA)微球。相关研究以“Microfluidic Fabrication of Monodisperse Hyaluronic Acid Microspheres with Excellent Biocompatibility and Tunable Physicochemical Properties”为题目发表于期刊《Industrial & Engineering Chemistry Research》。
本文要点:
1、本研究开发了一种基于液滴微流控的简单而高效的方法,用于可控制备具有优异生物相容性和可调理化特性的单分散透明质酸(HA)微球。
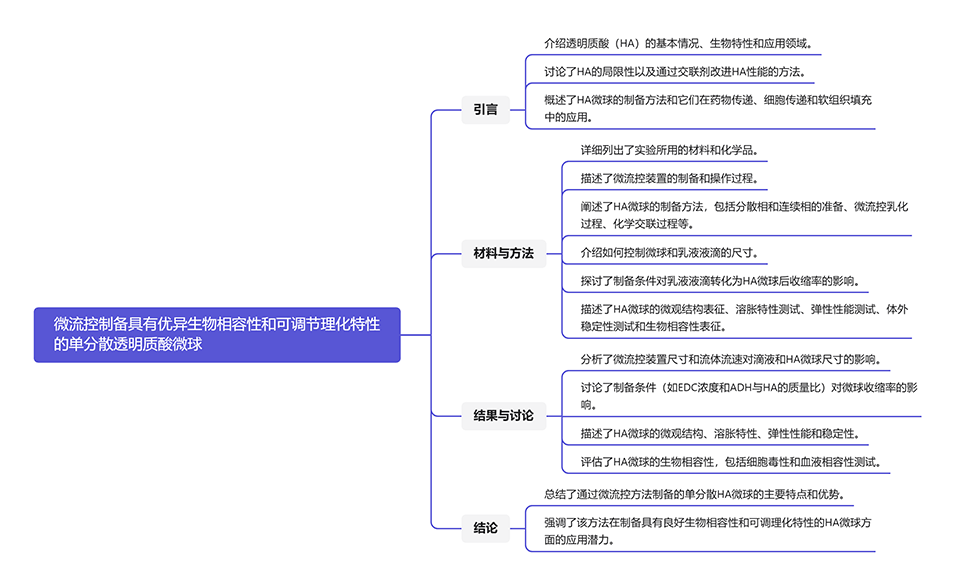
2、通过在HA分散相中使用己二酸二酰肼(ADH)作为交联剂,在收集液中使用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)作为活化剂,以微流控乳液液滴为模板,一步即可高效获得尺寸均匀、生物相容性优异的化学交联透明质酸微球。
3、通过调整微流控装置的尺寸以及分散相和连续相的流速,可以精确控制液滴模板和交联HA微球的尺寸。
4、通过调节收集液中的EDC浓度和分散相中ADH与HA的质量比,可以调节HA微球的溶胀特性、弹性特性和稳定性。
5、体外血液相容性和细胞实验表明,制备的HA微球具有良好的生物相容性。
6、本研究提出的策略和结果为简单高效地制备具有出色生物相容性和可调理化特性的单分散透明质酸微球提供了宝贵的指导意见,满足了多个领域对于高性能生物材料的迫切需求。
全文总结/概括:
本研究提出的基于液滴微流控的方法在制备透明质酸微球方面具有以下优势:
1、尺寸精确控制:通过调整微流控装置的尺寸和流体的流速,可以精确控制生成的乳液液滴和HA微球的大小,实现高度一致的微球尺寸。
2、单分散性:微流控技术能够生成单分散的乳液液滴,从而制备出大小均匀的HA微球,这对于药物递送和组织工程等应用至关重要。
3、生物相容性:使用ADH作为交联剂和EDC作为活化剂,可以在一步法中高效制备化学交联的HA微球,这些微球展现出优异的生物相容性。
4、理化特性可调:通过调节EDC浓度和ADH与HA的质量比,可以调节HA微球的溶胀特性、弹性和稳定性,满足不同应用场景的需求。
5、简化的制备流程:与需要多步骤或额外处理(如透析、冻干)的传统方法相比,本方法简化了HA微球的制备流程,提高了制备效率。
6、高产量和可扩展性:微流控技术能够实现高通量的微球制备,适合大规模生产,具有很好的可扩展性。
7、减少材料浪费:由于微球的尺寸和分布高度一致,可以减少因尺寸不一致导致的材料浪费,提高材料的利用效率。
8、潜在的多功能性:通过微流控技术,可以在微球中集成多种功能性组分,例如药物载体、生长因子、或细胞粘附分子等,为多功能集成提供了可能。
所制备的尺寸可控、生物相容性优异的单分散交联透明质酸微球的潜在应用包括:
1、药物递送系统:微球可以作为药物载体,实现药物的控制释放,提高疗效并减少副作用。
2、细胞递送:在组织工程中,微球可作为细胞的三维支架,促进细胞的附着、生长和分化。
3、软组织填充:在美容医学和整形外科中,微球可用于填充软组织,改善皮肤凹陷或其他缺陷。
4、止血材料:由于其优异的生物相容性,微球可以用于止血,尤其是在外科手术中控制出血。
5、化妆品和皮肤护理:透明质酸微球可以用于保湿和改善皮肤质量,作为化妆品的活性成分。
6、生物传感器:微球可以集成到生物传感器中,用于检测生物分子或细胞的特定相互作用。
7、诊断成像:功能化的透明质酸微球可以用于医学成像,增强对比度或作为特定组织的标记物。
这些应用利用了透明质酸微球的独特理化特性和生物相容性,为多种医疗和健康相关领域提供了创新解决方案。
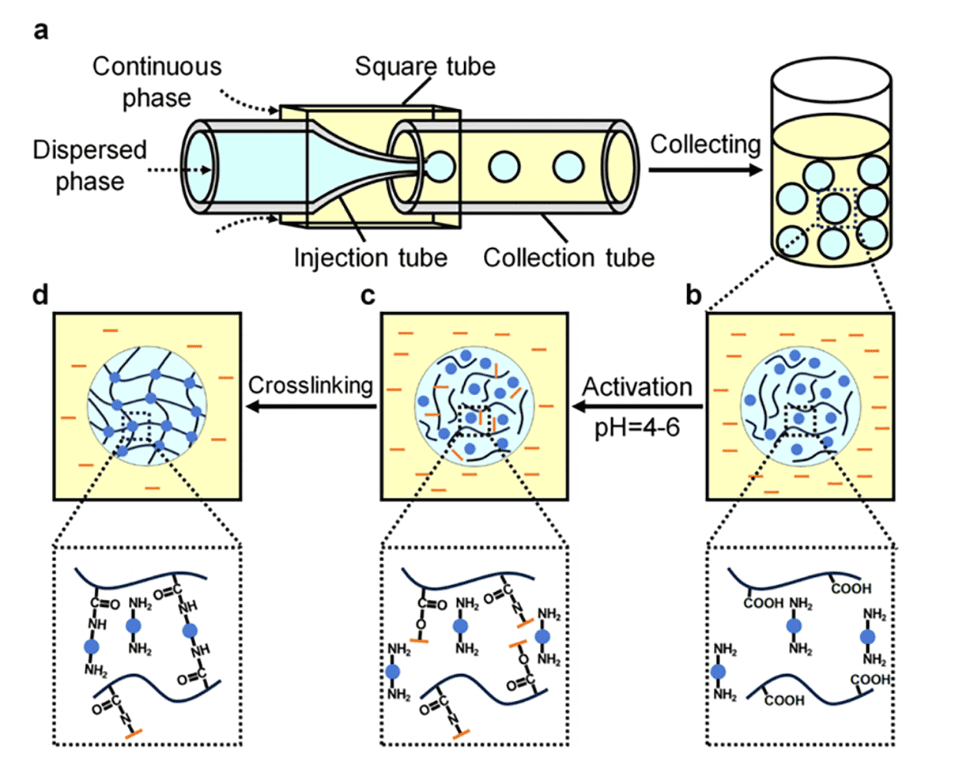
图1.单分散HA微球的制备示意图。
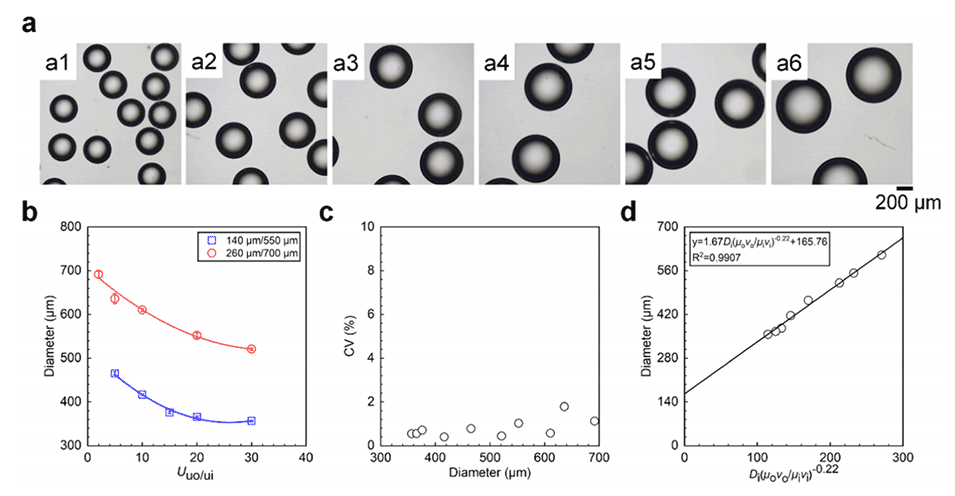
图2.微流控装置的尺寸以及内外相流体的流速对液滴尺寸的影响。
图3.微流控装置的尺寸以及内外相流体的流速对HA微球尺寸的影响。
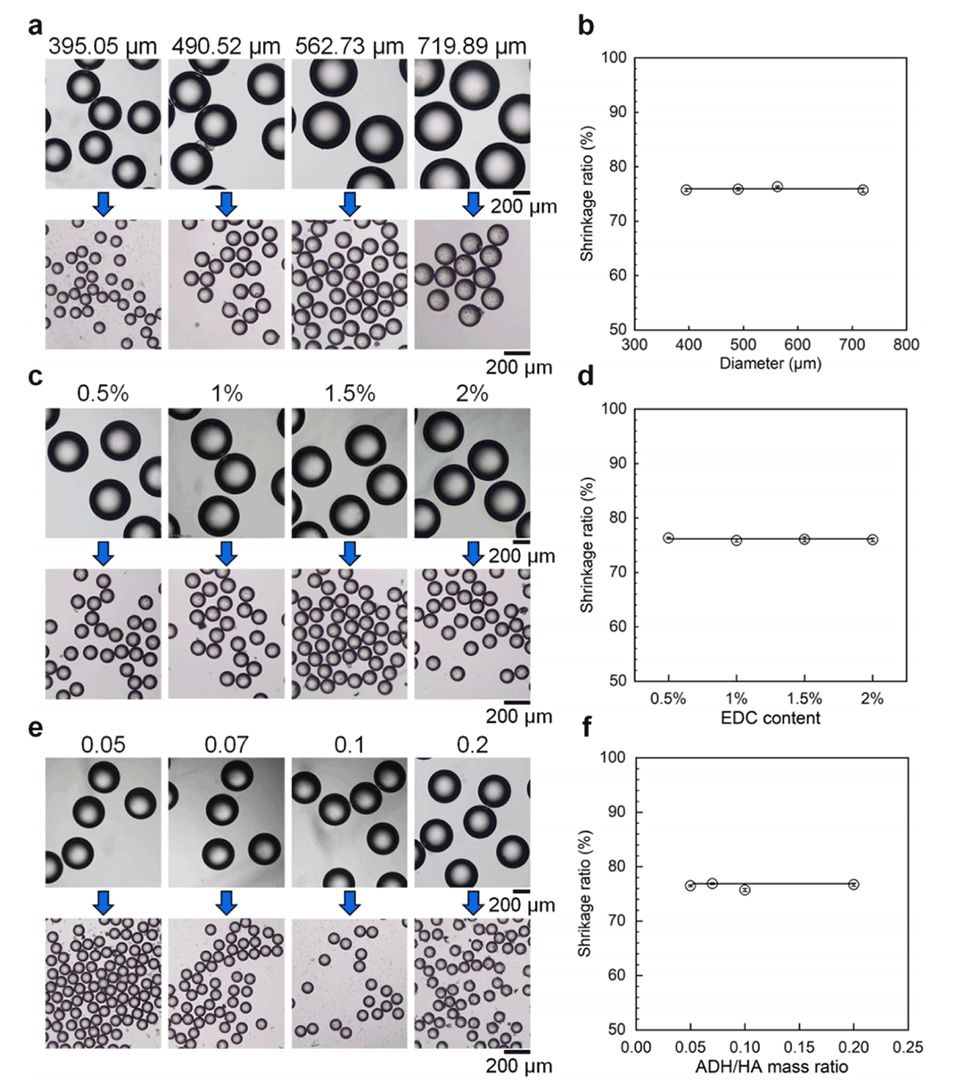
图4.液滴尺寸(a,b)、EDC浓度(c,d)以及ADH与HA的质量比(e,f)对转化为微球后液滴收缩率的影响。(a,c,e)液滴(上排)和相应生成的微球(下排)的光学图像。(b,d,f)定量关系。

图5.在不同EDC浓度(a,a′)和不同ADH与HA质量比(b,b′)下制备的HA微球的表面(a,b)和横截面(a′,b′)的SEM图像。(a1,a1′)0.5%,(a2,a2′)1%,(a3,a3′)1.5%,(a4,a4′)2%。(b1,b1′)0.05,(b2,b2′)0.07,(b3,b3′)0.1,(b4,b4′)0.2。
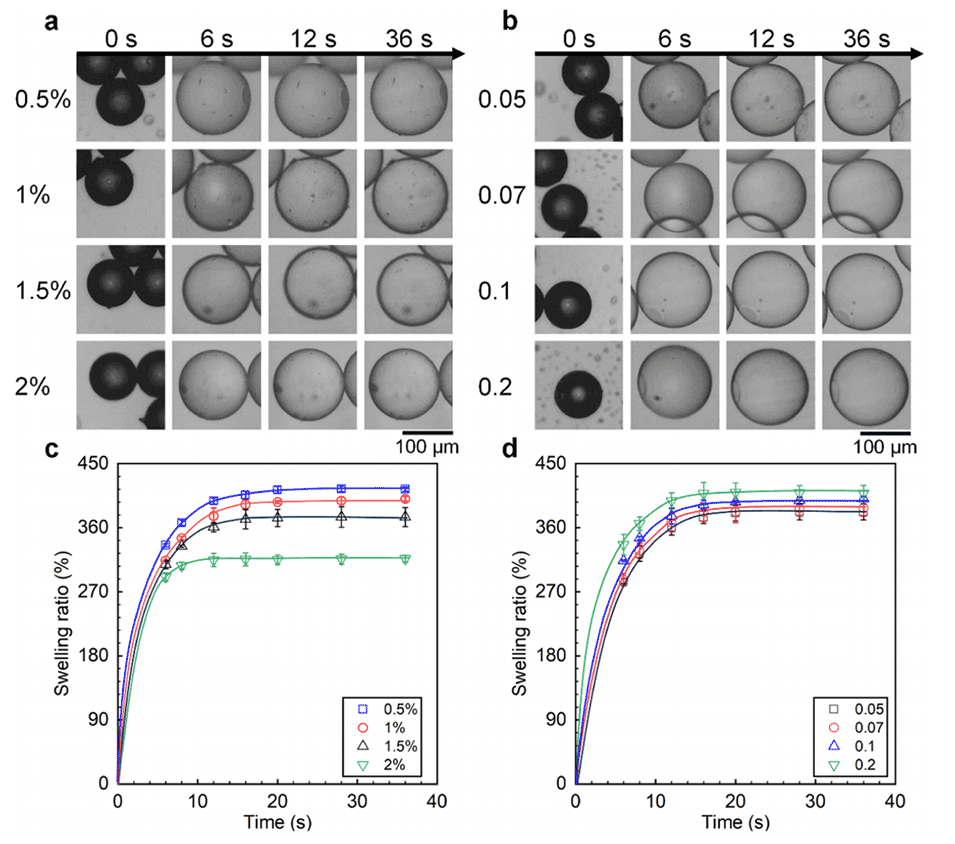
图6.(a,b)以0.5%、1%、1.5%和2%的EDC浓度制备的干燥HA微球的溶胀过程的光学显微照片(a),以及以0.05、0.07、0.1、0.2的ADH与HA的质量比制备的干燥HA微球在生理盐水溶液中于不同时间间隔下的溶胀过程。(c,d)EDC浓度(c)和ADH与HA的质量比(d)对HA微球在生理盐水溶液中的溶胀率的影响。
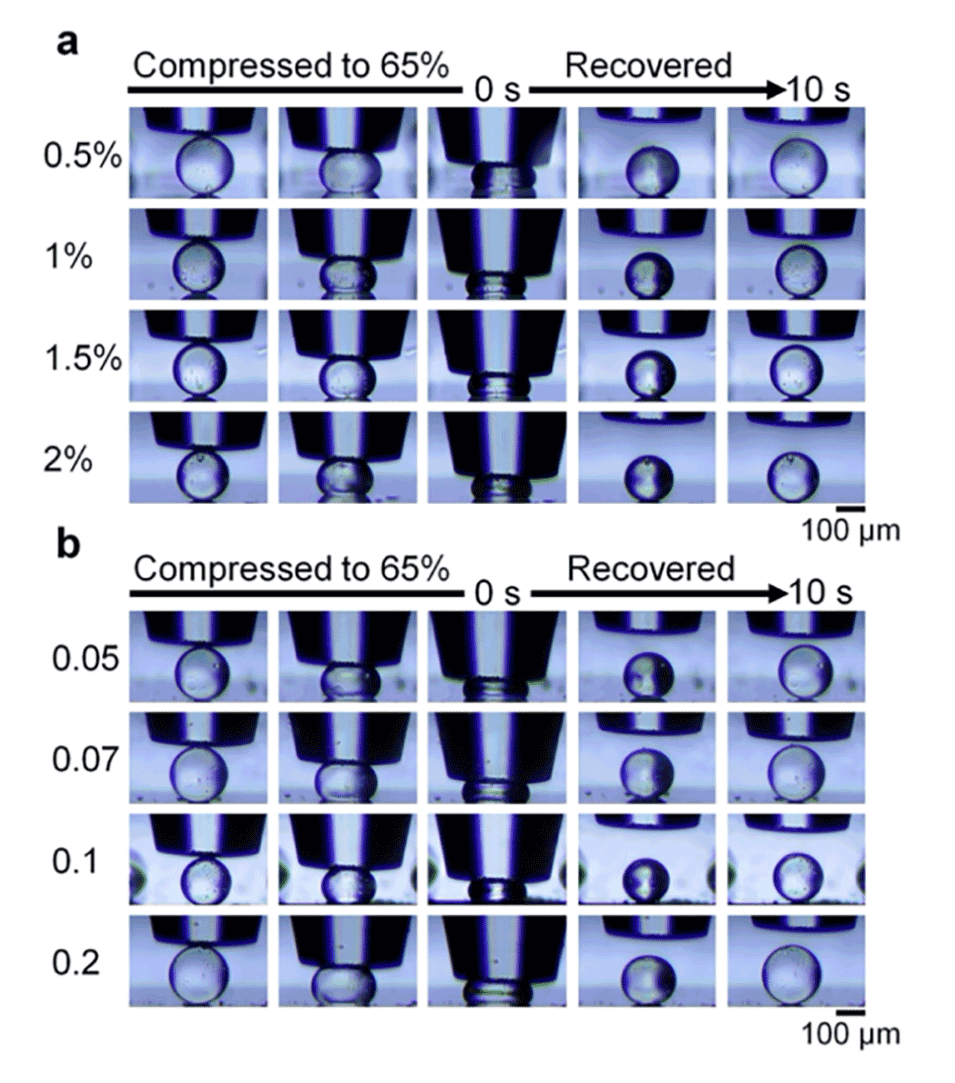
图7.在不同EDC浓度(a)和不同ADH与HA质量比(b)下制备的HA微球的压缩和恢复过程的光学图像。
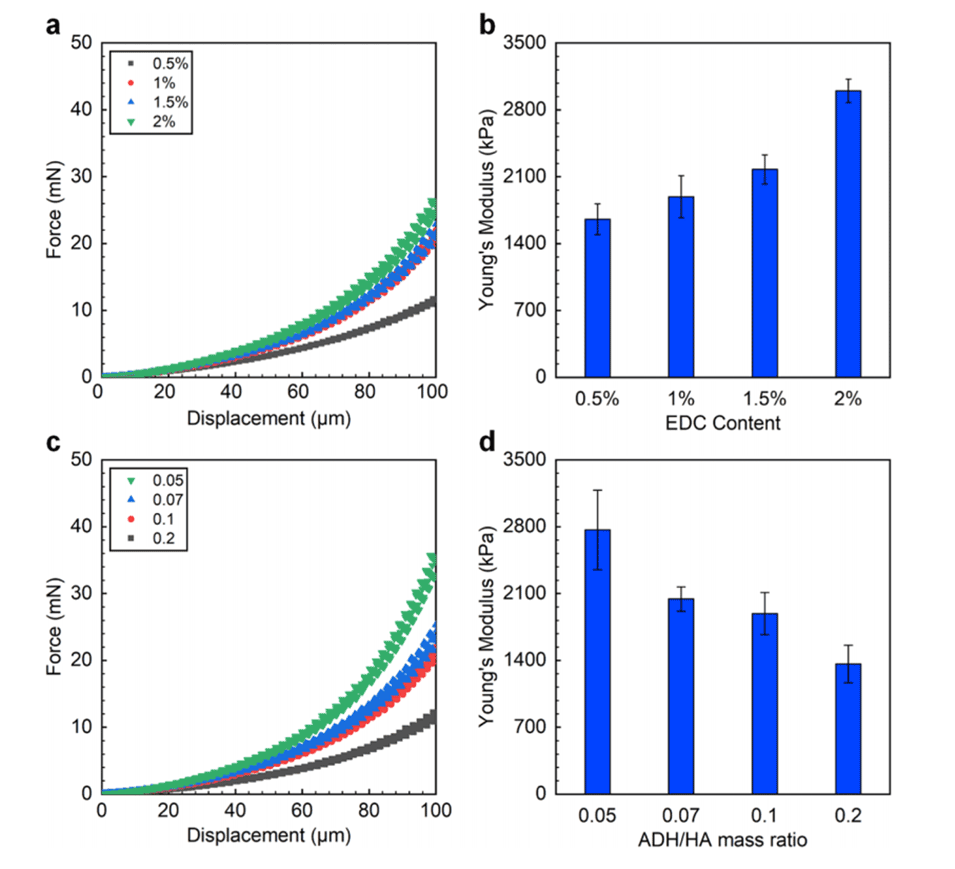
图8.(a,c)在不同EDC浓度(a)和不同ADH与HA质量比(c)下制备的HA微球的力-位移曲线。(b,d)EDC浓度(b)和ADH与HA的质量比(d)对HA微球的杨氏模量的影响。
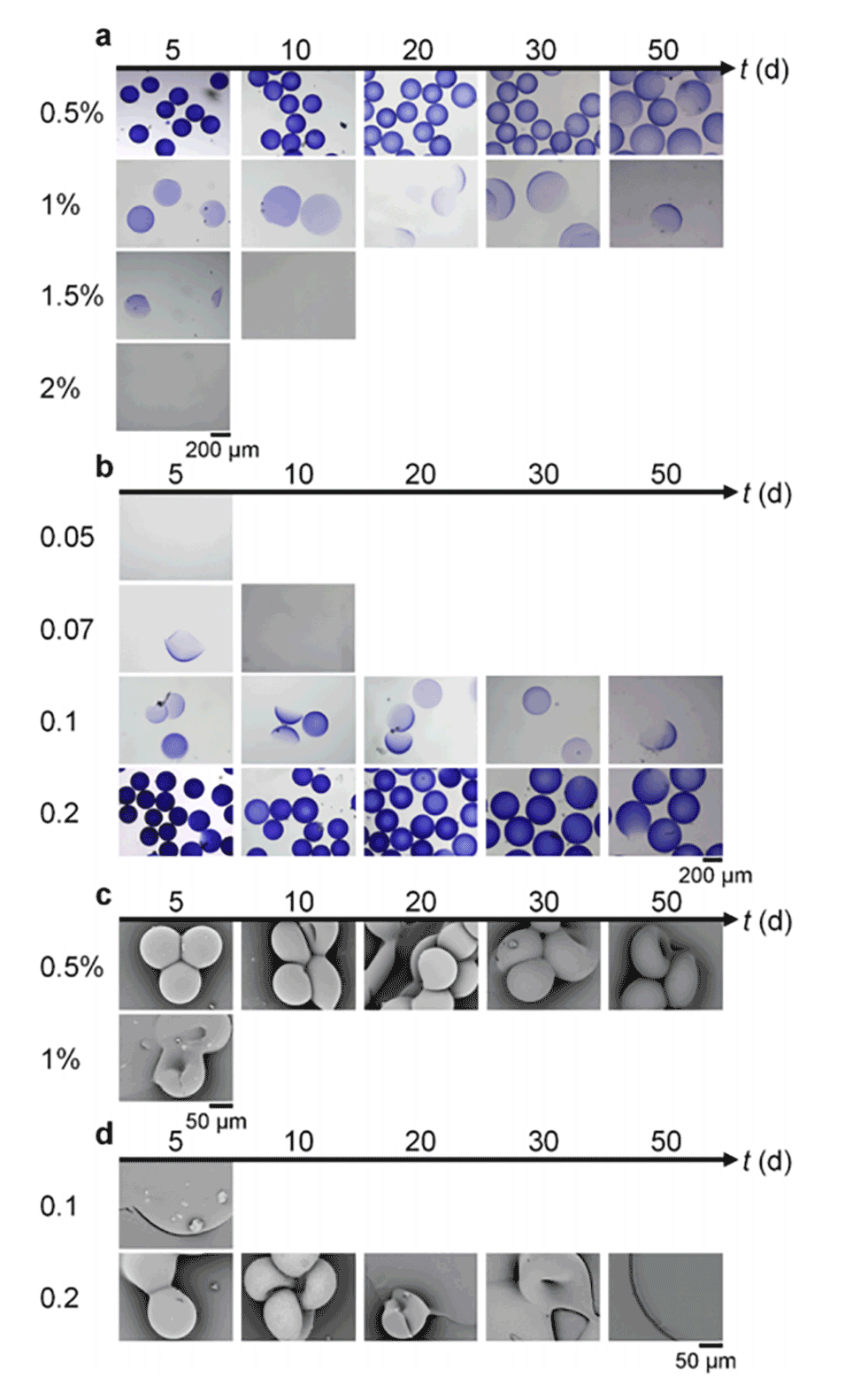
图9.以不同EDC浓度(a,c)和不同ADH与HA质量比(b,d)制备的HA微球在PBS中孵育5、10、20、30和50天的光学(a,b)和SEM(c,d)图像。
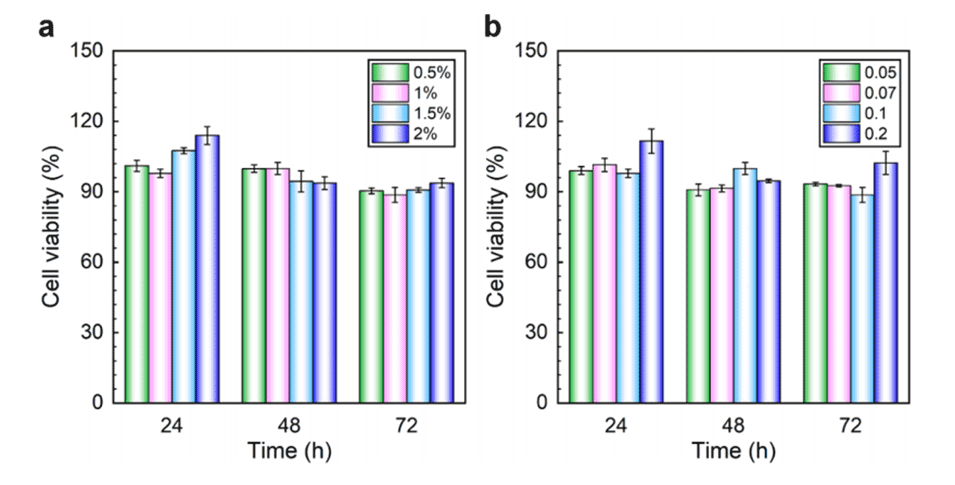
图10.以不同EDC浓度(a)和不同ADH与HA质量比(b)制备的HA微球在与L929细胞孵育24、48和72小时后的细胞存活率。
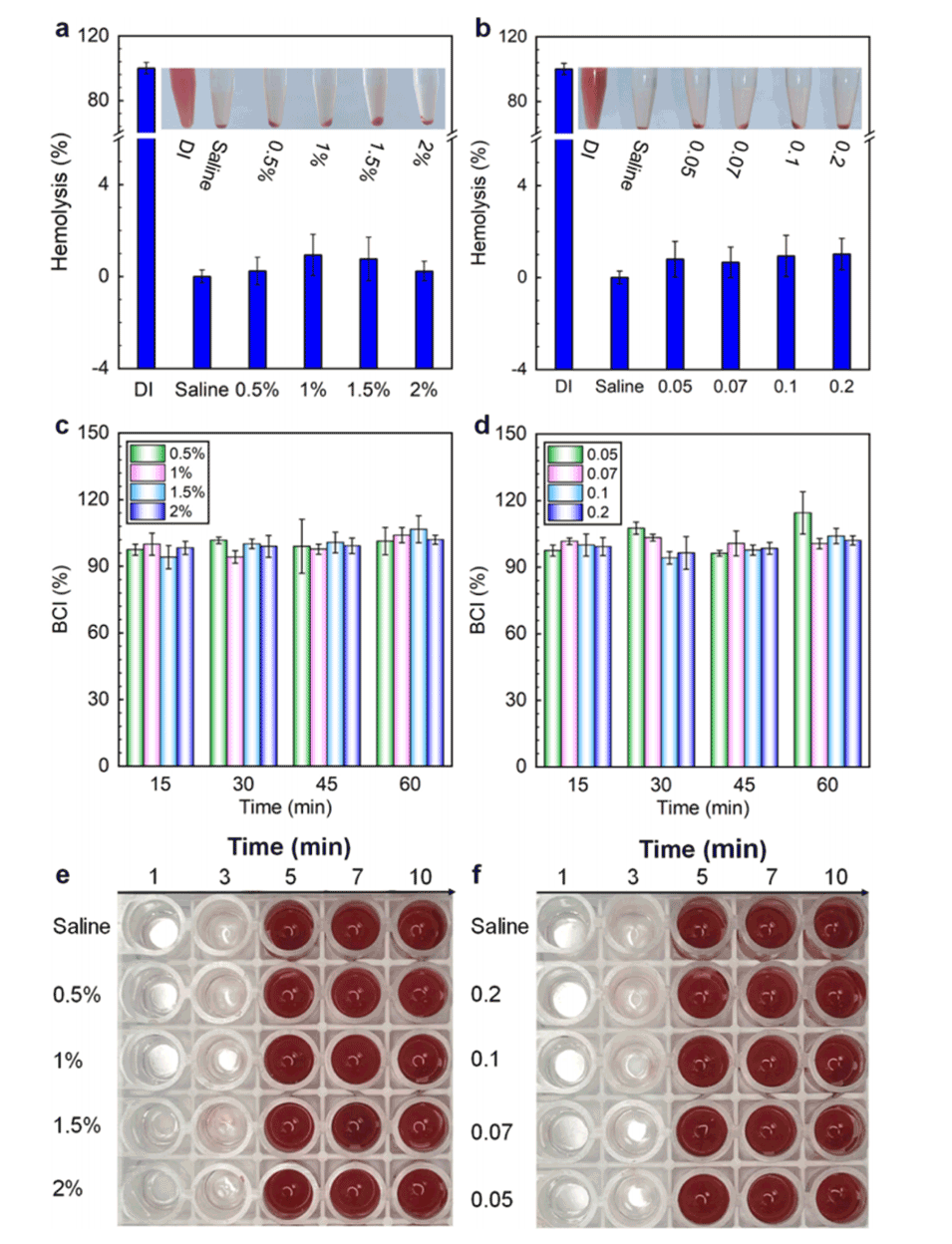
图11.EDC浓度(a,c,e)和ADH与HA的质量比(b,d,f)对HA微球的溶血率(a,b)、凝血指数(c,d),以及在1、3、5、7和10分钟观察到的凝血情况(e,f)的影响。
原文链接:https://doi.org/10.1021/acs.iecr.4c00337














