生物相容性水凝胶微粒由于其与生物细胞外基质的相似性,成为多种生物医学应用的理想材料。其中,非球形水凝胶微粒(NSHPs)因其形状各向异性而备受关注。特别是在消化道疾病的临床治疗中,具有高度可调结构和功能的NSHPs被认为是用于胃肠道药物管理的理想粘附载体。
与球形粒子相比,NSHPs可以在生理环境中提供独特的运动特性、更大的表面积以增强粘附性、更高的封装物质扩散效率,以及更好的特定组织黏附能力。为了合成具有独特结构的NSHPs,研究者们已经探索出了包括微模塑、逐层沉积、光刻和微流控在内的多种技术。在这些技术中,微流控方法具有显著的优势,因为它可以更好地控制微流动模式,以简单和可扩展的方式生成单分散的NSHPs。

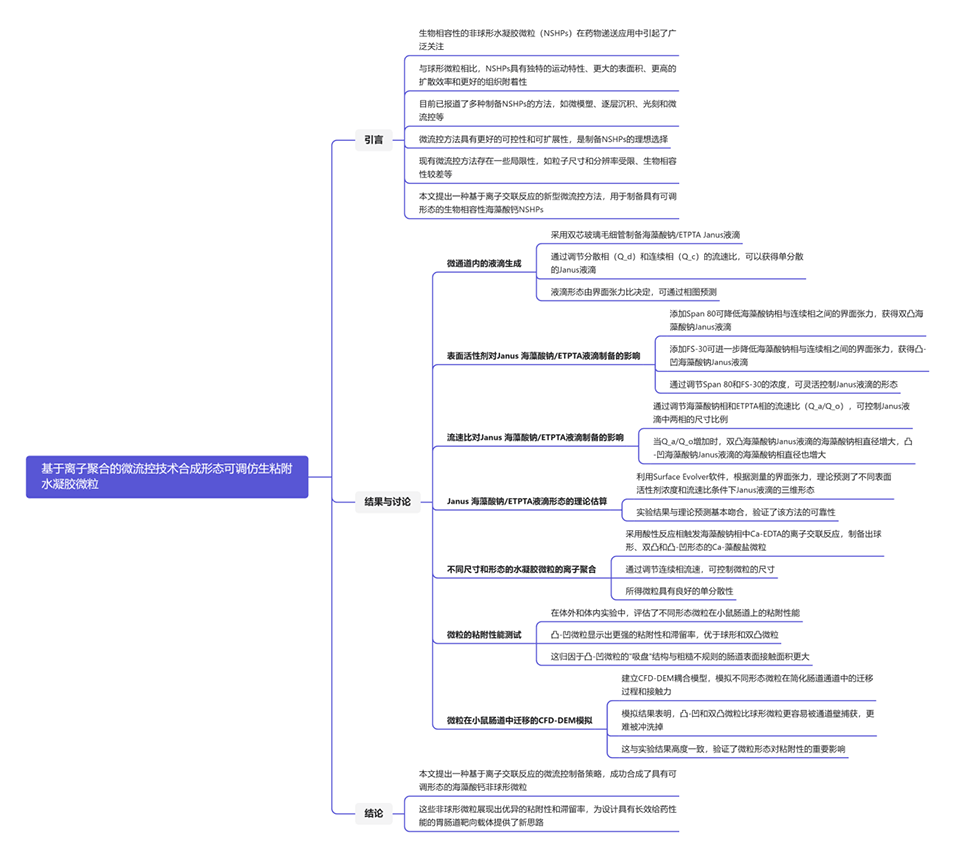
近期,清华大学徐建鸿教授团队提出了一种基于离子聚合的新型微流控方法,用于生成具有可调形态的海藻酸钙NSHPs。这种方法利用Janus乳液,通过精确控制多相系统中的流速条件和表面活性剂浓度,生成了具有不同形态的水凝胶微粒。相关研究以“Ionic Polymerization-Based Synthesis of Bioinspired Adhesive Hydrogel Microparticles with Tunable Morphologies from Microfluidics”为题目,发表在期刊《ACS Applied Materials & Interfaces》上。
本文要点:
1、受天然吸盘优良粘附能力的启发,本研究利用Janus乳液,首次通过离子交联反应在微流控芯片上制备了具有可调形态的海藻酸钙NSHPs。
2、通过调节界面张力和流速比,成功制备了具有双凸和凸-凹形状的海藻酸钙微粒,平均直径分别为168μm和159μm,且均匀性良好。
3、对所制备的海藻酸钙NSHPs在体外和体内的粘附能力进行了评估,发现形状各向异性微粒相较于球形微粒展现出更优的粘附特性。
4、采用计算流体动力学和离散元方法(CFD-DEM)耦合模拟,从理论上评估了不同形状微粒在模拟肠道中的迁移和接触力,结果与实验观察一致。
5、这种简单、可扩展的制备策略为设计具有优异粘附性和滞留率的胃肠道靶向给药系统提供了新思路。
全文总结/概括:
为什么选择离子聚合而不是传统的光聚合来合成海藻酸钙水凝胶微粒?
1、生物相容性考量:光聚合过程中使用的UV光和光引发剂可能对生物组织产生毒性,而离子聚合不依赖于这些潜在有害的化学物质,提供了一种更为生物相容的合成途径。
2、避免细胞毒性:某些光引发剂已被证实具有细胞毒性,可能引起基因突变或影响细胞功能。离子聚合作为一种无光引发剂的方法,降低了细胞毒性的风险。
3、材料适用性:光聚合通常局限于特定的光敏材料,而离子聚合可应用于包括海藻酸钙在内的多种天然和合成聚合物,这为设计具有特定功能的水凝胶微粒提供了更多可能性。
4、生产过程的稳定性:离子聚合不依赖于光源,因此在生产过程中不会受到光照条件变化的影响,提供了更为稳定和可重复的合成条件。
5、形态多样性:微流控技术结合离子聚合可以精确控制微粒的形态和尺寸,这对于设计具有特定释放特性的药物输送系统至关重要,而光聚合通常受到光源分布和光掩模限制。
6、快速反应:离子聚合可以在较短的时间内完成,这对于在微流控芯片上快速生成大量微粒极为关键,有助于极大地提升生产效率。
非球形海藻酸钙水凝胶微粒在药物输送中相比传统球形微粒的优势包括:
1、增强的粘附性:非球形微粒,尤其是具有特定形状如凸-凹形状的微粒,在生物体内的粘附性能更强,这有助于药物在目标部位的持久释放。
2、更大的接触面积:非球形微粒提供了更大的接触面积,这增加了与生物体内壁的接触,从而可能提高药物的吸收效率。
3、改善的运动特性:在生理环境中,非球形微粒展现出与球形微粒不同的运动特性,有助于在复杂生物系统中的导航和定位。
4、形态多样性:通过微流控技术,可以精确控制微粒的形态,从而设计出适合特定药物输送需求的微粒形状。
5、可控的释放特性:非球形微粒的形态可以影响药物的释放动力学,实现更为可控和持续的药物释放。
6、生物相容性和安全性:海藻酸钙作为一种已被广泛研究和应用的生物材料,具有优良的生物相容性,且在本研究中避免了使用UV光和光引发剂,减少了潜在的细胞毒性问题。
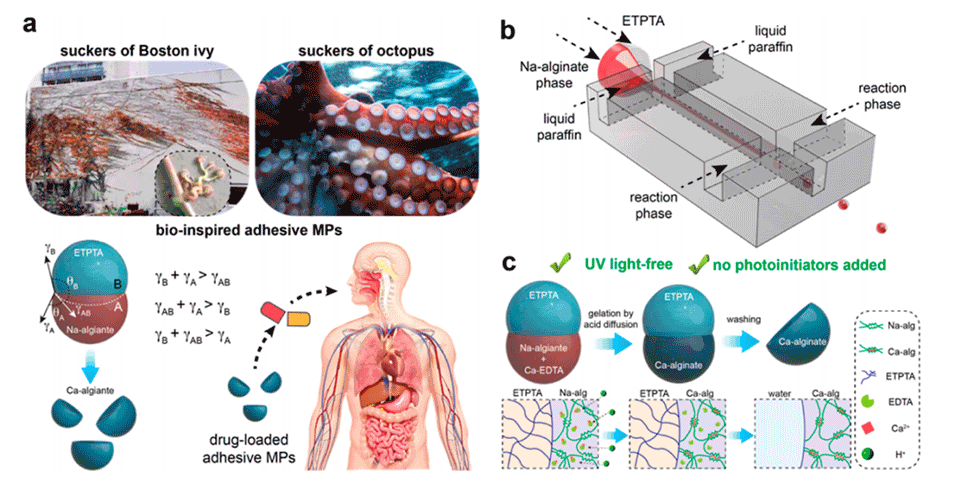
图1.微流控生成具有可调结构的海藻酸钙仿生粘性水凝胶微胶囊。
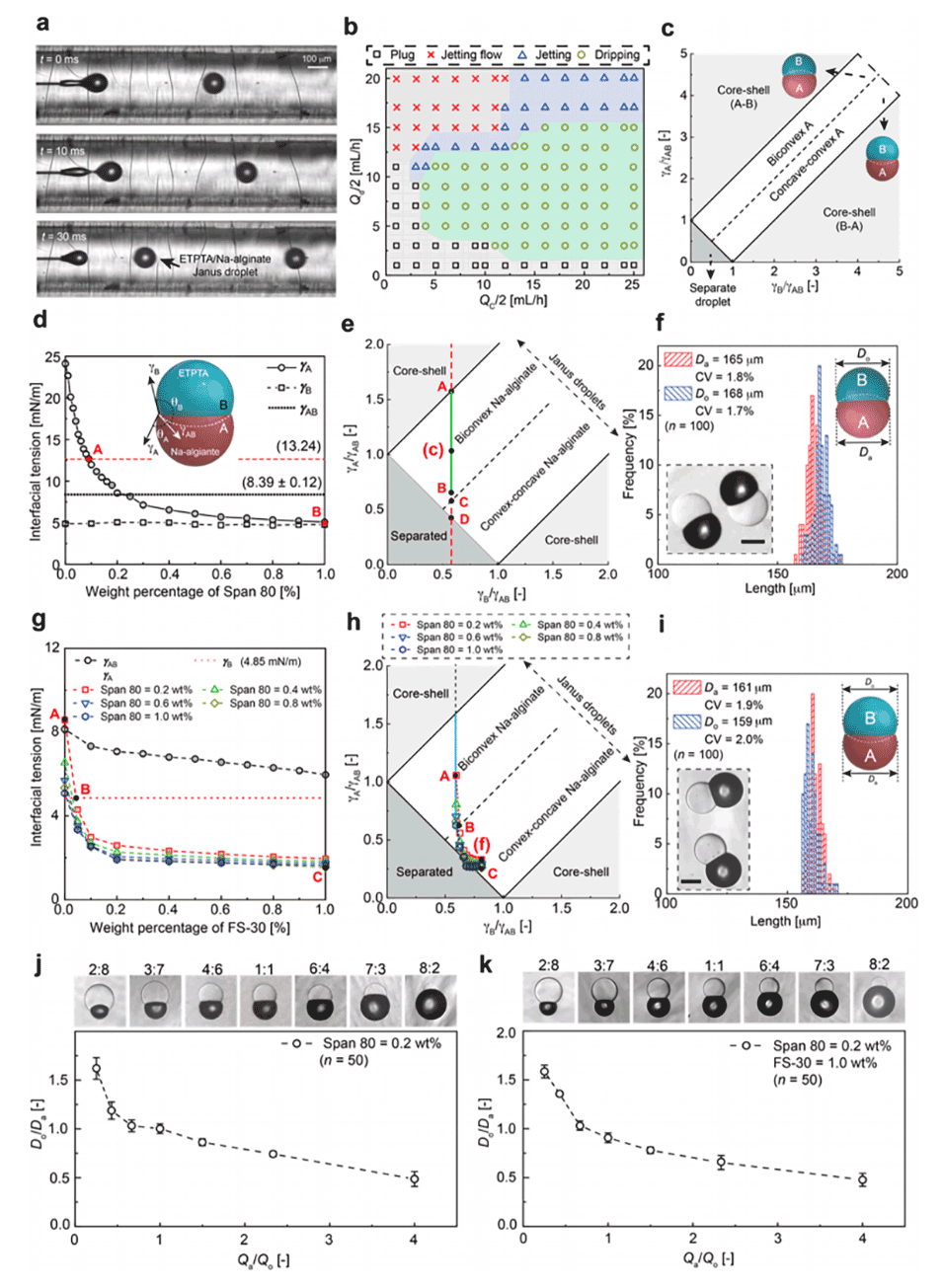
图2.Janus藻酸钠/ETPTA液滴的生成。
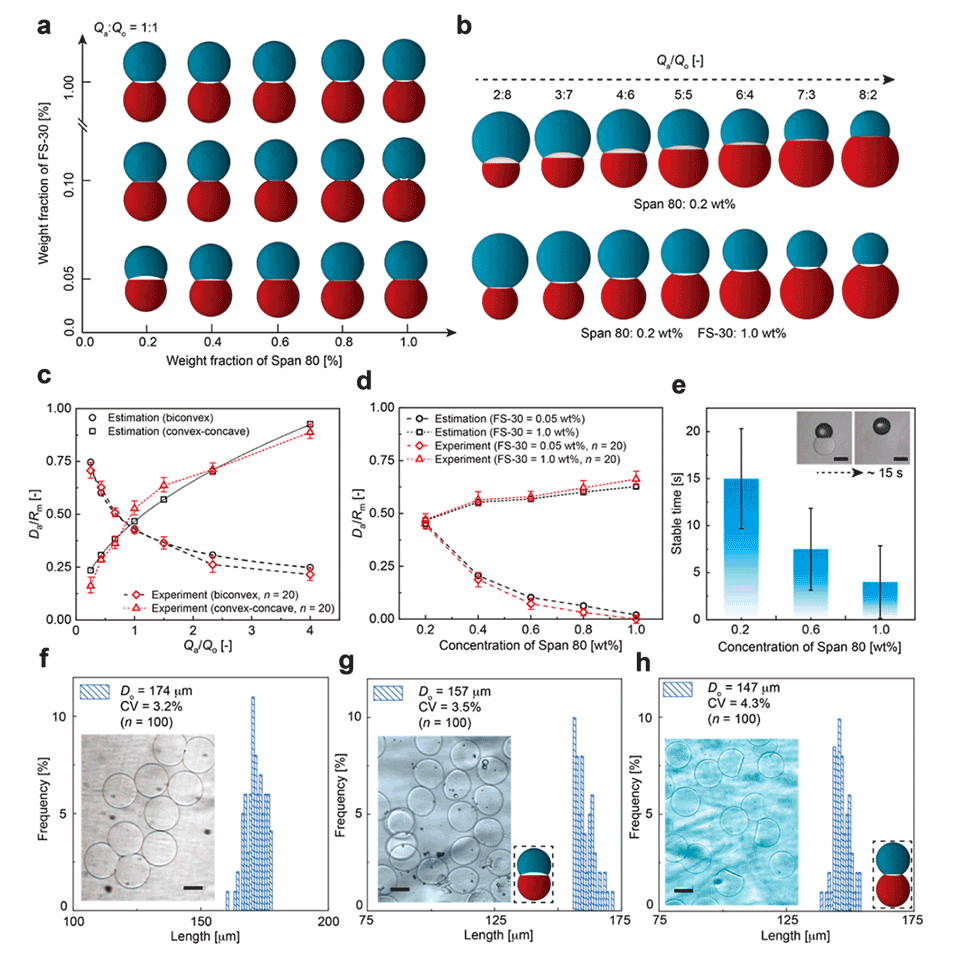
图3.非球形藻酸钙水凝胶微粒的制备。
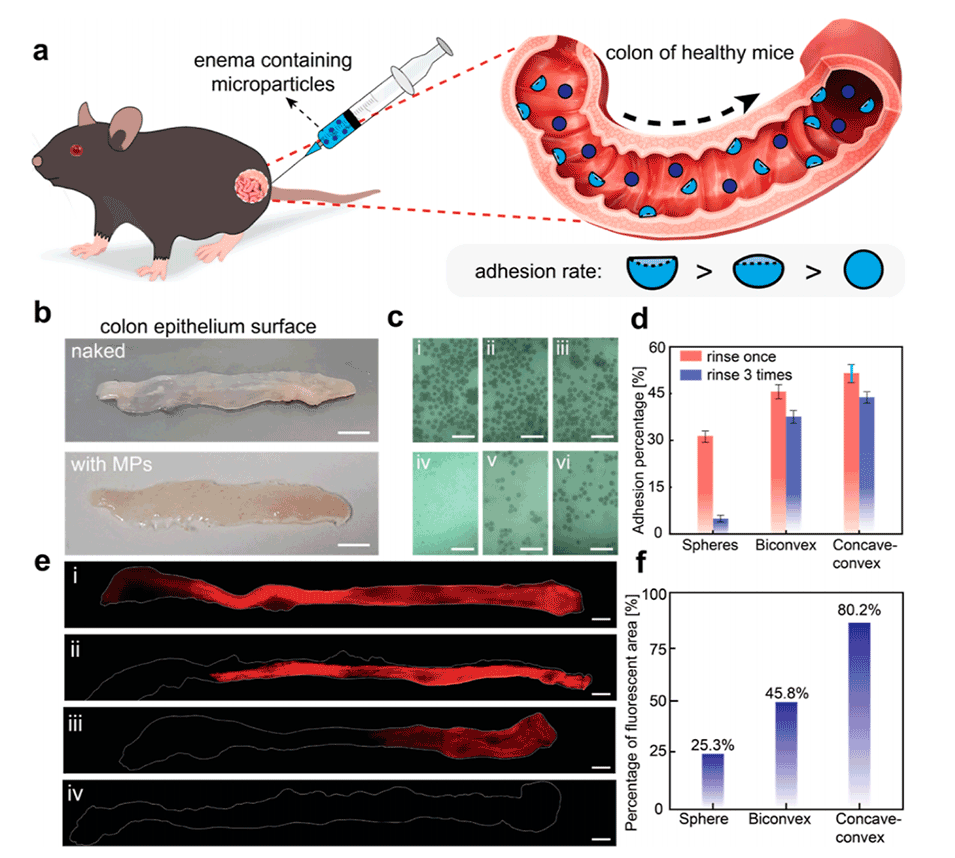
图4.获得的水凝胶微粒的粘附能力测试。
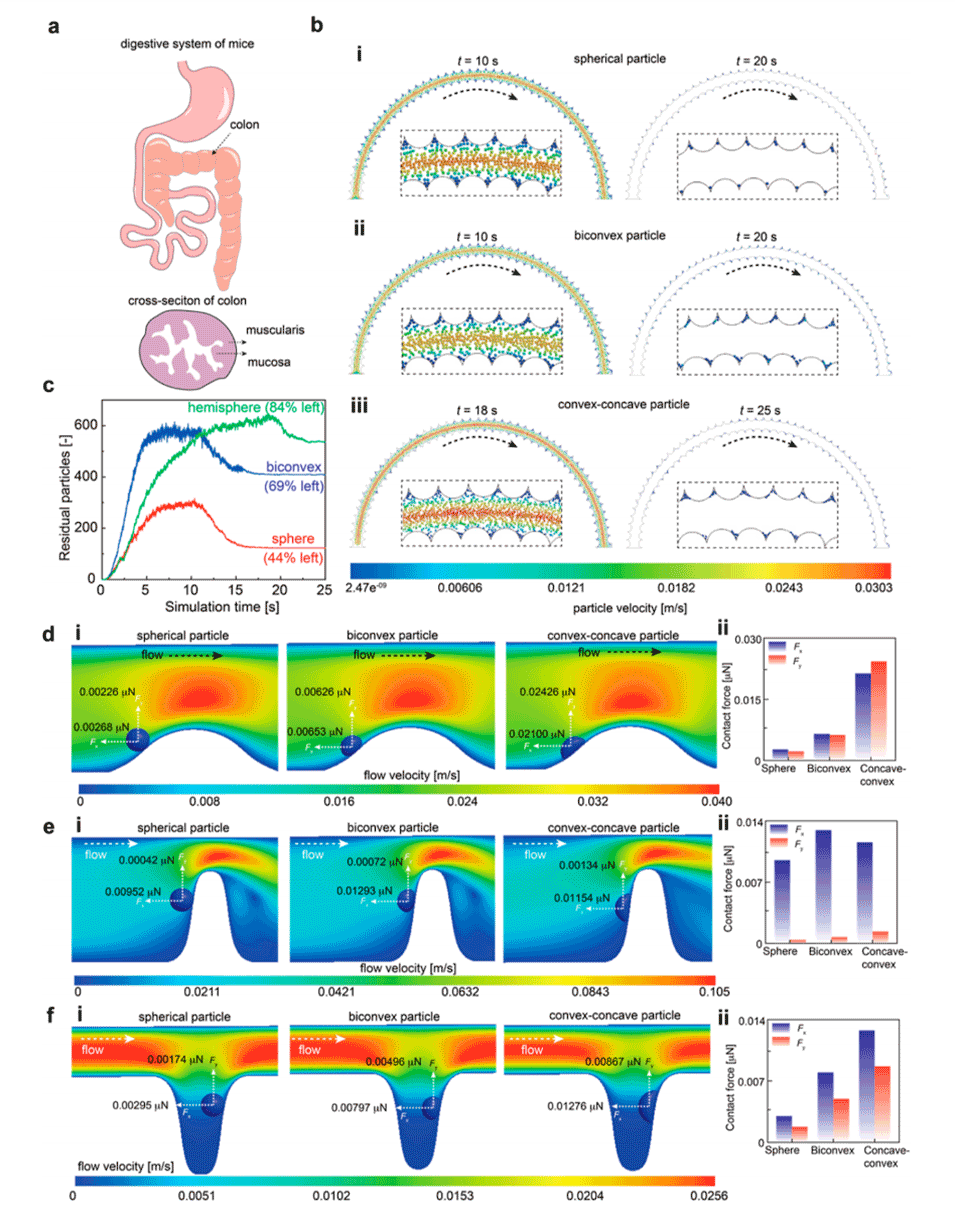
图5.微粒迁移的CFD-DEM模拟。
原文链接:https://doi.org/10.1021/acsami.4c06578














