背景介绍:
活细胞作为一个复杂的超分子系统,其内部的自组装结构在空间和时间上具有精确的有序性,支撑着生命的基本功能。受此启发,研究者们认为,若能在合成体系中实现分子自组装的精确区域控制,将为开发新型超分子结构提供强大的策略。这些结构在催化、传感和生物治疗等多个领域展现出潜在的应用价值。
为了在特定的空间区域形成超分子结构,需要在这些区域特异性地激活分子自组装过程。目前,已有研究通过利用外部刺激,如pH值变化、电场、催化剂和光照等,实现了对超分子自组装的空间控制。然而,针对水-水界面上小分子的局部自组装,相关报道仍然较少。水-水界面上的分子自组装对于需要纯水环境的应用,如生物分子的封装具有重要意义。
创建一个稳定的水-水界面是实现该界面上分子自组装的关键。水-水两相系统(ATPS)因其在聚合物/聚合物、聚合物/盐和聚合物/表面活性剂的水溶液之间自发相分离而闻名。通过ATPS生成的水-水界面在抗体、蛋白质、DNA和细胞的分离中显示出广泛的应用。尽管如此,在水-水界面上实现小分子的局部自组装仍然面临挑战,主要原因是缺乏能够在水-水界面上有效触发的分子自组装系统。近年来,研究人员系统地探究了一种基于腙键的超分子水凝胶系统,其中腙基水凝胶剂(HA3)通过水溶性腙(H)和醛(A)前体原位形成,并自组装成水凝胶。通过添加催化剂(如H+或苯胺),可以显著加速腙基水凝胶剂的形成和自组装。

导读:
近期,华东理工大学王义明研究员团队利用水-水两相系统(ATPS)和微流控技术,成功在水-水界面上触发了腙基水凝胶剂的自组装,连续制备出具有超分子水凝胶壳层的微胶囊。这些微胶囊能有效装载酶,模拟活细胞内生物丝的自组装过程,为开发新型仿生超分子载体提供了新途径,有望在生物医学和基础研究中发挥重要作用。相关研究以“Microfluidic‐Assisted Self‐Assembly of Molecular Hydrogelator at Water–Water Interfaces for Continuous Fabrication of Supramolecular Microcapsules”为题目,发表在期刊《Small》上。
本文要点:
1、本研究利用水-水界面上的分子自组装,通过微流控技术连续制备出具有超分子水凝胶壳层的微胶囊。
2、通过在两种不相溶的水溶液(PEG和Dex)中分别溶解非自组装的前体分子,并在催化剂作用下在水-水界面上快速形成并自组装成水凝胶,实现了对分子自组装的空间调控。
3、将酶(葡萄糖氧化酶)装载进这些微胶囊,利用酶催化反应在微胶囊内部诱导超分子纤维的生长,模拟了生物细胞内部的酶催化自组装过程。
4、这种在水-水界面上实现分子自组装的方法为开发生物模拟的超分子载体提供了新思路,可应用于生物医学和基础研究,如原生细胞的构建等。
使用微流控技术制造超分子微胶囊的优点包括:
1、连续生产能力:微流控技术能够实现超分子微胶囊的连续化生产,提高生产效率并降低成本。
2、空间选择性:该技术能够在特定的水-水界面上精确控制分子自组装,实现空间选择性的结构构建。
3、结构均一性:微流控技术能够保证微胶囊的尺寸和结构均一性,有利于后续的应用和研究。
4、生物分子封装:微胶囊可有效封装酶和其他生物分子,保护其免受外界环境影响,维持其活性。
5、生物相容性:微流控技术制备的微胶囊具有良好的生物相容性,适合用于生物体内的药物递送和治疗。
6、稳定性与功能性:在纯净的水环境中形成的微胶囊稳定性高,可通过功能化修饰以适应不同的生物医学应用。
制备的超分子微胶囊在生物医学领域的潜在应用有哪些?
1、药物递送系统:超分子微胶囊可以作为药物载体,实现药物的控制释放和靶向递送,提高治疗效果并减少副作用。
2、生物分子封装:微胶囊可有效封装酶和其他生物活性分子,保护其免受外界环境影响,用于生物传感器和诊断工具。
3、组织工程:在组织工程中,超分子微胶囊可以作为细胞培养的三维微环境,促进细胞生长和分化。
4、模拟细胞功能:微胶囊可以模拟细胞内某些生物化学过程,用于基础生物医学研究,如细胞信号传导和代谢途径的研究。
5、原细胞构建:微胶囊的结构和功能使其有望用于原细胞的构建,为合成生物学和生命起源研究提供模型系统。
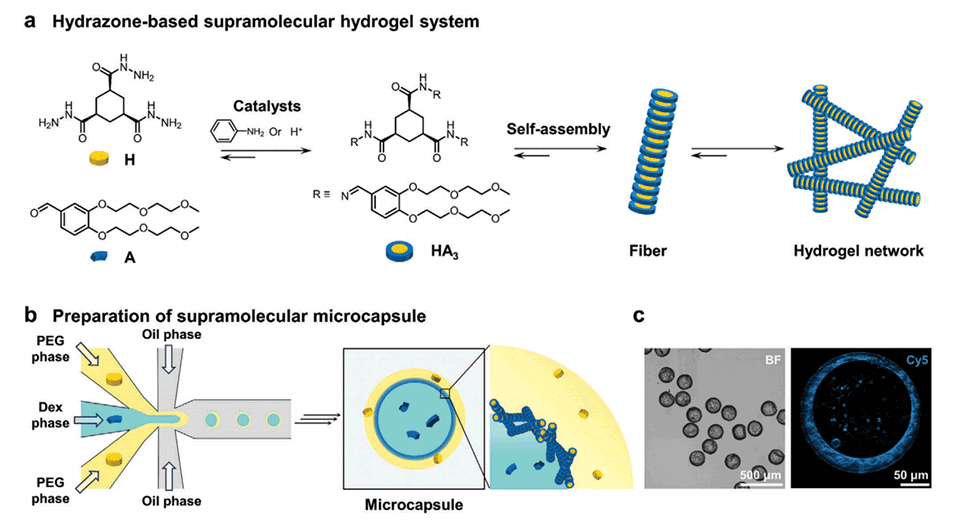
图1.通过在水-水界面触发腙类水凝胶的原位形成和自组装,连续制造超分子微胶囊的示意图。
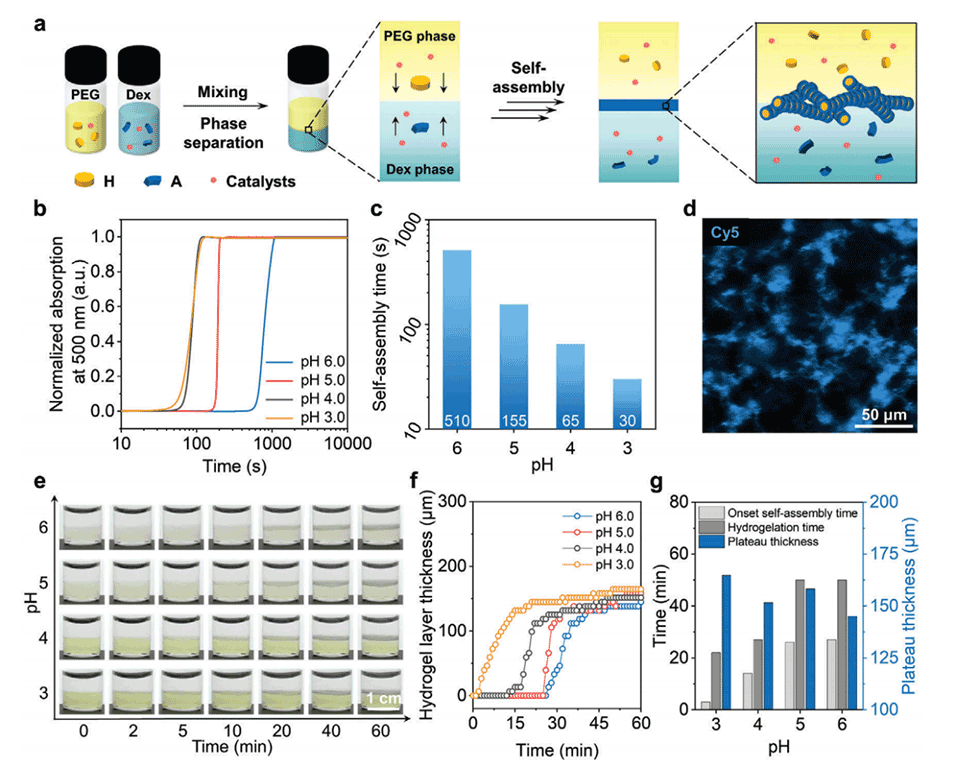
图2.水-水界面处超分子水凝胶的自组装。
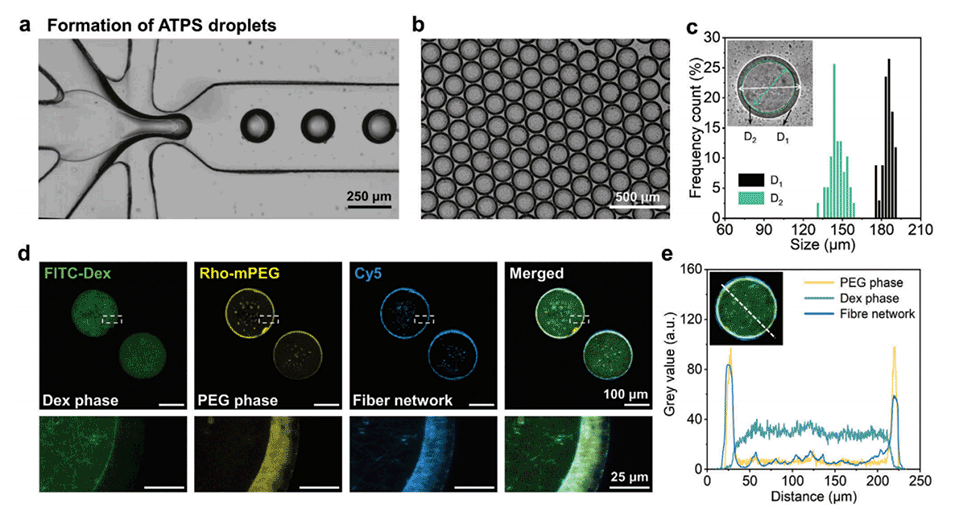
图3.利用微流控技术连续制造超分子微胶囊。
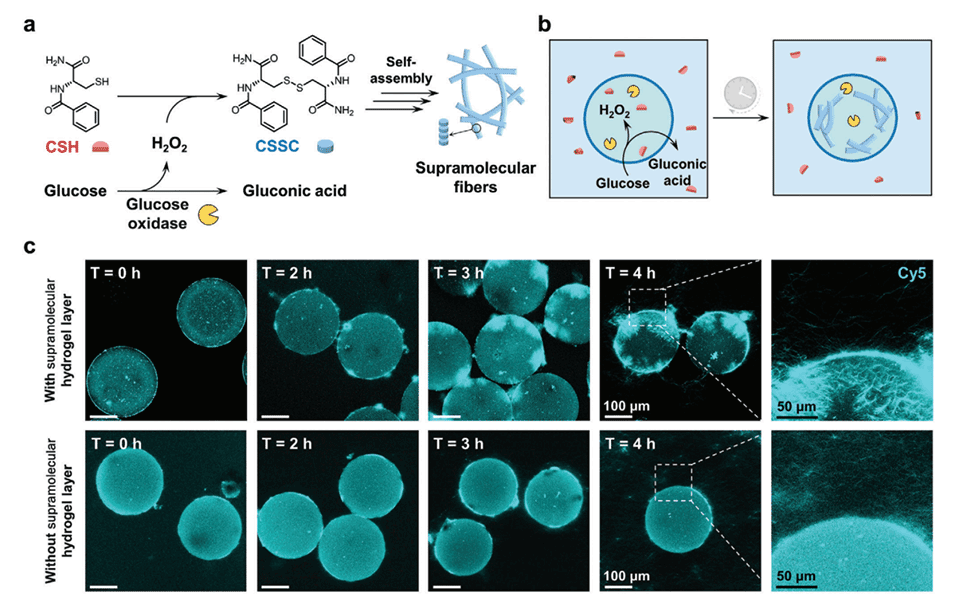
图4.超分子微胶囊内超分子纤维的酶促生长。
原文链接:https://doi.org/10.1002/smll.202403085














