
导读:
近期,有研究人员开发了一种集成式模块化微流控芯片平台,它通过直接电纺技术在PMMA基底上制备了具有可调节孔隙率的多孔膜,用于构建模拟肠道上皮屏障的体外模型,为药物渗透性研究和器官芯片技术提供了创新的解决方案。相关研究以“An Integrated and Modular Compartmentalized Microfluidic System with Tunable Electrospun Porous Membranes for Epithelialized Organs-on-a-Chip”为题目,发表在期刊《ACS Applied Materials & Interfaces》上。
本文要点:
1、本研究开发了一个集成式模块化的三维隔室微流控系统,通过在PMMA基底上直接电纺聚合物纳米纤维,实现了多孔膜与微流控芯片的一体化集成,省略了传统的额外装配步骤。
2、研究人员在具有复杂微流道结构和较大尺寸的多种芯片设计上成功沉积了纳米纤维,证明了该方法在高通量膜集成方面的有效性。
3、使用Caco-2细胞系在PMMA芯片上培养上皮单层,构建了模拟肠道上皮屏障的体外模型,并研究了药物渗透性。
4、对PMMA和PS基多孔膜的物理化学性质进行了全面分析,确定了最佳性能的聚合物,并对膜的孔隙率和纤维结构进行了优化,以适应不同的细胞培养和药物运输应用。
5、该平台能够动态模拟上皮屏障,为药物传输和微生理系统建模提供了新的研究工具,有望在药物发现和开发中发挥重要作用。
在微流控设备中使用电纺膜的主要优势包括:
1、一体化集成:电纺膜可以直接集成到微流控芯片中,避免了传统膜集成所需的额外组装步骤,简化了制造过程。
2、高通量生产能力:电纺丝技术能够在多种复杂设计的微流控芯片上快速沉积纳米纤维,提高了膜集成的效率和产量。
3、孔隙率可调:通过调节电纺丝过程中的参数,如纤维直径和膜的总厚度,可以定制膜的孔隙率,以满足不同的细胞培养和药物运输需求。
4、改善细胞相容性:电纺膜的表面特性和孔隙结构有助于提高细胞的附着、增殖和分化,增强细胞相容性。
5、增强物理和化学稳定性:电纺膜展现出良好的机械强度和化学稳定性,能够在长期的细胞培养和动态微流控环境中保持性能稳定。
6、促进细胞间交流:多孔膜的设计支持营养物、气体和信号分子的交换,同时通过物理隔离维持了细胞群体的独立性,有效模拟了体内细胞间的相互作用。
本工作中使用的Caco-2细胞系在药物渗透性研究中的作用是什么,以及如何评估这种细胞屏障模型的功能?
Caco-2细胞系是一种人结肠腺癌细胞系,它在研究中被用来模拟小肠上皮细胞,以探究药物的渗透性。通过在电纺纳米纤维膜上培养Caco-2细胞,可以模拟药物在体内的吸收过程。
这种细胞屏障模型的功能通过跨上皮电阻(TEER)测量和免疫荧光染色来评估。TEER值的增加表明细胞间紧密连接的形成,而免疫荧光染色则用于观察细胞间紧密连接蛋白的表达。此外,通过测量FITC-地克司蓝(一种荧光示踪剂)的渗透性,可以进一步评估细胞屏障的完整性和功能。
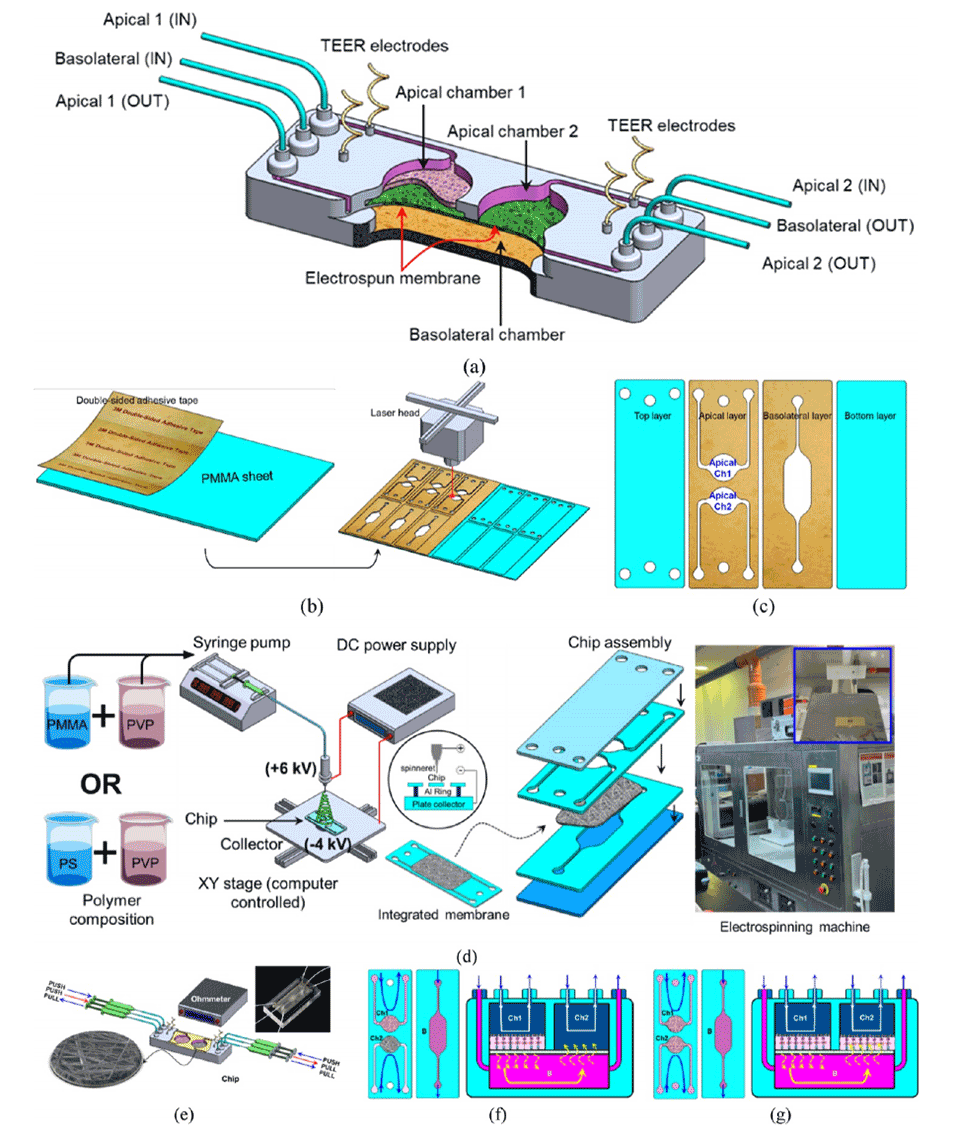
图1.集成式设备示意图。


图2.聚合物的化学组成和流变学性质以及静电纺丝条件对纤维和膜形态的影响。
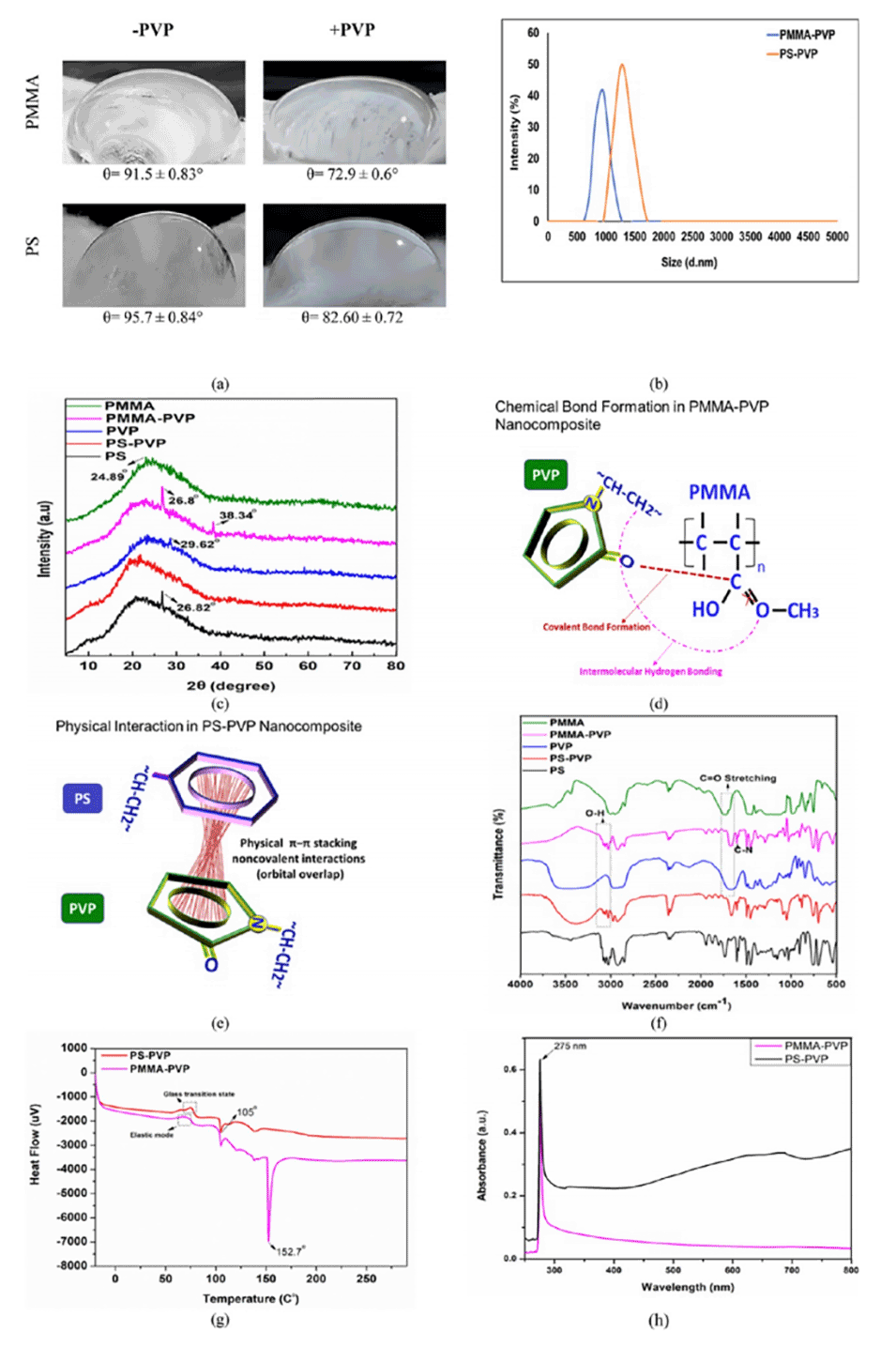
图3.描述了添加PVP对PMMA或PS电纺膜润湿性的影响,并通过XRD和FTIR分析了膜的晶体结构和化学组成。
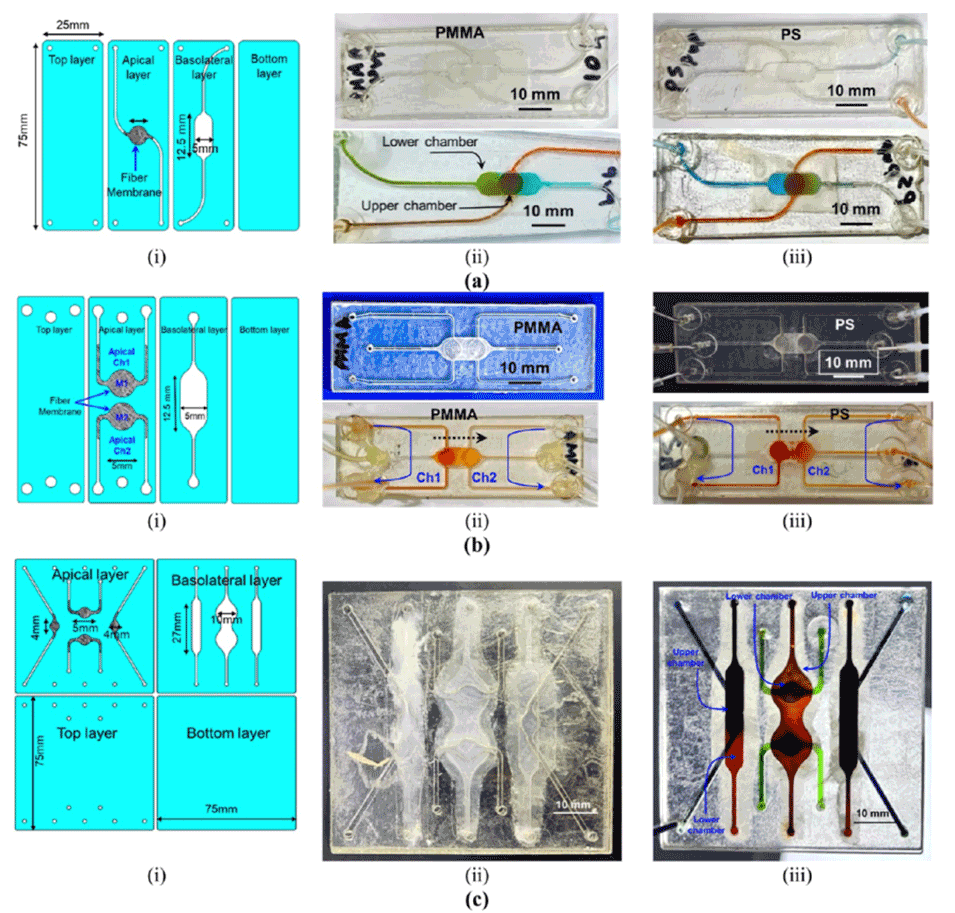
图4.展示了不同设计的微流控芯片及其电纺膜的集成情况,包括单层和多层结构。
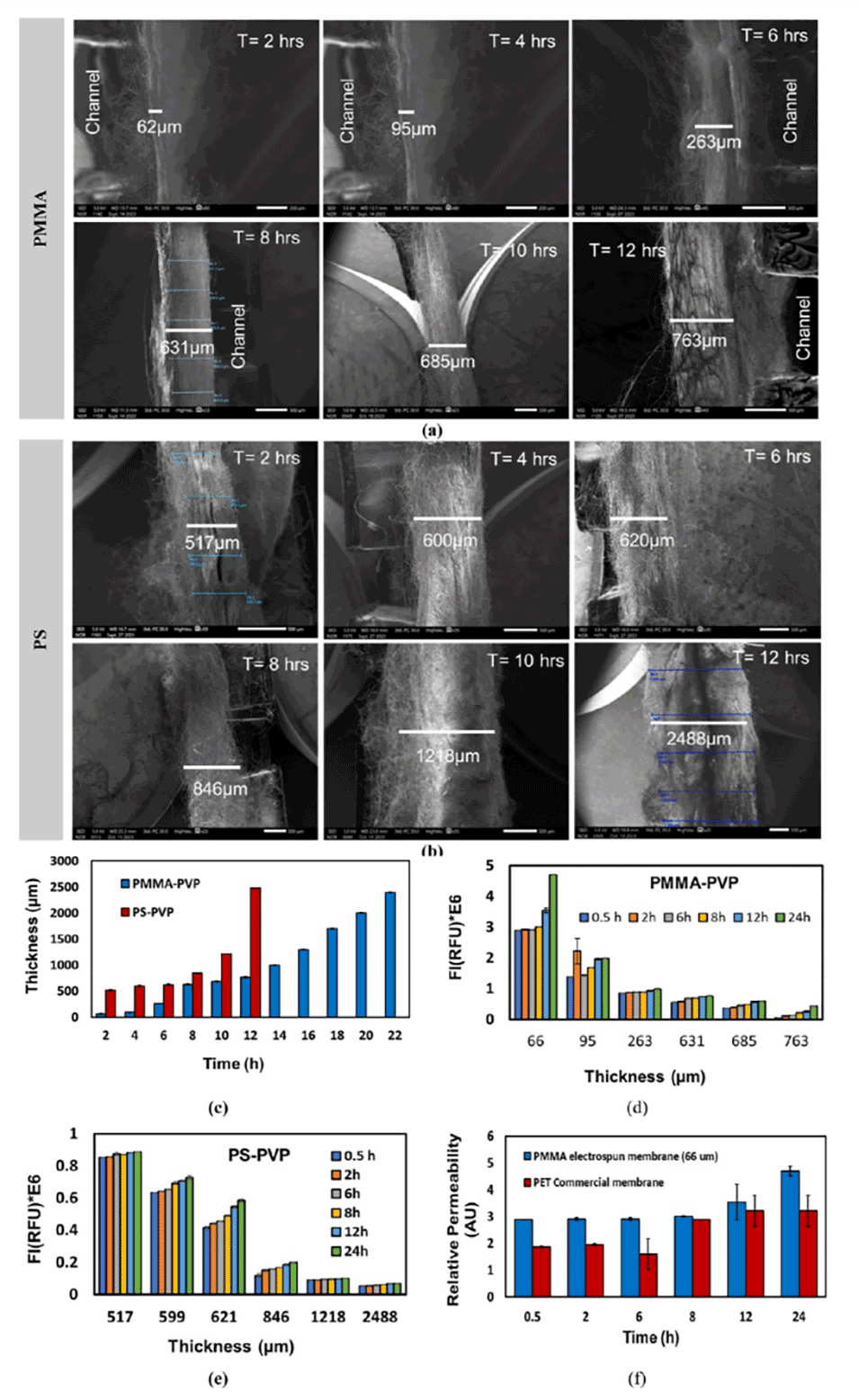
图5.通过SEM图像展示了不同电纺丝时间对PMMA-PVP和PS-PVP膜厚度的影响,以及FITC-地克司蓝的通透性测试结果。
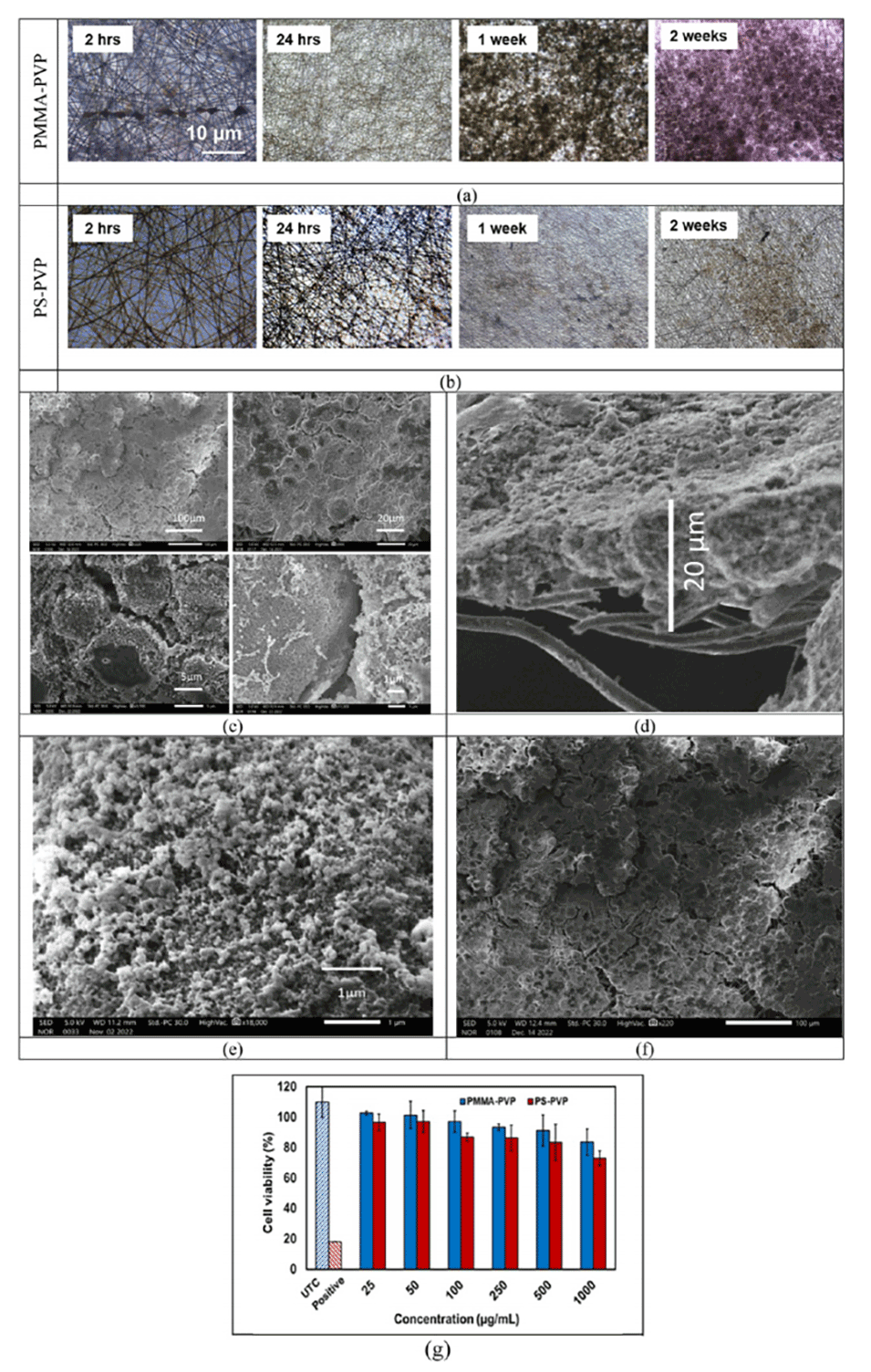
图6.通过SEM图像展示了Caco-2细胞在PMMA基膜上的附着和增殖,以及形成的紧密连接结构。
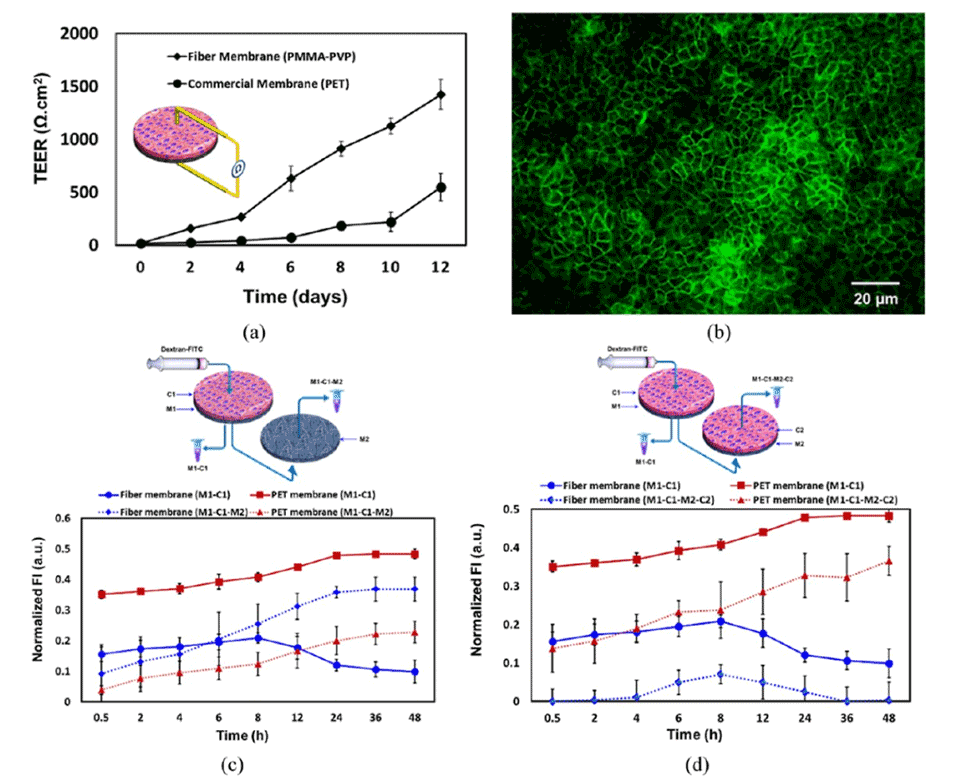
图7.展示了Caco-2细胞单层的TEER测量结果,以及FITC-地克司蓝在单层和双层细胞中的通透性研究。
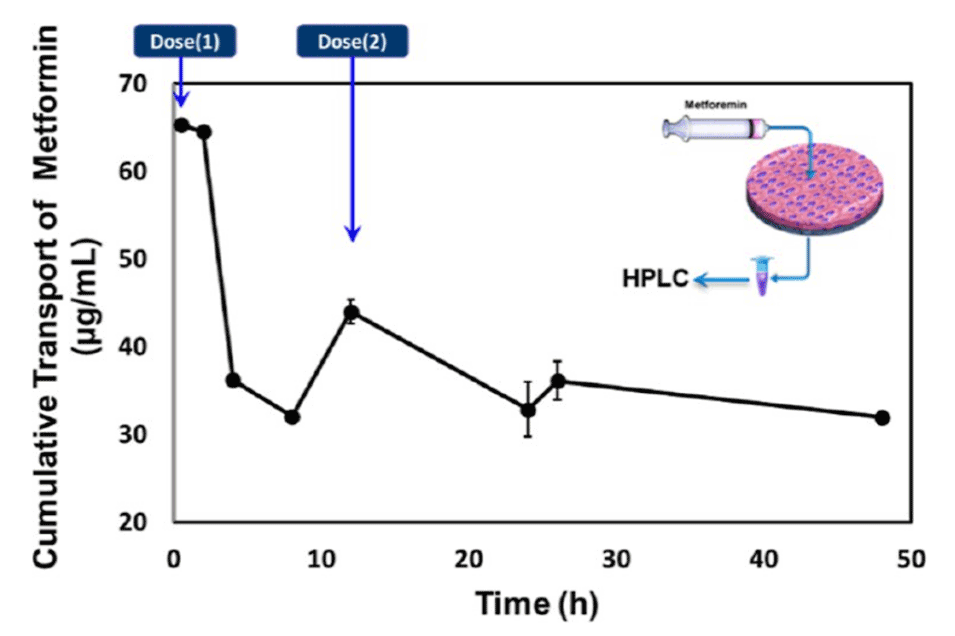
图8.药物二甲双胍在Caco-2细胞单层中的动态运输时间过程研究,并用高效液相色谱(HPLC)技术进行了分析。
原文链接:https://doi.org/10.1021/acsami.4c08864














