食品中的许多活性成分在通过胃部时会被胃酸和酶破坏,从而降低目标成分的预期效果。此外,传统的微胶囊制备方法通常通过机械搅拌或振荡来打破分散体,产生大小不均匀、包合物含量不一致的液滴,机械外力还可能导致活性物质变性和失活。

近期,华南农业大学食品学院蒋卓团队采用微流控技术制备了具有高包封率、可控结构和靶向释放特性的均质和核壳海藻酸钠微囊,为活性成分的有效保护和肠道靶向递送提供了新的技术方案。相关研究以“Preparation and evaluation of microcapsules of sodium alginate based on microfluidic technology”为题目,发表在期刊《Food Hydrocolloids》上。
本文要点:
1、本研究采用微流控技术制备了具有良好单分散性和高度可调性质的油包水包油(O/W/O)液滴结构,并利用海藻酸盐在酸性条件下与Ca2+反应的交联特性,进一步制备了具有高包封率和靶向肠道释放特性的微胶囊。
2、选择茶多酚和维生素E作为亲水性和亲脂性生物活性化合物的模型,分别制备了均质和核壳型微胶囊,并对其粒径分布、释放效果、包封率和氧化稳定性进行了评估。
3、使用PDMS芯片制备了壳层厚度约25μm的薄壳微胶囊,以及使用毛细玻璃管芯片制备了粒径为230μm的大微胶囊,后者在4℃下储存20天后,维生素E的保留率达到88.66%,而在裸露环境下所有维生素E全部被氧化。
4、此外,在模拟胃液中,维生素E的释放量仅为20%左右,而在人工肠液中释放接近100%,显示了微胶囊的肠道靶向特性。
在微胶囊的制备中,海藻酸钠作为壳层材料的选择依据是什么?
1、天然来源:海藻酸钠是一种天然多糖,具有良好的生物相容性和安全性,适合用于食品和药物的微胶囊化。
2、优良的凝胶化特性:海藻酸钠能够与Ca²+结合形成稳定的凝胶结构,提供有效的物理保护,防止内嵌成分的氧化和降解。
3、膜形成能力:海藻酸钠能够形成连续的薄膜,隔离内嵌物质与外部环境,增强其稳定性。
4、pH敏感性:海藻酸钠在酸性环境下收缩,在碱性环境下溶胀和解离,这一特性有助于实现在特定环境下的靶向释放。
5、抗氧化性:海藻酸钠壳层能够减缓内嵌成分的氧化过程,延长其储存稳定性,保持活性成分的效能。
使用微流控技术制备微胶囊的主要优势包括:
1、尺寸和形状精确控制:能够精确调控微胶囊的粒径和壳层厚度,实现高度一致的单分散性。
2、高包埋效率:微流控技术可以提高活性成分的包埋效率,确保更多的活性成分被有效封装。
3、靶向释放:可以制备出在特定pH值或环境下响应释放的微胶囊,实现对活性成分释放的精确控制。
4、保护活性成分:微胶囊的壳层为活性成分提供了物理屏障,保护其免受外界不利因素如氧气、光线、极端pH值等的影响。
5、提高生物利用度:通过控制释放,微胶囊有助于提高活性成分在体内的生物利用度。
6、适应性强:微流控技术适用于多种材料和活性成分,增加了制备微胶囊的灵活性和应用范围。
7、高通量生产潜力:微流控芯片可以并行处理多个样本,提高生产效率,有助于实现规模化生产。
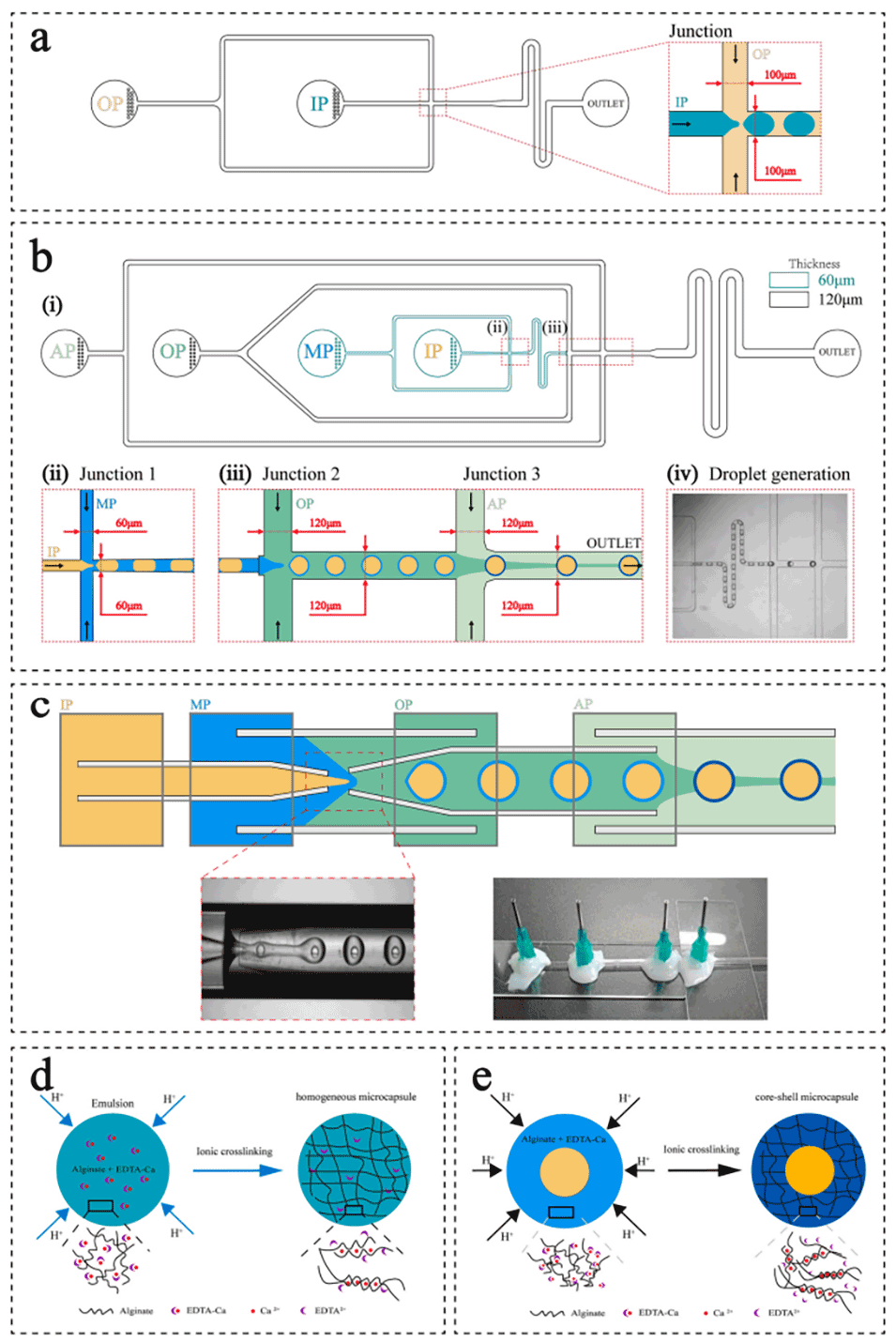
图1.(a)PDMS单乳液芯片结构图和单乳液生成示意图;(b)O/W/O型双乳液芯片结构图及双乳液生成示意图;(c)玻璃管双乳液芯片结构和固体芯片示意图;(d)海藻酸钙均质微胶囊固化机理;(e)海藻酸钙核壳微胶囊固化机理示意图。
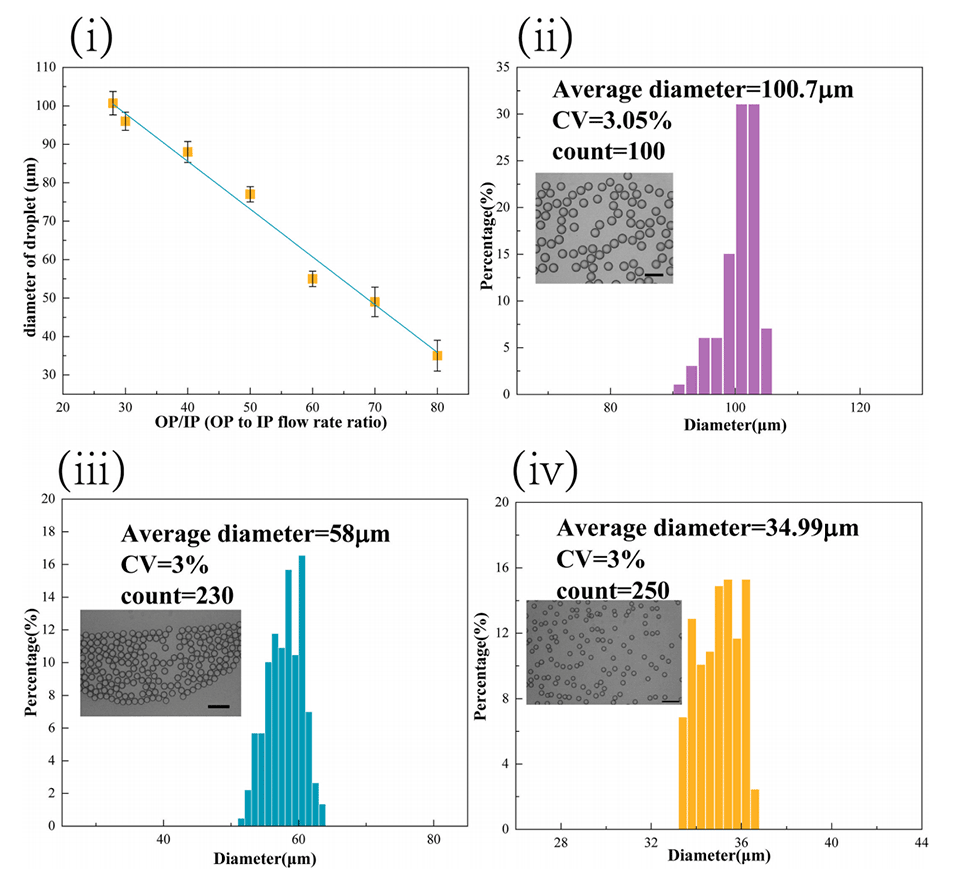
图2.(i)粒径与流速的关系(固定IP流速为50μL/h);(ii)1400μL/h连续相流速下的液滴尺寸分布;(iii)3000μL/h连续相流速下的液滴尺寸分布;(iv)连续相流速为4000μL/h时的液滴尺寸分布(比例尺为200μm)。
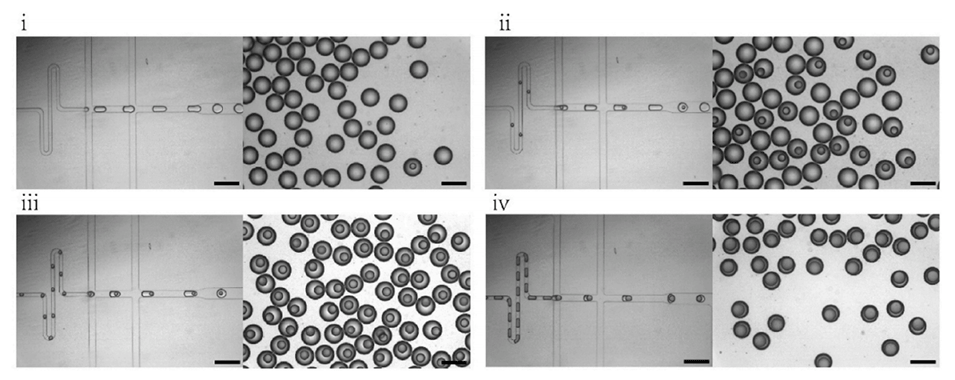
图3.仅改变内相产生的乳液类型(比例尺为200μm):(i)W/O单乳液(IP流速为30μL/h),(ii)交替单乳液和双乳液(IP流速为40μL/h)。
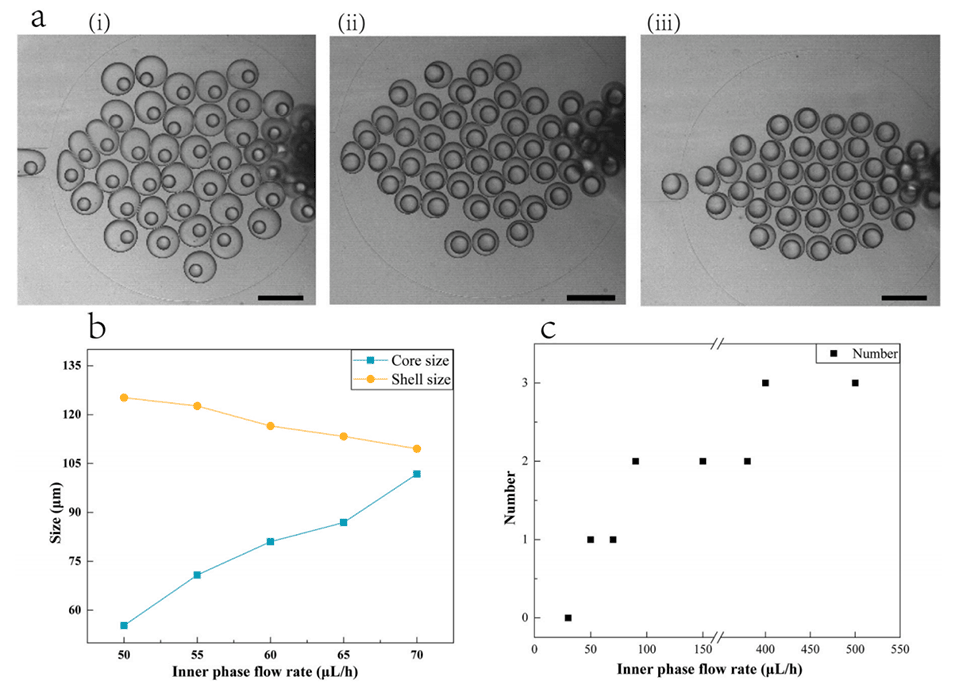
图4.(a)改变内相产生的双乳液液滴核尺寸的变化(比例尺为200μm);(b)仅改变内相的粒径变化图;(c)仅改变内相的核数变化图。
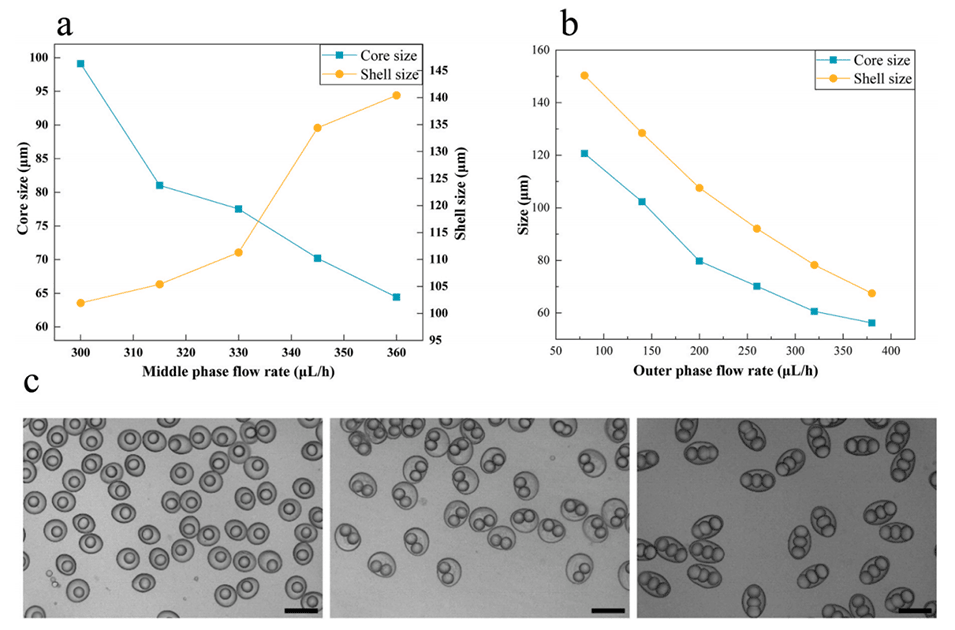
图5.(a)仅改变中间相的粒度变化图;(b)仅改变外相的粒径变化图;(c)制备单核、双核和三核的CSM-PC(澄清:对于单核CSM-PC的制备,相流速为IP(50μL/h)、MP(350μL/h)、OP(500μL/h)和AP(400μL/h)。对于双核CSM-PC的制备,每相的流速分别为IP(70μL/h)、MP(300μL/h)、OP(500μL/h)和AP(400μL/h)。对于三核CSM-PC的制备,相流速为IP(110μL/h)、MP(320μL/h),OP(500μL/h)和AP(450μL/h))。比例尺为200μm。
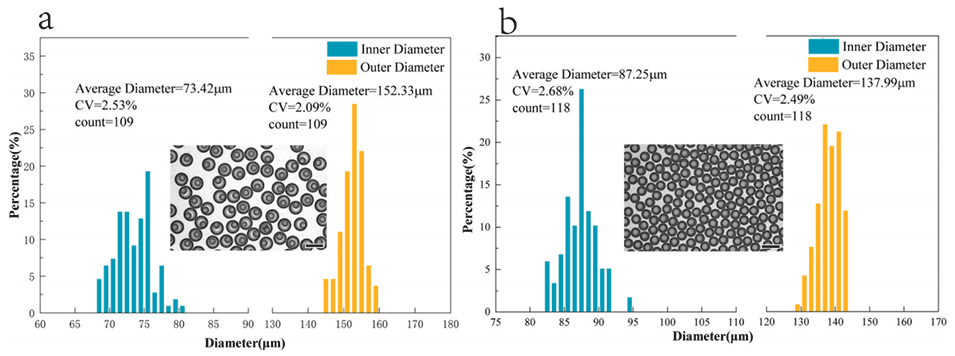
图6.(a)厚壳CSM-PC(IP(70μL/h)、MP(370μL/h),OP(500μL/h)和AP(400μL/h));(b)薄壳CSM-PC(IP(65μL/h)、MP(345μL/h)、OP(500μL/h)和AP(400μL/h))。比例尺为200μm。
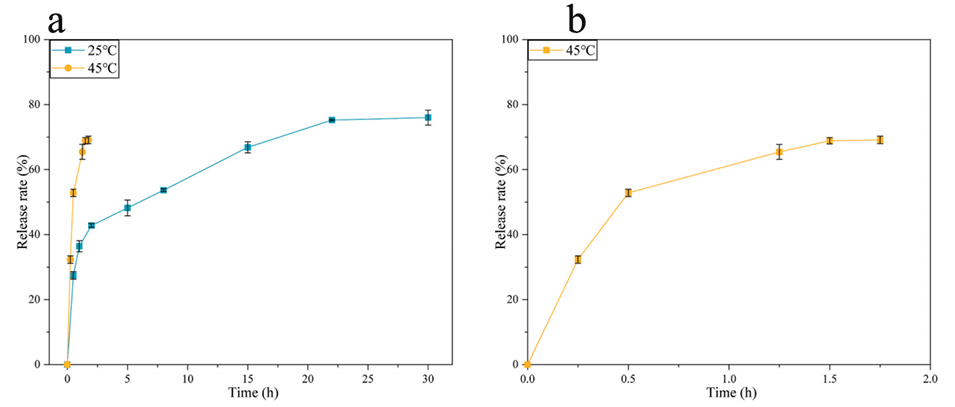
图7.(a)25℃和45℃下茶多酚释放的比较;(b)45℃时茶多酚的释放。
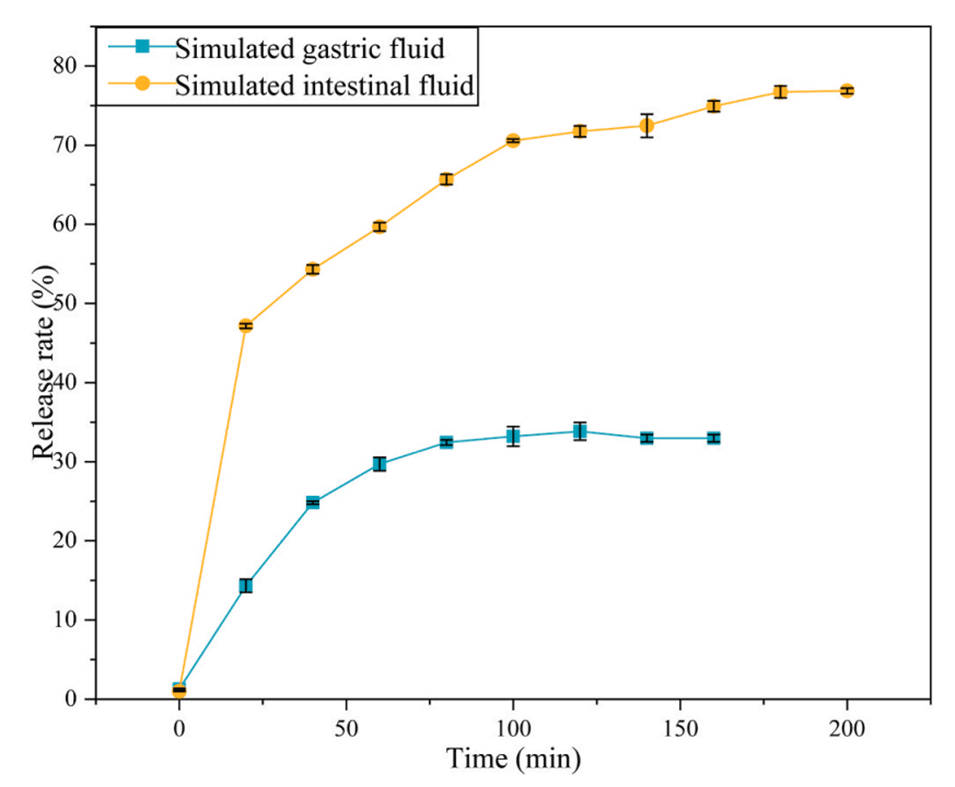
图8.在37℃的模拟胃肠液条件下茶多酚的释放。

图9.CSM-CGTC在不同pH值下的变化:(i)添加磷酸盐溶液前的微胶囊;(ii)加入pH=3的磷酸盐缓冲溶液后微胶囊的状态;(iii)加入pH=6的磷酸盐缓冲溶液后胶囊的状态;(iv)加入pH=8的磷酸盐缓冲溶液后微胶囊的状态。(a、b、c和d的比例尺为100μm,e、f和g的比例尺为200μm)。
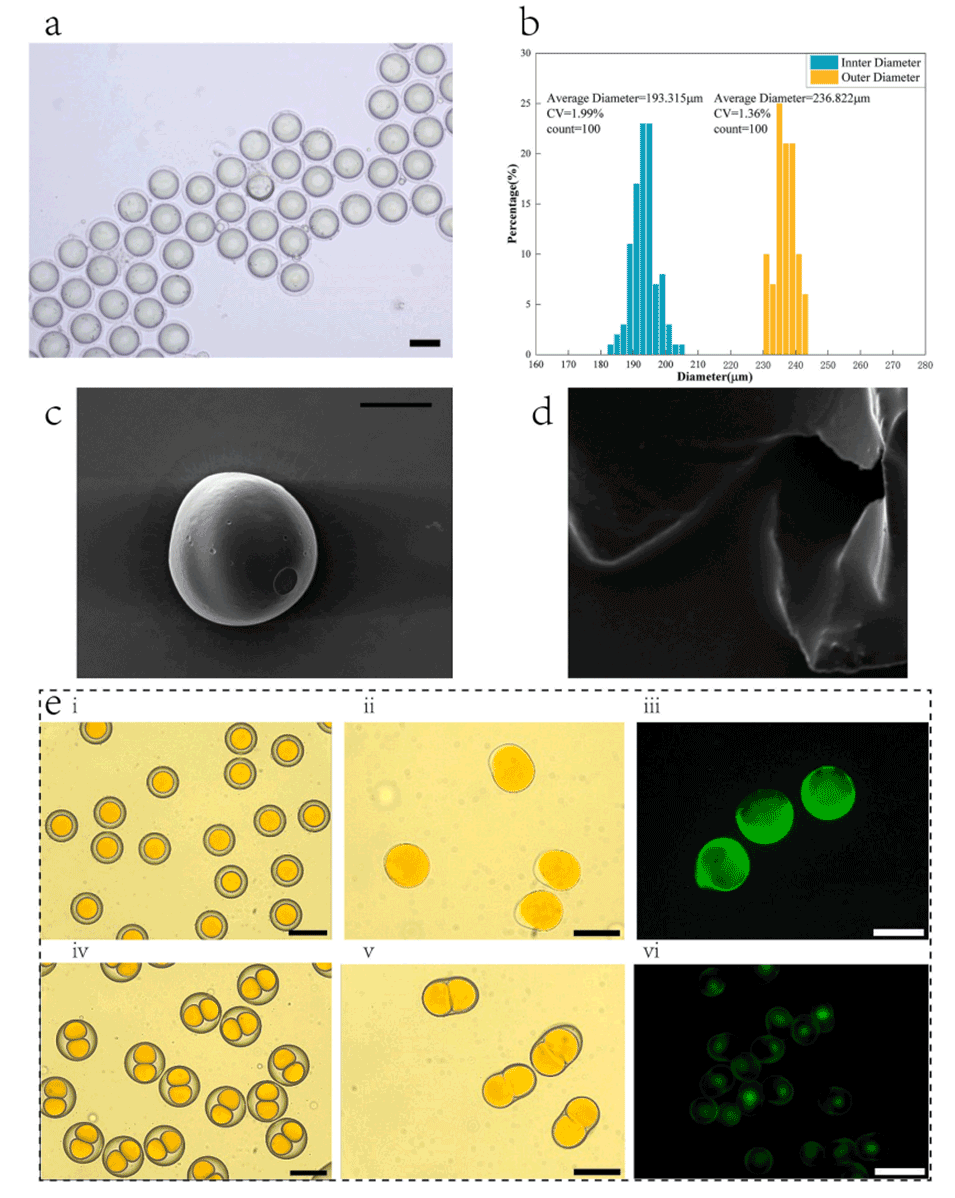
图10.CSM-CGTC在光学显微镜下的结构特征:(a)在去离子水中的分散;(b)核壳微胶囊的粒径分布;(c)单个微胶囊的扫描电镜表征;(d)用镊子打开微胶囊后的局部电子显微镜视图;(e)凝胶微胶囊的干燥收缩变化。(c、d的比例尺为100μm,a、e的比例尺为200μm)。
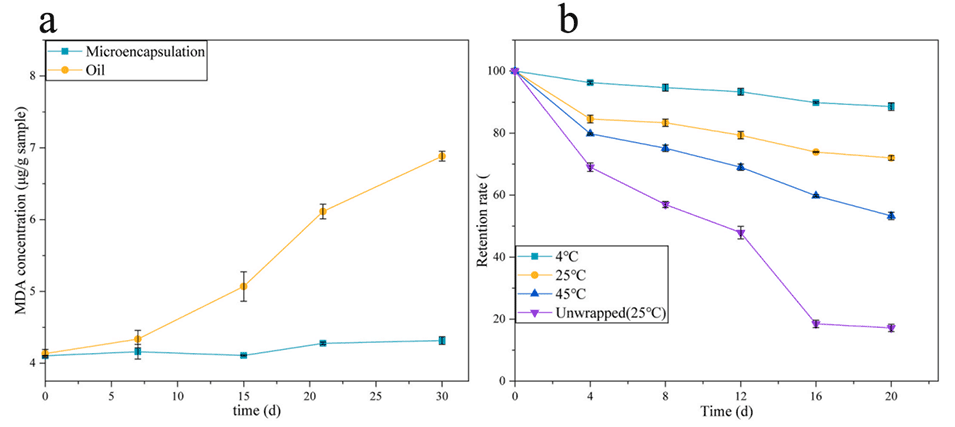
图11.(a)45℃下原油和微胶囊中油脂氧化产物MDA含量的比较;(b)不同温度下储存的维生素中维生素E的保留率。
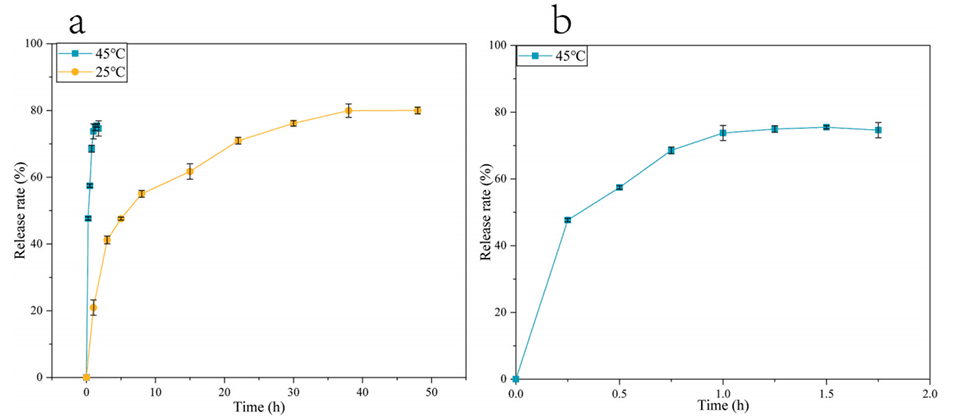
图12.(a)维生素E在两种不同温度条件下的释放情况;(b)维生素E在45℃下的释放情况。
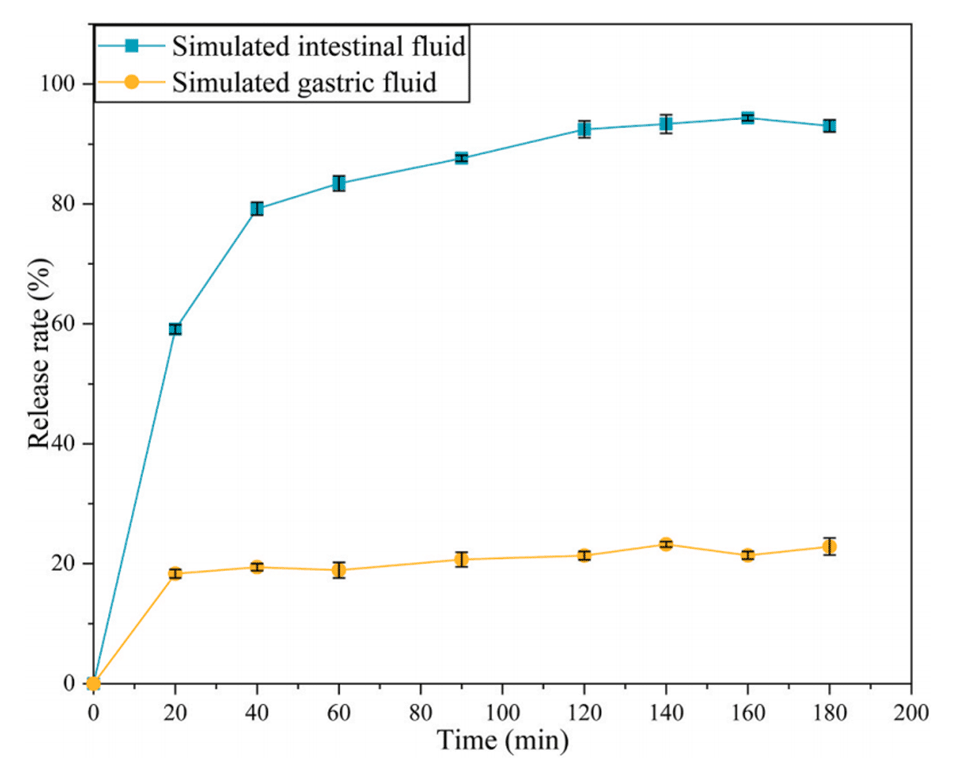
图13.维生素E在37℃模拟胃肠液条件下的释放情况。
原文链接:https://doi.org/10.1016/j.foodhyd.2024.110113














