富血小板血浆(PRP)宫内输注已被证明可有效治疗薄型子宫内膜(TE)并实现妊娠。然而,生长因子的快速释放限制了其在临床应用中的有效性,往往需要多次宫内输注才能达到治疗效果。

近期,青岛妇女儿童医院生殖医学中心郝翠芳团队联合青岛大学附属青岛市口腔医院研究团队,开发了一种可注射的GelMA水凝胶微球生物材料,通过微流控技术实现PRP的持续释放,用于治疗TE,并通过体外和体内实验验证了其生物相容性,发现PRP负载微球显著增强了细胞增殖、迁移和血管生成,对修复子宫内膜和恢复生育能力具有积极作用。相关研究以“Injectable GelMA Hydrogel Microspheres with Sustained Release of Platelet‐Rich Plasma for the Treatment of Thin Endometrium”为题目,发表在期刊《Small》上。
本文要点:
1、本研究利用液滴微流控技术开发了一种可注射的GelMA水凝胶微球生物材料,用于缓释PRP,解决了PRP快速释放的问题。
2、体外实验证实该复合材料具有良好的生物相容性,能够促进细胞增殖、迁移和血管生成。
3、体内实验表明,PRP负载微球能更有效地修复薄型子宫内膜,恢复小鼠的生育能力,其效果相当于三次PRP宫腔灌注。
4、机制研究发现,PRP通过上调E2F转录因子家族的激活因子,下调抑制因子,从而促进子宫内膜细胞的增殖。
5、该复合材料为临床治疗薄型子宫内膜提供了新的思路,避免了重复的PRP宫腔注射,减少了患者就诊次数。
使用GelMA水凝胶微球进行PRP递送的主要优势如下:
1、PRP的持续释放:GelMA水凝胶微球可以改变PRP的递送方式,延长其作用时间,克服了直接给药PRP的快速释放问题。
2、提高疗效:GelMA微球持续释放PRP能够达到三次PRP宫腔灌注的同等治疗效果,避免了多次注射的需要。
3、缩短治疗时间和降低成本:GelMA微球系统避免了重复宫内注射PRP的要求,减少了患者就诊次数和相关费用。
4、生物相容性:GelMA水凝胶微球在体外和体内实验中都表现出优良的生物相容性,可安全用于子宫内膜修复。
5、可调控性:GelMA水凝胶可以设计成具有可调节的机械性能和降解特性,以优化PRP的输送。
总之,GelMA水凝胶微球平台为以可控方式递送PRP提供了一种有效的方法,相比于直接使用PRP,能够增强其治疗薄子宫内膜的潜力。
在PRP@GelMA-M复合材料的制备过程中,如何通过液滴微流控技术实现对微球药物释放动力学的精确控制?
1、调整微球的尺寸:液滴微流控技术可以精确控制生成的液滴尺寸,从而影响微球的药物释放动力学。较小的微球通常具有更大的表面积与体积比,这可能导致更快的药物释放。
2、控制微球的孔隙结构:通过调节微流控过程中的参数,如聚合物浓度、交联剂用量和交联时间,可以控制微球的孔隙率和孔径大小,进而影响药物的扩散速率和释放动力学。
3、调节聚合物的化学组成:通过改变GelMA的甲基丙烯酰化程度,可以调节微球的降解速率和机械性能,从而影响药物的释放动力学。
4、优化微球的表面特性:通过在微球表面引入特定的化学基团或生物分子,可以调节药物与微球基质之间的相互作用,进而调节药物的释放行为。
5、使用刺激响应性材料:在微流控过程中引入pH敏感、温度敏感或酶敏感的聚合物,可以制备出对特定刺激响应的药物释放系统,实现对药物释放动力学的精确控制。
6、控制药物的负载方式:通过物理吸附、化学键合或将药物嵌入聚合物基质中,可以调节药物在微球中的分布和释放行为。
7、后处理工艺:在微球制备完成后,可以通过后处理技术如二次交联、表面涂层或热处理等方法进一步调整微球的药物释放动力学。
通过上述方法,液滴微流控技术为PRP@GelMA-M复合材料的药物释放动力学提供了精确的控制手段,有助于实现个性化和优化的药物递送策略。
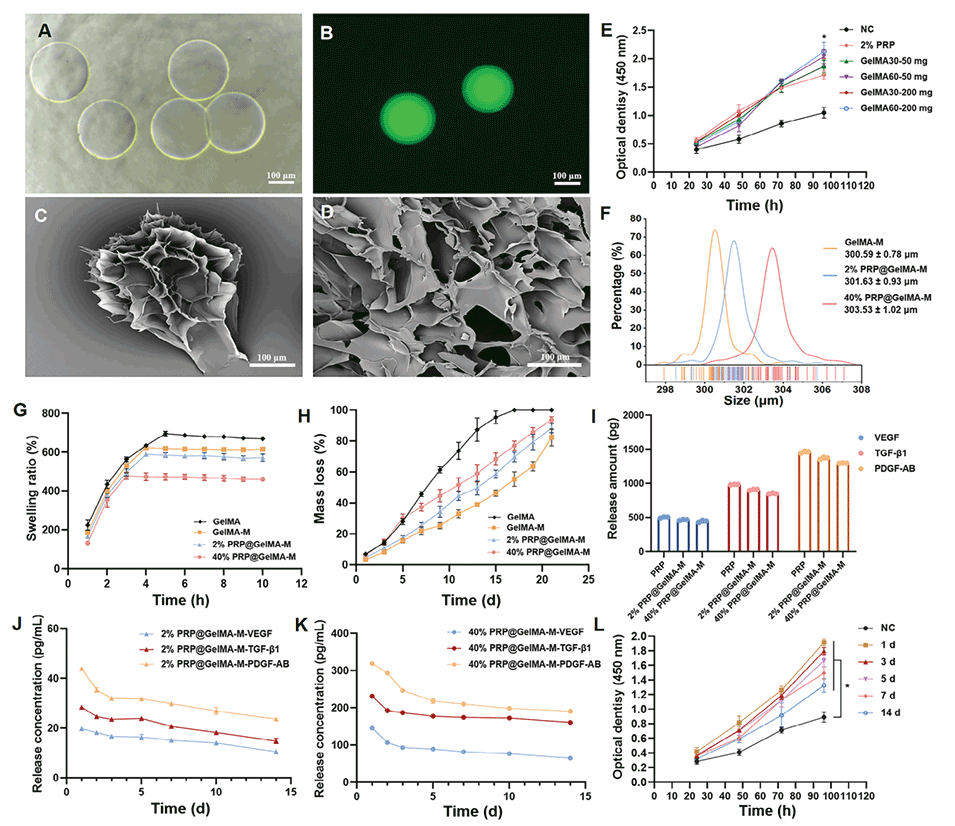
图1.PRP@GelMA-M的外观和性能表征。
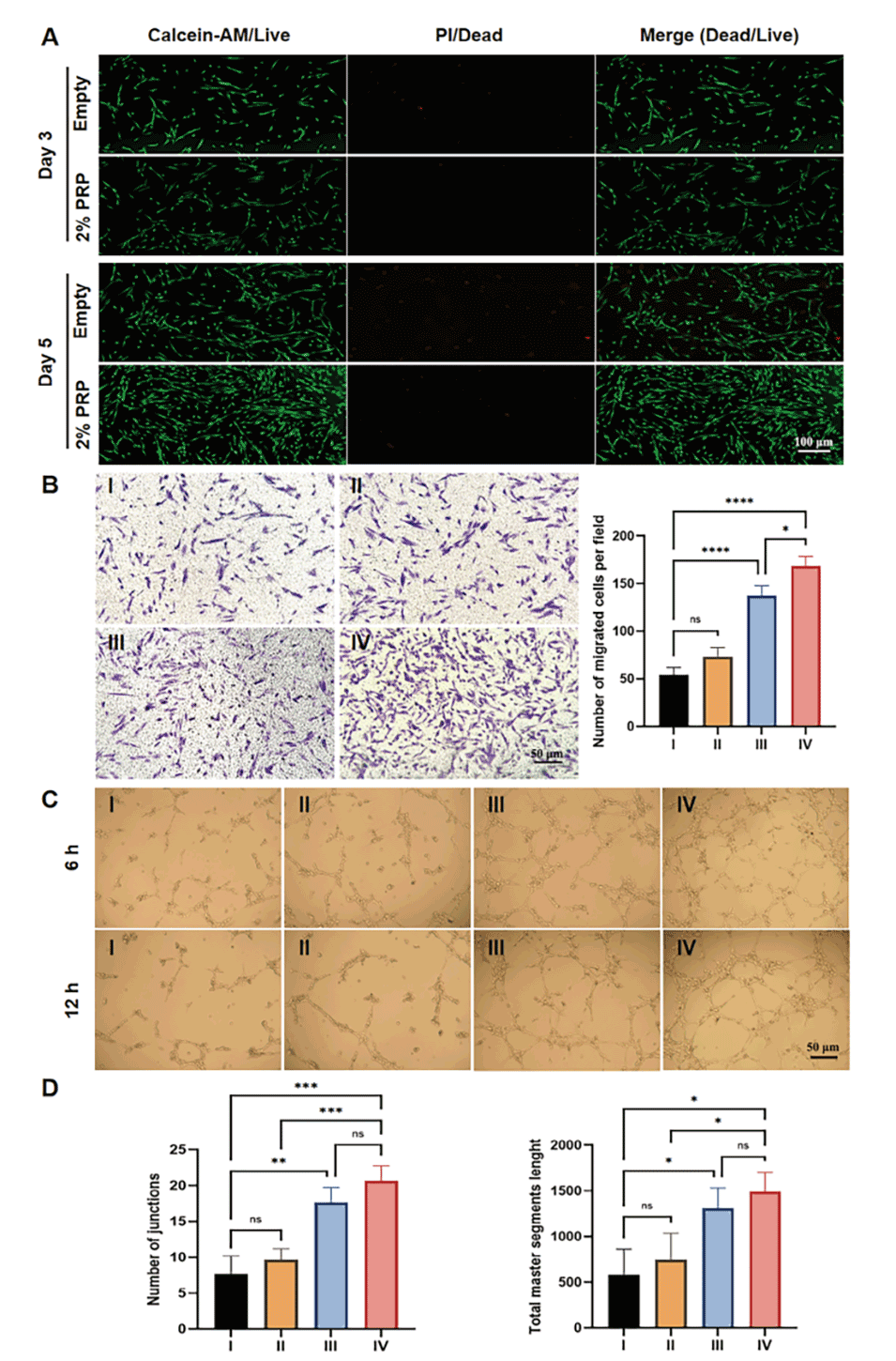
图2.2%PRP@GelMA-M对细胞行为的影响。
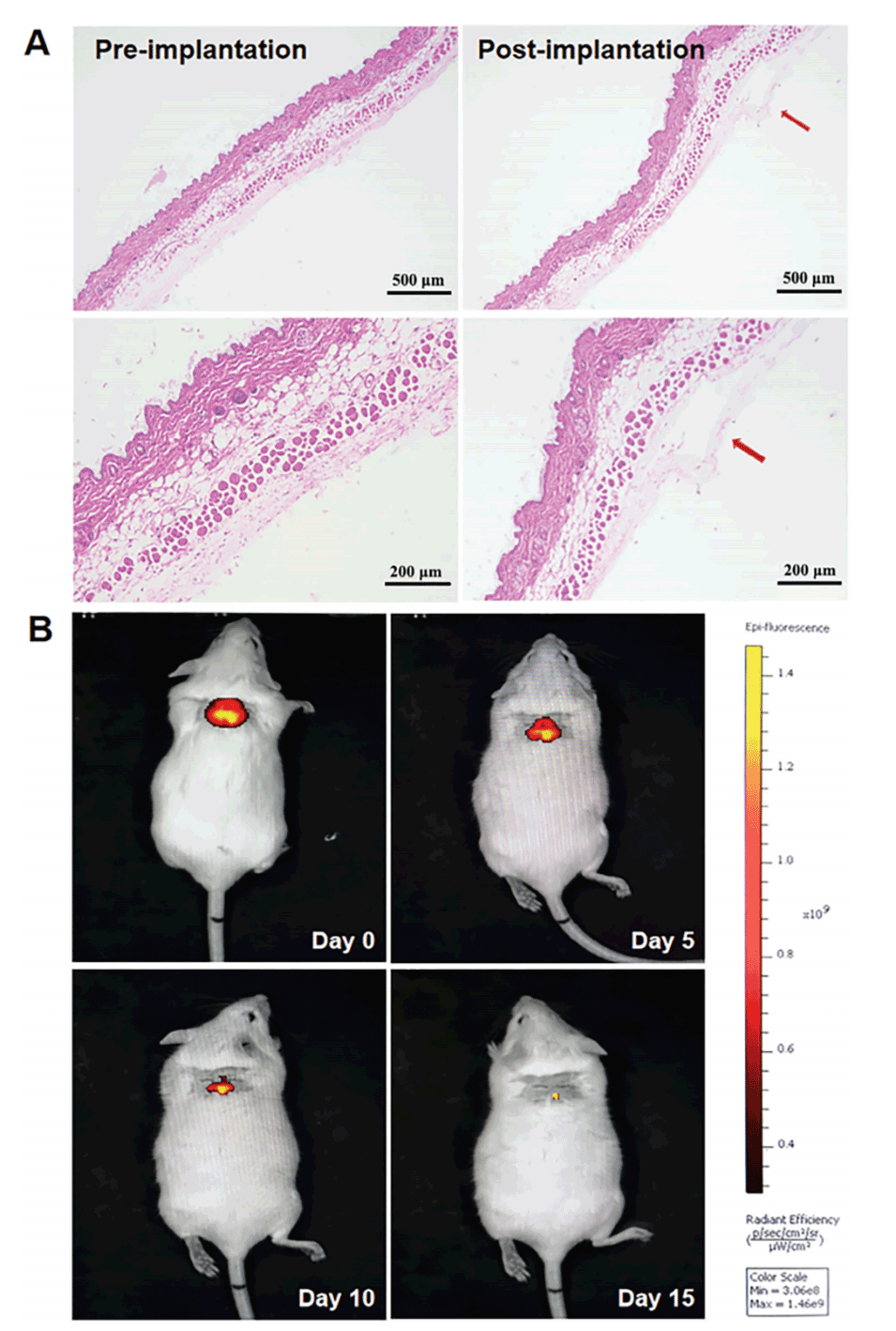
图3.40%PRP@GelMA-M的组织相容性和降解性。
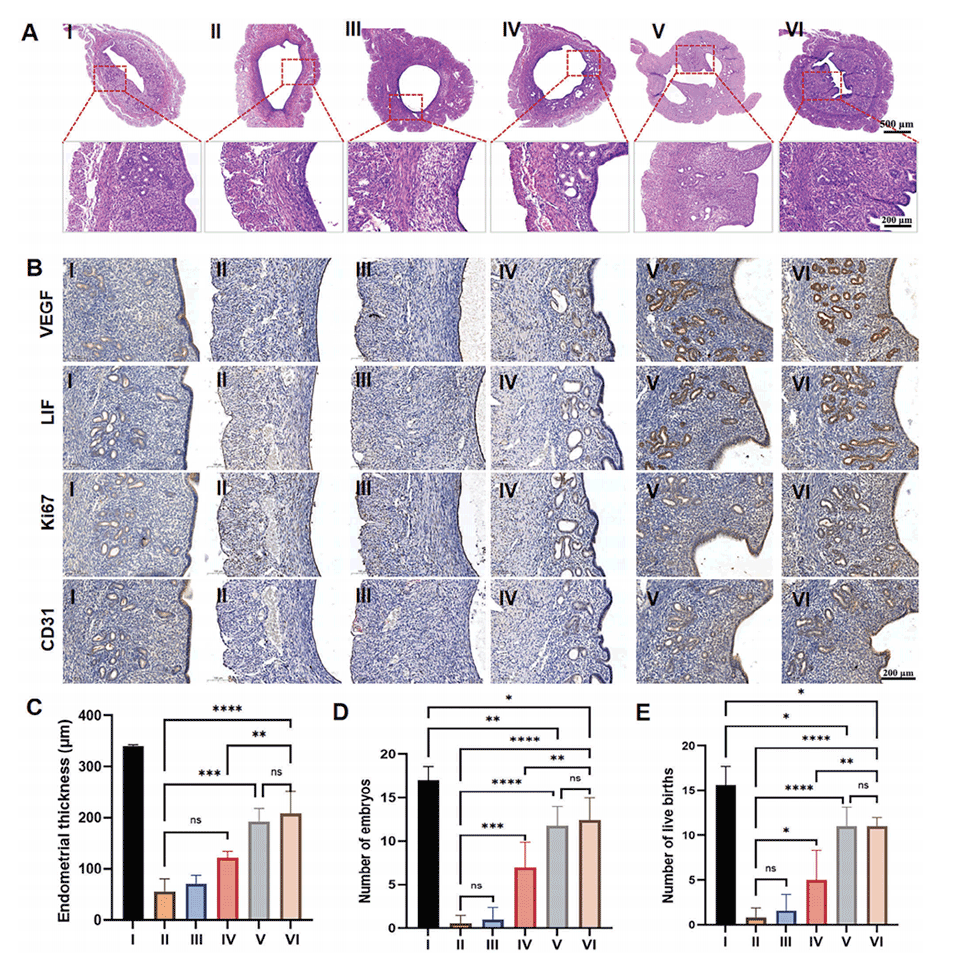
图4.40%PRP@GelMA-M对TE模型小鼠子宫内膜的修复。
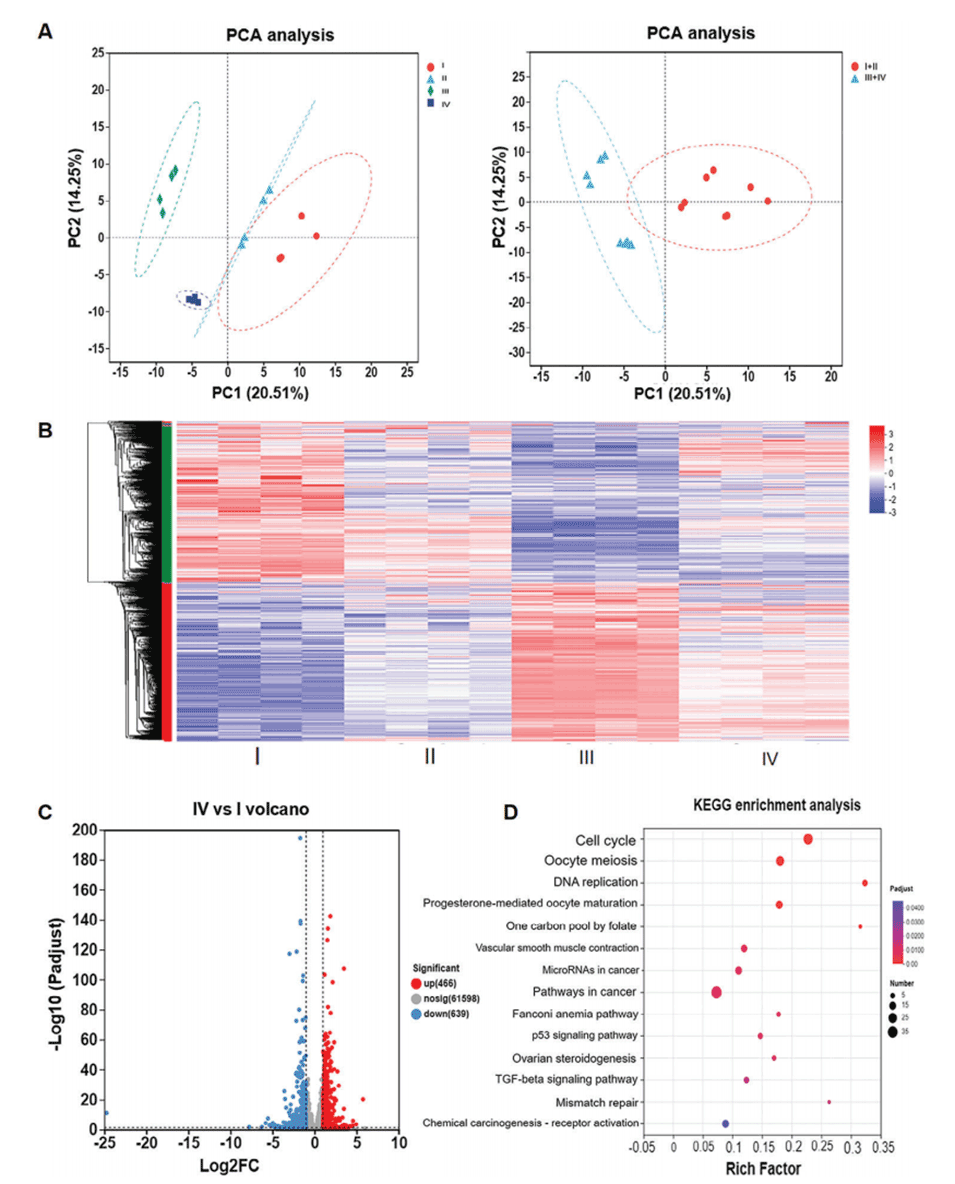
图5.转录组测序结果
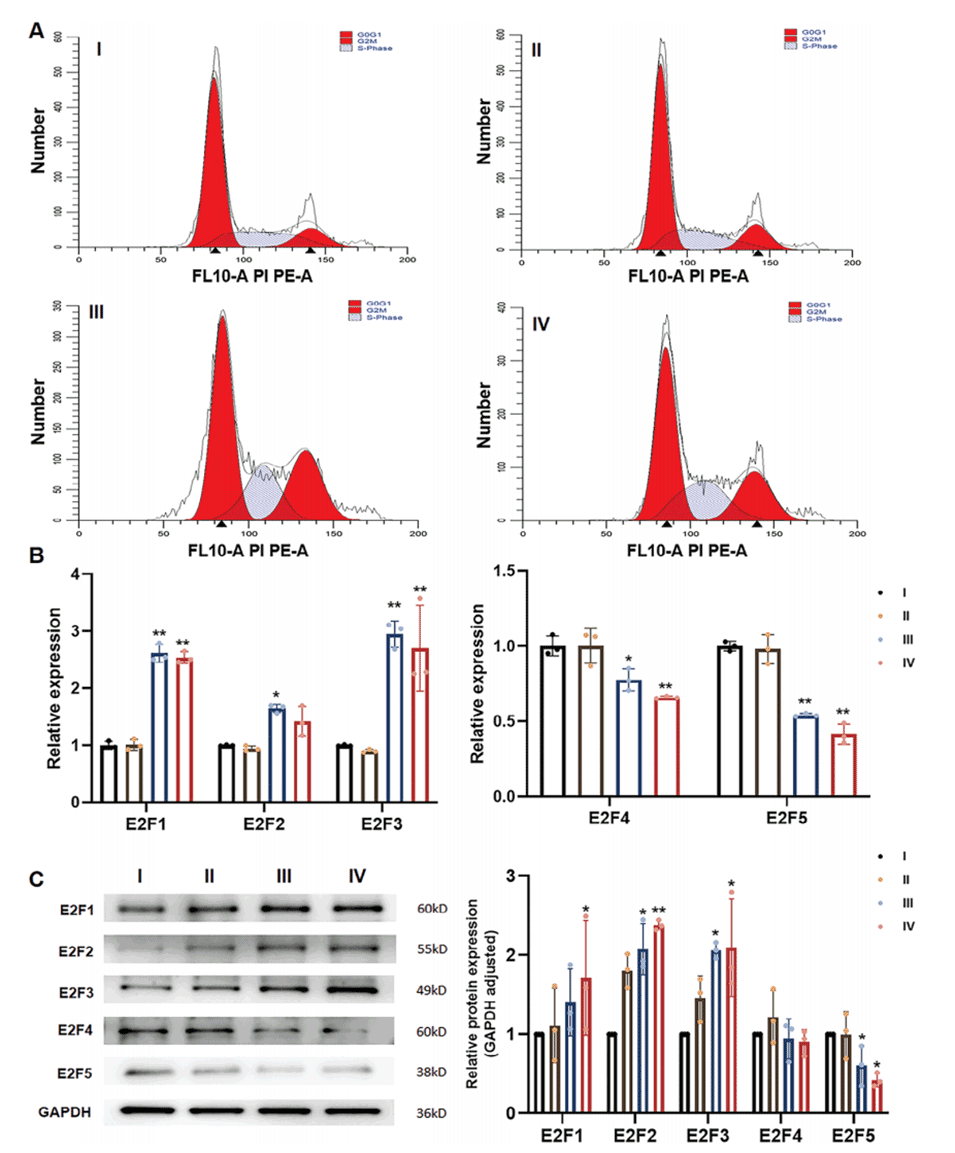
图6.PRP通过调节转录因子家族E2Fs的表达来调节细胞周期。
原文链接:https://doi.org/10.1002/smll.202403890














