
导读:
近期,东南大学生物科学与医学工程学院张天柱教授团队开发了一种响应微环境的水凝胶平台(MSC-GSM@HG),通过空间和时间控制释放载有间充质干细胞的多孔微球,以促进腹壁缺损的修复,克服了传统干细胞治疗中的低植入率和生存率问题。相关研究以“Spatiotemporal delivery of microenvironment responsive hydrogel incorporated with stem cells-loaded porous microspheres for abdominal wall repair”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究开发了一种名为MSC-GSM@HG的微环境响应性治疗平台,用于修复腹壁缺损。
2、该平台可响应体内炎症反应,溶解HA-PBA/Gel-DA(HG)水凝胶,释放负载间充质干细胞(MSC)的明胶和丝素蛋白微球(GSM)。
3、HG水凝胶不仅能保护MSC免受过量活性氧(ROS)的损害,还具备止血和抗炎特性。
4、研究表明,MSC-GSM@HG平台减少了炎症反应,促进了血管生成和胶原沉积,在体内显著增强了腹壁缺损的修复效果。
5、总之,该微环境响应性平台为基于MSC的腹壁缺损治疗提供了一种有前景的策略。
MSC-GSM@HG平台通过以下几种机制增强了干细胞的存活和疗效:
1、微环境响应性:该水凝胶能够在体内炎症反应下溶解,从而控制释放负载间充质干细胞(MSC)的多孔微球(GSM),确保干细胞按需精准释放。
2、保护作用:HA-PBA/Gel-DA水凝胶能够保护MSC免受过量活性氧(ROS)的损害,这在炎症环境中尤为重要,有助于维持干细胞的功能。
3、生物相容性和粘附性:水凝胶的材料(透明质酸和明胶)具有良好的生物相容性,可促进细胞的粘附和增殖,为MSC提供了有利的微环境。
4、止血和抗炎特性:该水凝胶具有止血和抗炎特性,能够减轻伤口的炎症反应,促进愈合过程。
5、促进血管生成和胶原沉积:MSC-GSM@HG平台能够有效促进血管生成和胶原沉积,这对于组织修复至关重要,进一步支持了干细胞的有效性。
综上所述,MSC-GSM@HG平台通过提供一个有利的微环境和多重保护机制,显著提高了干细胞在腹壁缺损修复中的存活率和疗效。
多孔微球的制备采用了微流控技术结合冷冻干燥的方法。具体步骤如下:
1、微流体设备的构建:通过组装两个22G注射针,形成微流体设备。一个注射针用于注入水相,另一个用于注入油相,流速的调节可以控制生成微球的尺寸。
2、微球的生成:在微流体设备中,水相和油相以特定的流速混合,形成微滴,随后通过光照固化形成微球。研究中使用了不同的水相与油相流速比,以获得不同尺寸的微球。
3、冷冻干燥:生成的微球在不同的冷却温度下进行冷冻干燥,以形成多孔结构。研究表明,在-196°C(液氮温度)下冷冻的微球能够形成理想的多孔表面结构。
4、表征和优化:通过扫描电子显微镜(SEM)对微球的形态进行表征,观察其表面和内部的多孔结构。微球的直径和孔径均经过统计分析,以确保其适合细胞培养和后续应用。
最终,制备的多孔微球不仅具有良好的生物相容性,还能有效支持间充质干细胞的增殖,为后续的组织修复提供了良好的载体。
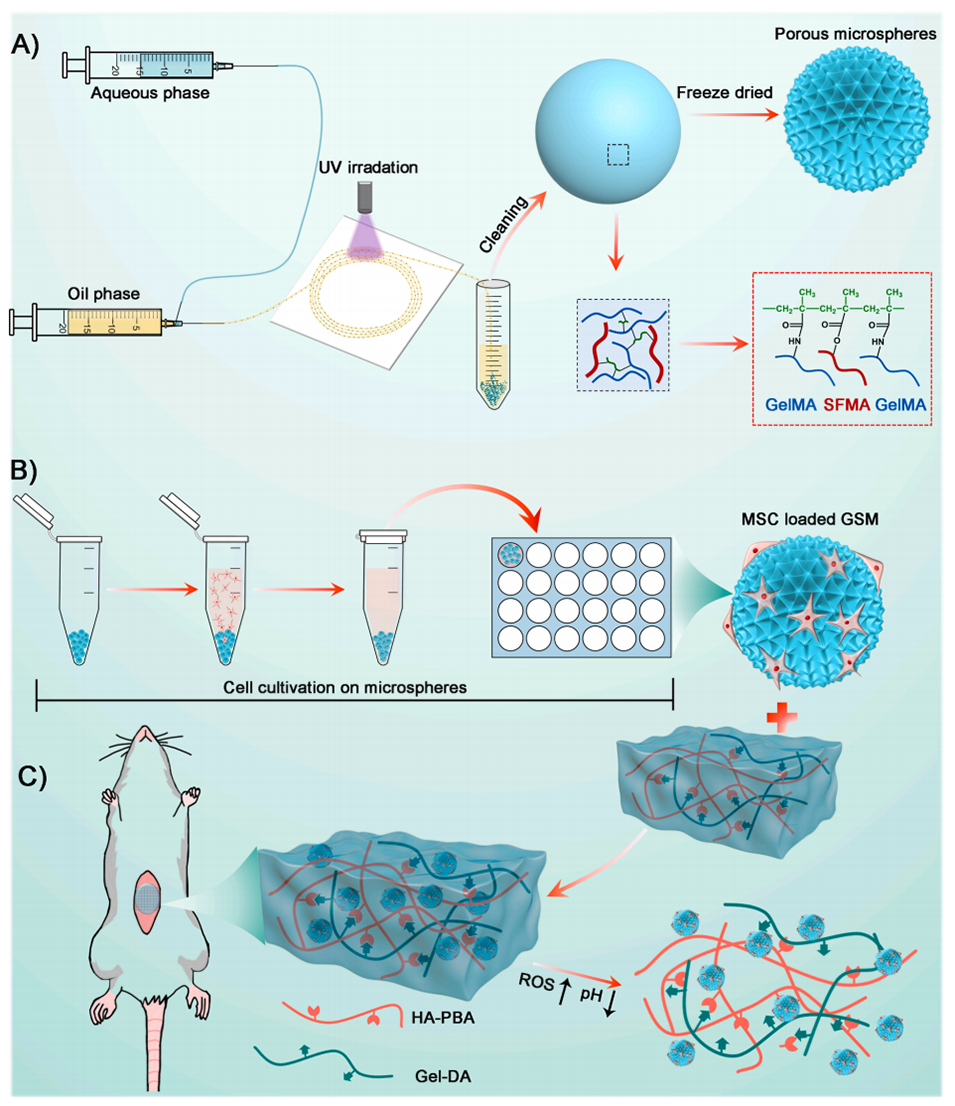
Scheme1.MSC-GSM@HG的构建示意图。
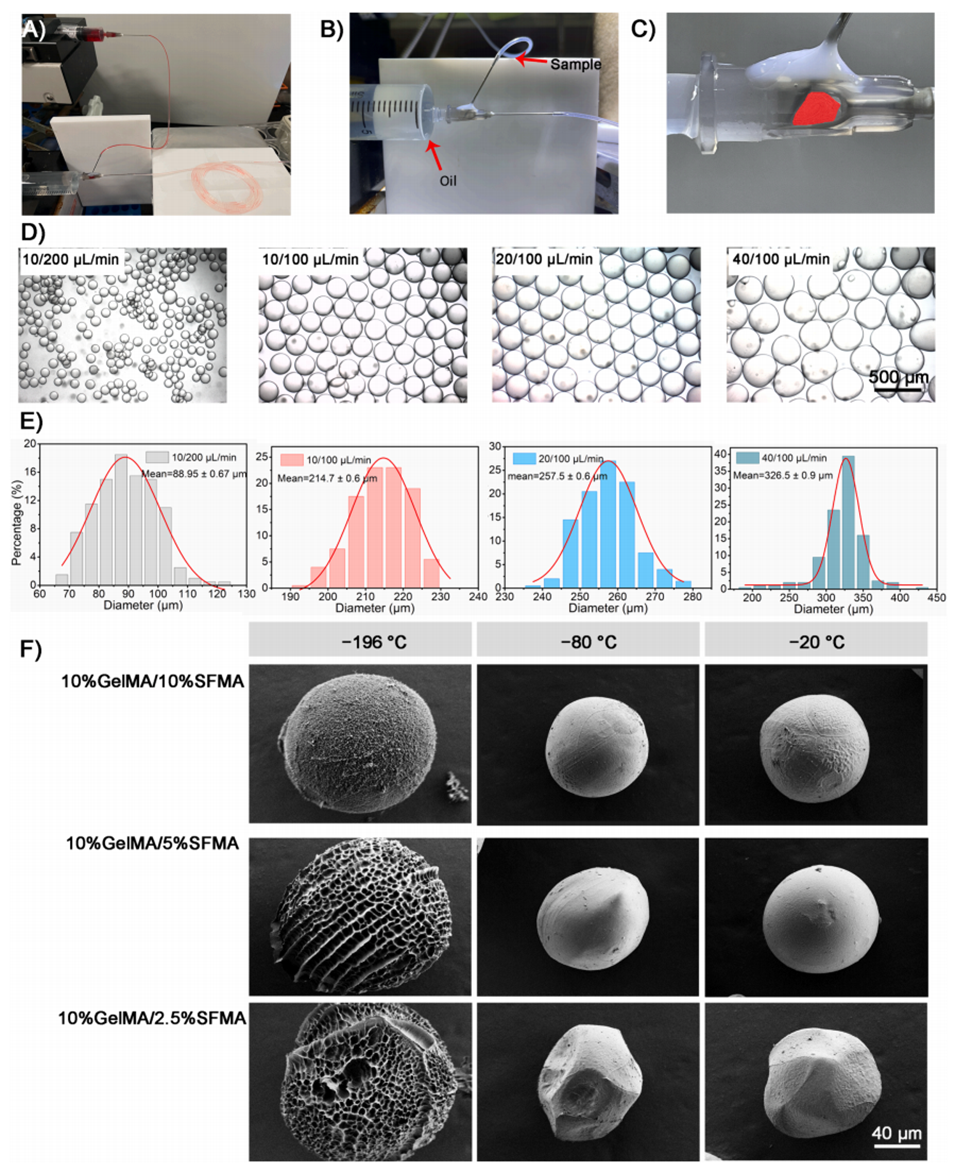
图1.GSM的生成。
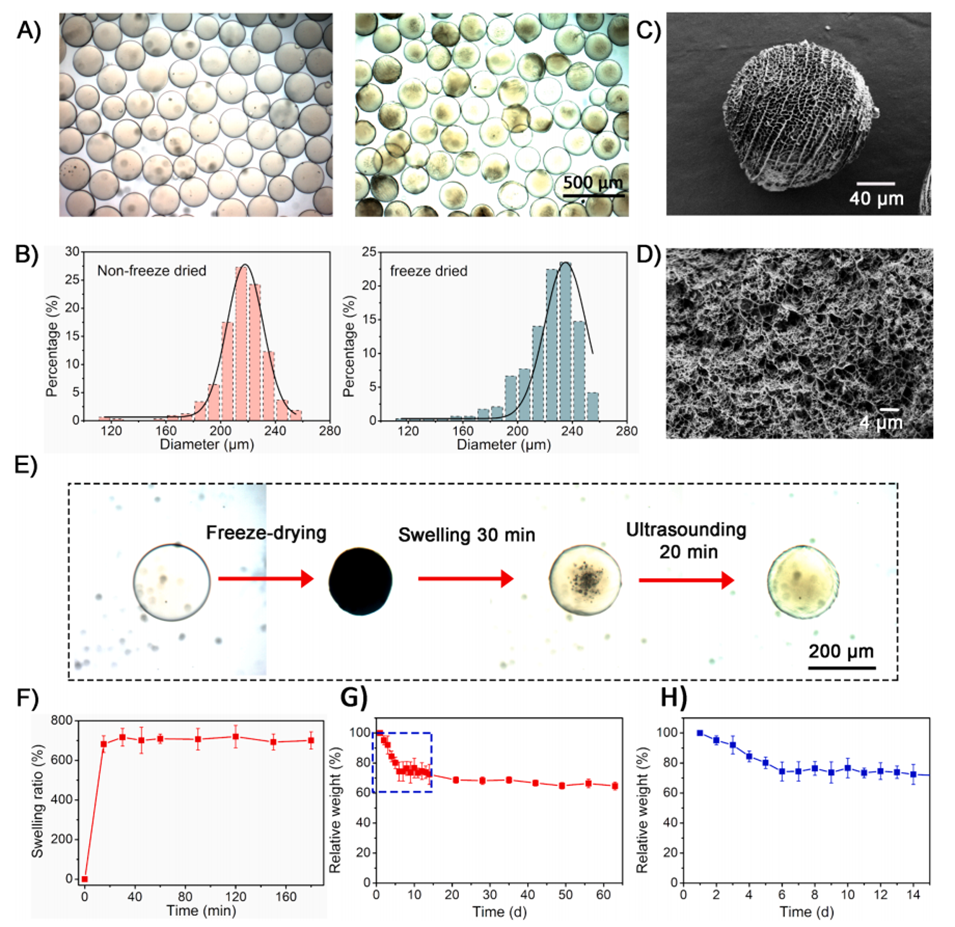
图2.GSM的表征。
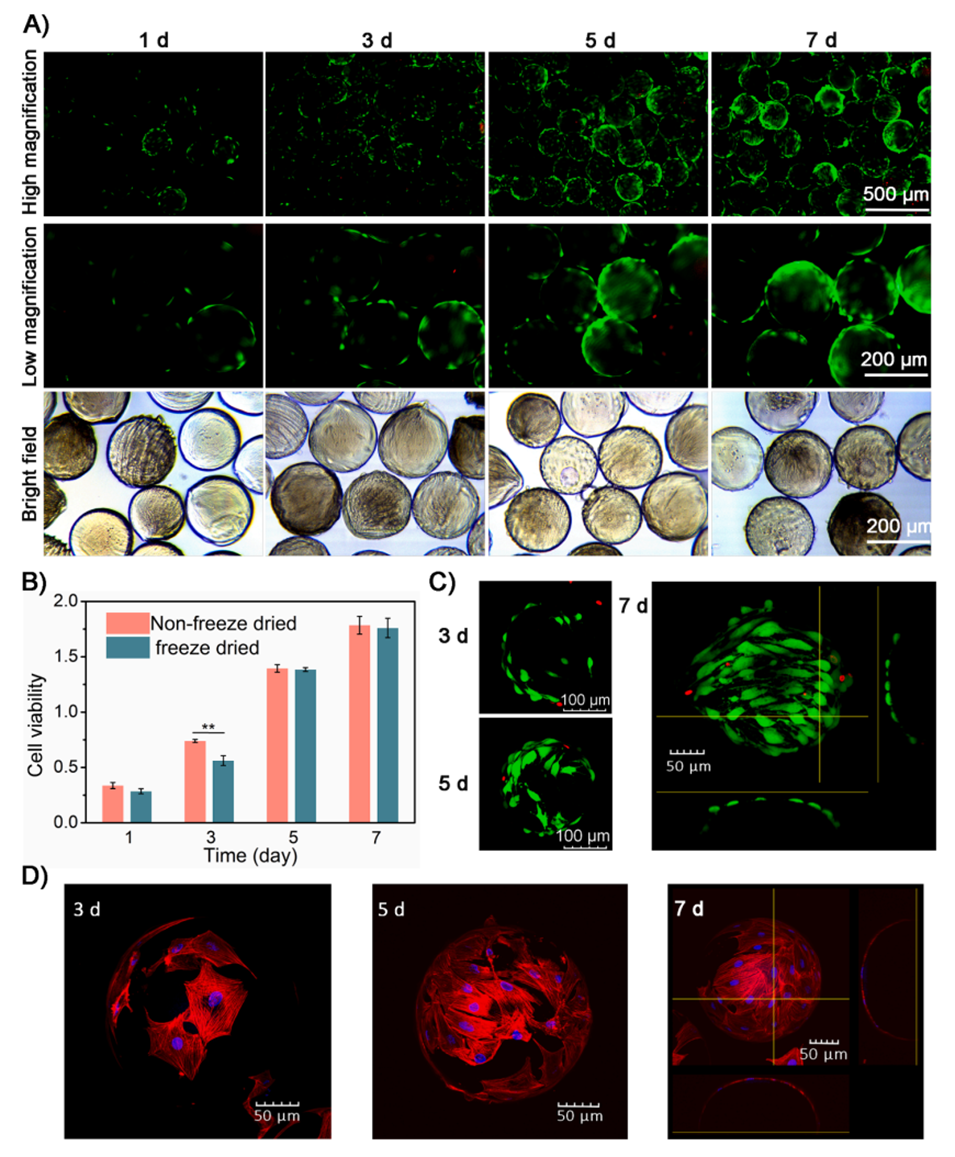
图3.多孔GSM上的细胞负载和增殖。
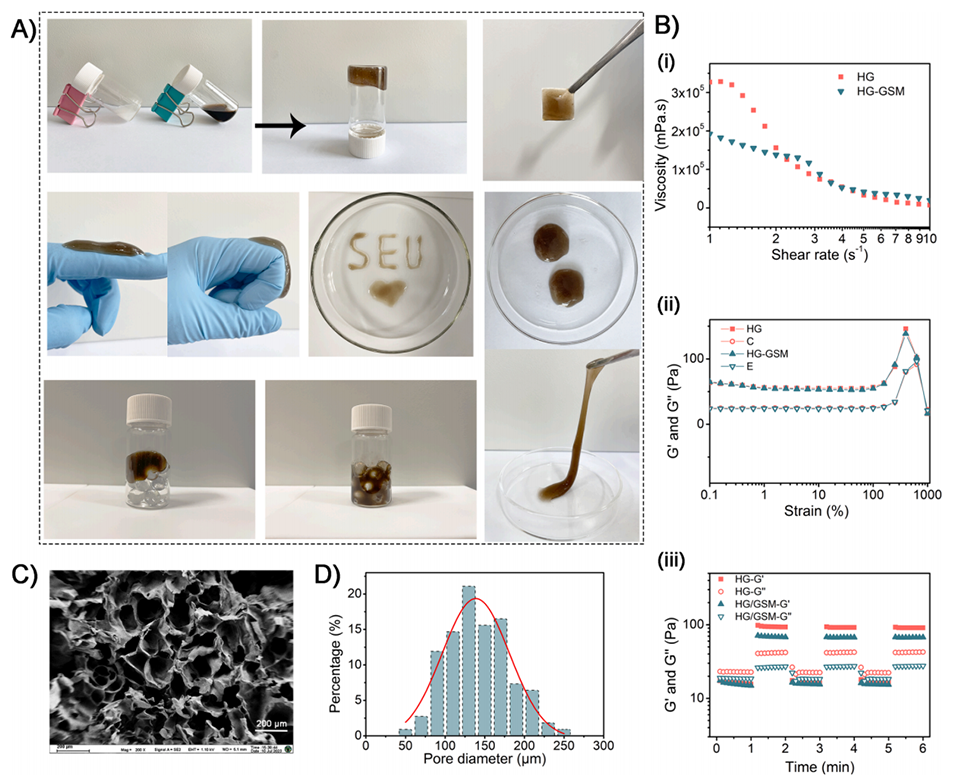
图4.HG水凝胶的表征和流变学分析。
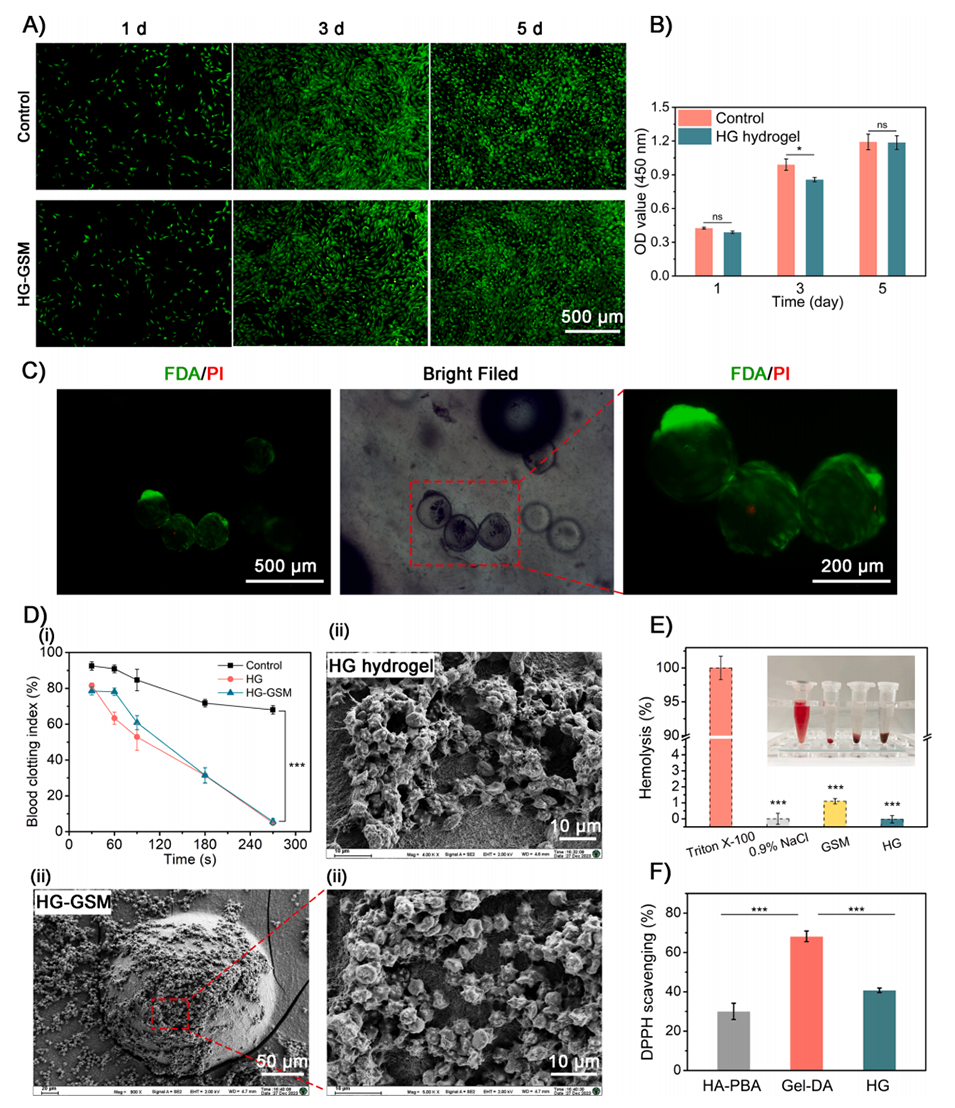
图5.水凝胶的生物相容性。
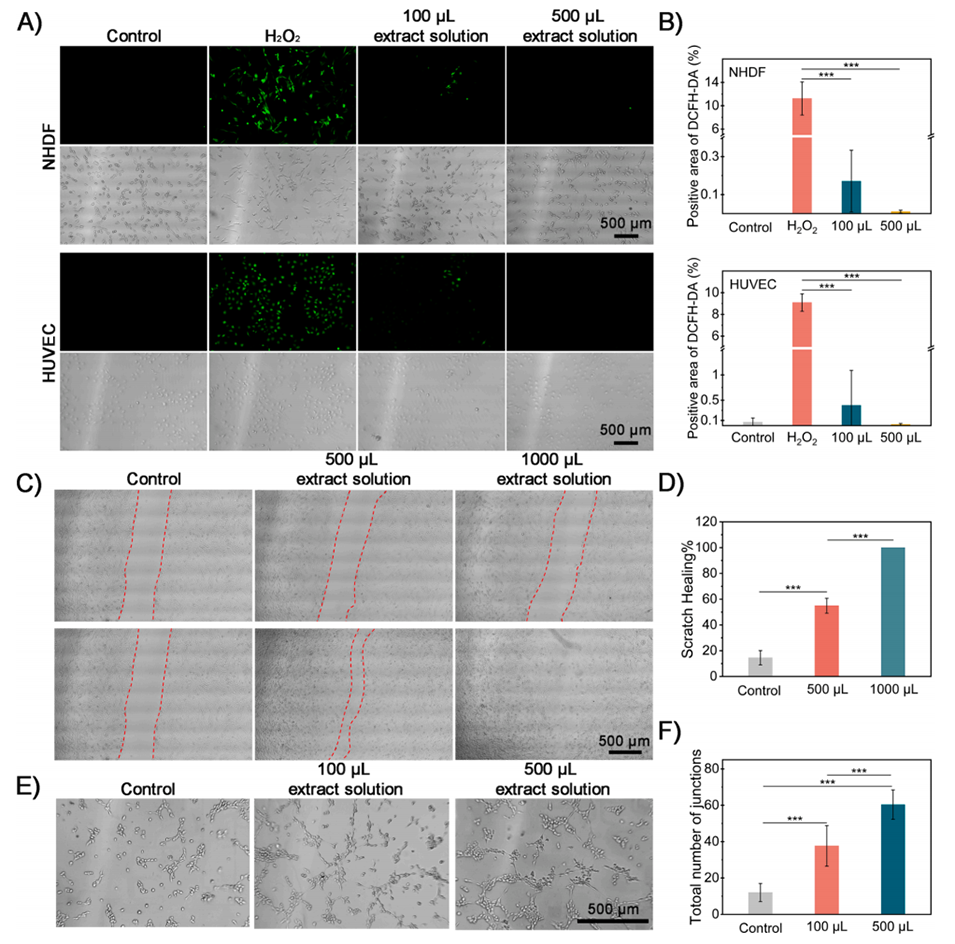
图6.MSC-GSM提取溶液对NHDF和HUVEC细胞的影响。
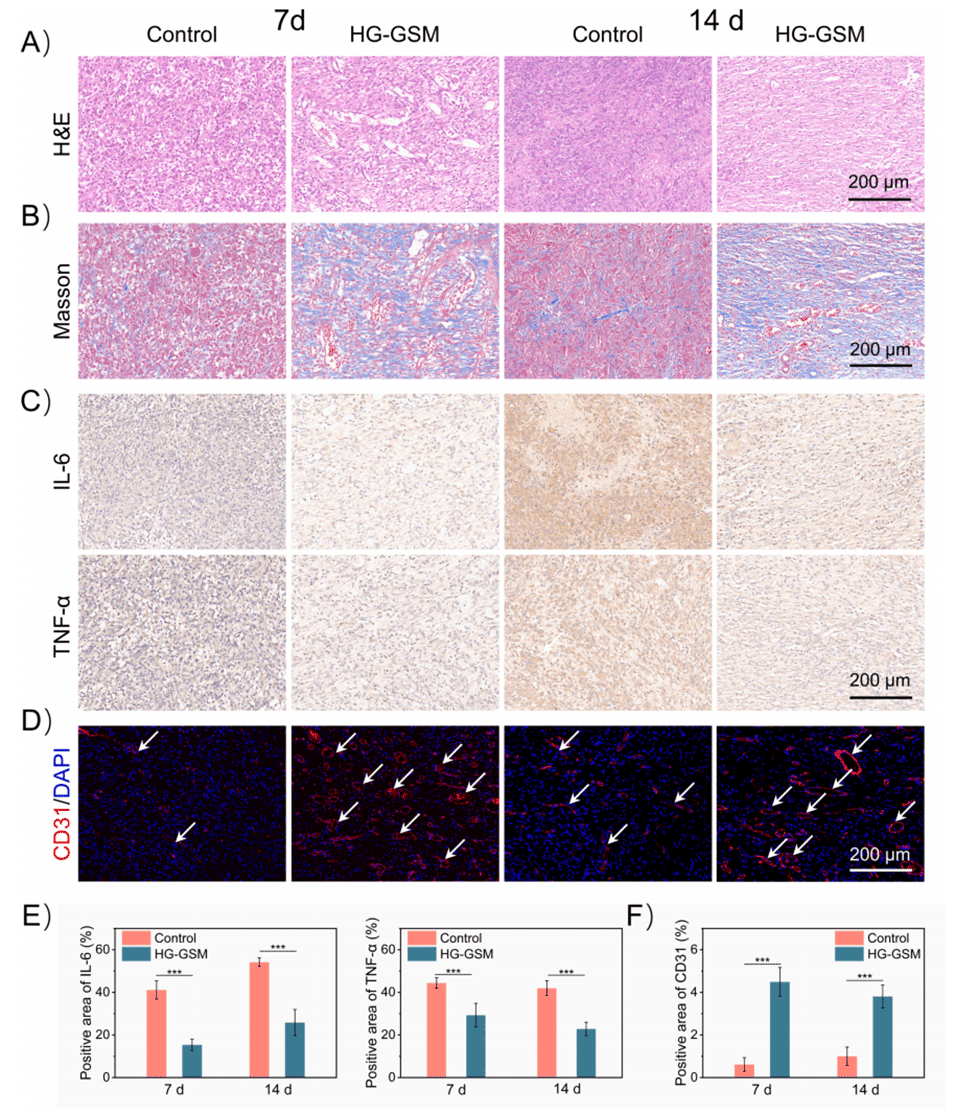
图7.MSC-GSM@HG在体内促愈合的组织形态学评价。
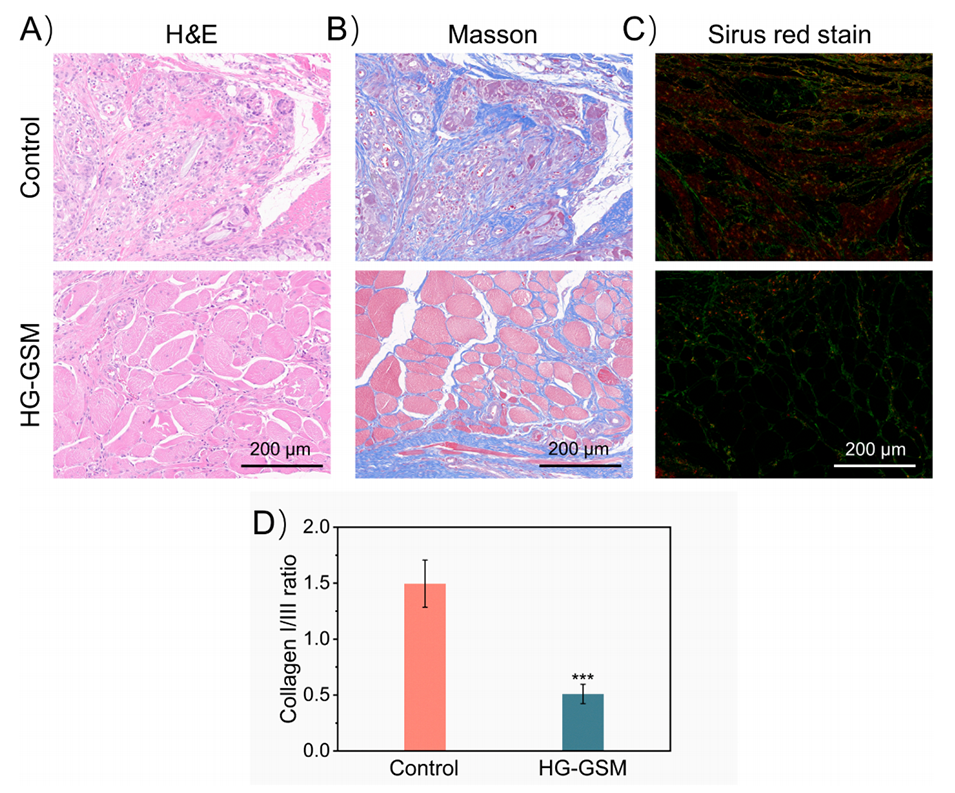
图8.在第30天对伤口组织进行H&E、Masson和免疫荧光染色。
论文链接:https://doi.org/10.1016/j.cej.2024.154435














