抗癌肽(ACP)具有良好的癌症细胞靶向性和抗癌作用以及低耐药性,是一种很有前途的抗癌药物。然而,许多ACP对癌症细胞没有选择性毒性,给药后很容易被酶降解。因此,需要药物递送系统(DDS)来保护这些肽免受降解并诱导靶向递送。

近期,常州大学招秀伯教授团队利用微流控装置制备了负载抗癌肽At3的沸石咪唑酯骨架(ZIF-8)纳米颗粒,以提高其在乳腺癌治疗中的效果,结果表明该纳米颗粒具有更好的抗癌活性和较低的毒性,展示了其作为抗癌药物递送系统的潜力。相关研究以“Microfluidic fabrication of anticancer peptide loaded ZIF-8 nanoparticles for the treatment of breast cancer”为题目,发表在期刊《Journal of Colloid and Interface Science》上。
本文要点:
1、本研究利用高性能微流控设备制备了负载抗癌肽At3的沸石咪唑酯骨架(ZIF-8)纳米颗粒,以增强其在乳腺癌治疗中的应用。
2、微流控技术实现了高效快速的混合,生成了具有可控特性的纳米颗粒,且其尺寸均匀性优于传统方法制备的产物。
3、将At3封装到ZIF-8中显著降低了其溶血效应,并实现了pH控制释放。
4、由于ZIF-8 NPs增强了细胞摄取,At3@ZIF-8在相同浓度下显示出比游离肽更高的抗癌作用。NPs能够抑制多细胞肿瘤球体(MCTSs)的生长并破坏MCF-7乳腺癌细胞的线粒体膜。
5、体内实验表明,At3@ZIF-8纳米颗粒可抑制裸鼠MCF-7肿瘤的生长,且未对血液生化指标或重要器官的组织病理特性产生明显影响。
6、因此,At3负载纳米颗粒为抗癌肽的递送提供了新的思路,拓宽了其在癌症治疗中的应用。
使用微流控技术合成ZIF-8纳米颗粒的优势包括:
1、更好的尺寸控制和均一性:微流控设备能够实现高效快速的混合,从而生成尺寸更小、分散性更好的ZIF-8纳米颗粒,与传统批量法相比,微流控法制备的ZIF-8纳米颗粒具有更低的多分散指数(PDI)。
2、更高的药物包封效率:与传统的批量法相比,微流控法制备的At3@ZIF-8纳米颗粒的药物包封效率显著提高(81% vs 59%)。
3、更高的生产率:微流控设备(旋涡混合器)能够以120 mL/min的高生产率制备ZIF-8纳米颗粒,远高于典型的微流控设备。
4、简单性和一步法:微流控合成ZIF-8纳米颗粒是一个简单的一步法过程,不需要特殊条件如高温、有机溶剂或多步骤操作,与传统方法相比更加简单。
综上所述,微流控法能够高效、快速、可控地合成尺寸均一的ZIF-8纳米颗粒,并具有较高的药物负载量,相比于传统批量法,微流控法是制备ZIF-8基药物递送系统的首选方法。
将抗癌肽At3封装到ZIF-8纳米颗粒中显著增强了抗癌效果,其作用机制主要体现在以下几个方面:
1、保护肽免受降解:封装在ZIF-8纳米颗粒中的At3能够避免被体内酶轻易降解,从而提高了稳定性并延长了循环时间。
2、提高细胞摄取:At3@ZIF-8纳米颗粒能够增强At3在癌细胞中的摄取,导致更高的细胞内浓度,从而提高抗癌活性。
3、降低溶血效应:封装在ZIF-8中的At3显示出较低的溶血作用,减少了对正常细胞的毒性,这使得其在治疗过程中更加安全。
4、pH响应性释放:ZIF-8纳米颗粒在酸性环境中(如肿瘤微环境)能够快速释放At3,这种pH敏感性使得药物在肿瘤部位集中释放,增强了治疗效果。
5、抑制肿瘤生长:At3@ZIF-8纳米颗粒在体外和体内实验中均显示出对MCF-7乳腺癌细胞和肿瘤的显著抑制作用,且在3D多细胞肿瘤球模型中表现出更强的抗肿瘤效果。
6、破坏线粒体膜:At3@ZIF-8纳米颗粒能够破坏癌细胞的线粒体膜,引起细胞死亡,这是其抗癌效果增强的直接原因之一。
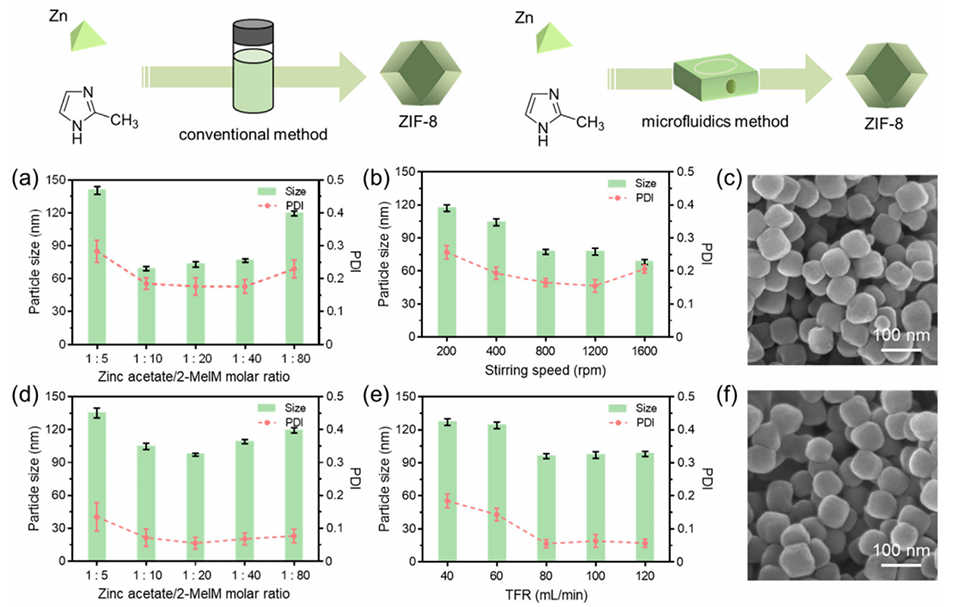
图1.不同参数对ZIF-8合成的影响。
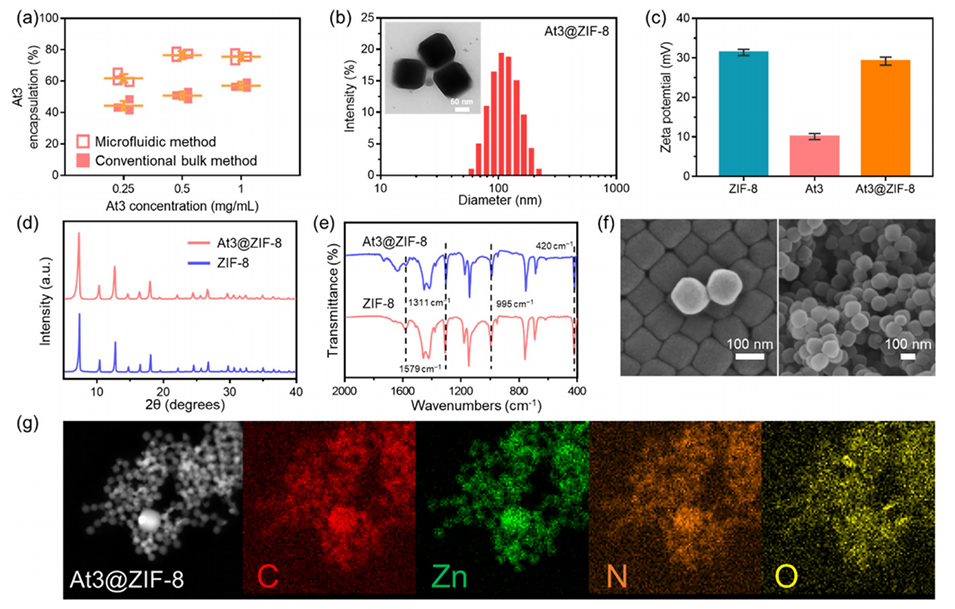
图2.(a)通过传统的批量法和微流控法封装At3@ZIF-8。(b)At3@ZIF-8 NPs的粒径分布。(c)ZIF-8 NPs和At3@ZIF-8 NPs的Zeta电位、(d)XRD图谱和(e)FTIR光谱。(f)At3@ZIF-8的SEM。(g)At3@ZIF-8 MOFs中常见元素的EDS映射。
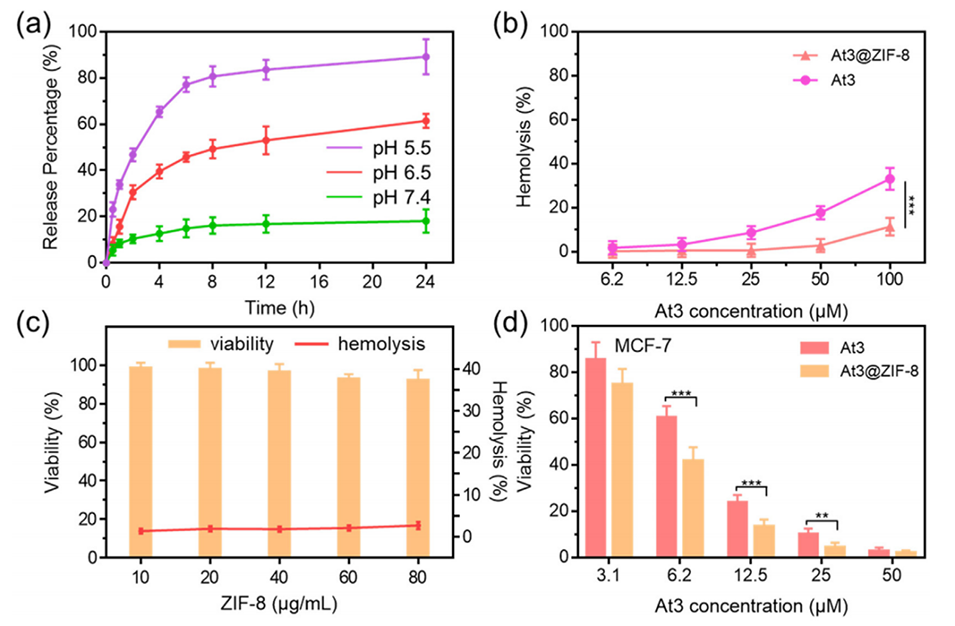
图3.(a)在不同pH条件下At3@ZIF-8 NPs的At3累计释放量。(b)不同浓度At3和At3@ZIF-8 NPs的溶血率。(c)与一定浓度的ZIF-8 NPs孵育24小时后MCF-7的存活率和溶血率。(d)与一定浓度的At3和At3@ZIF-8孵育24小时后MCF-7的存活率。(n≥3;***P<0.001和**P<0.01)。
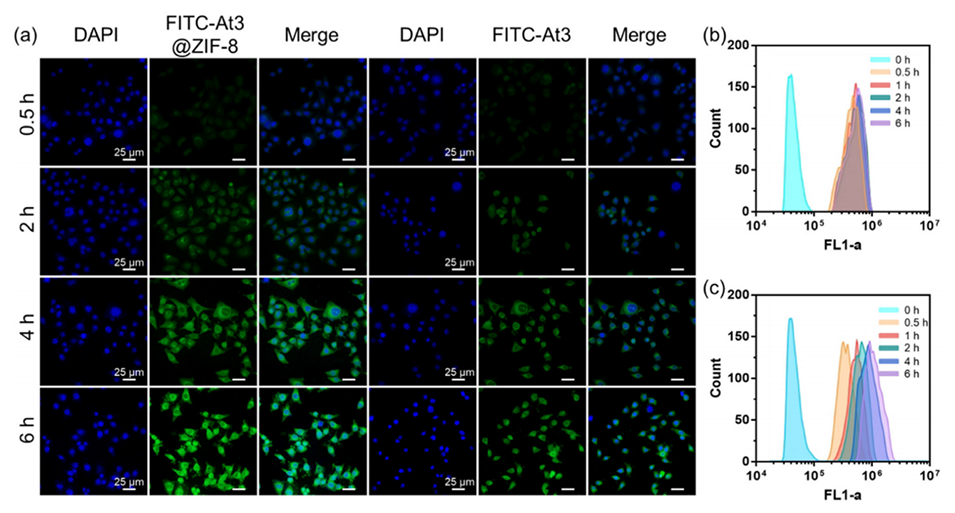
图4.At3和At3@ZIF-8的细胞摄取。
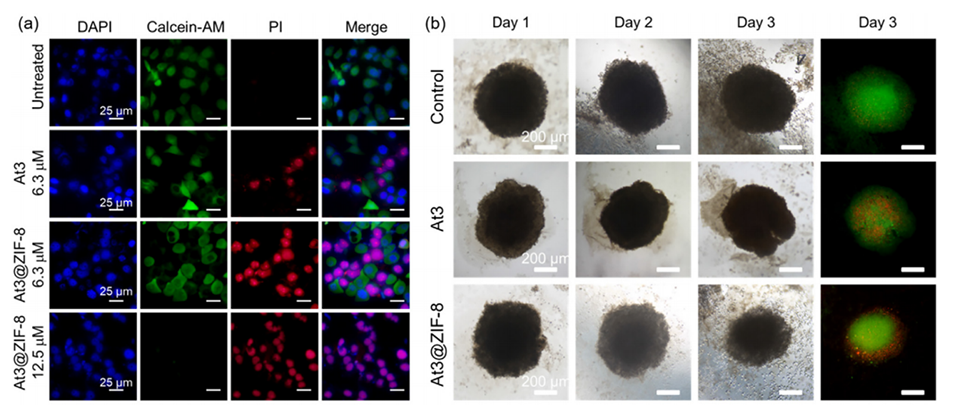
图5.钙黄绿素AM/PI和DAPI染色。
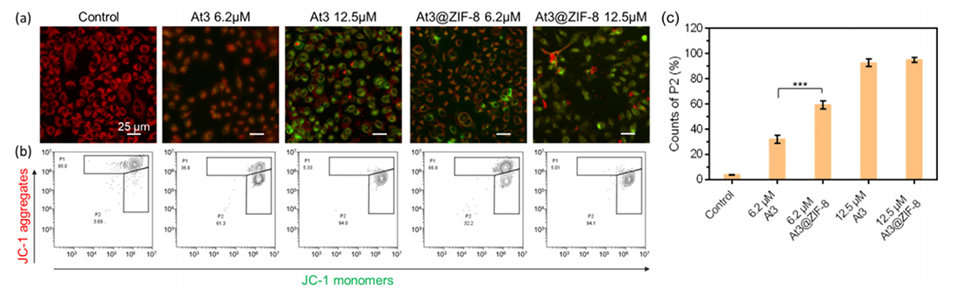
图6.线粒体膜损伤测定。
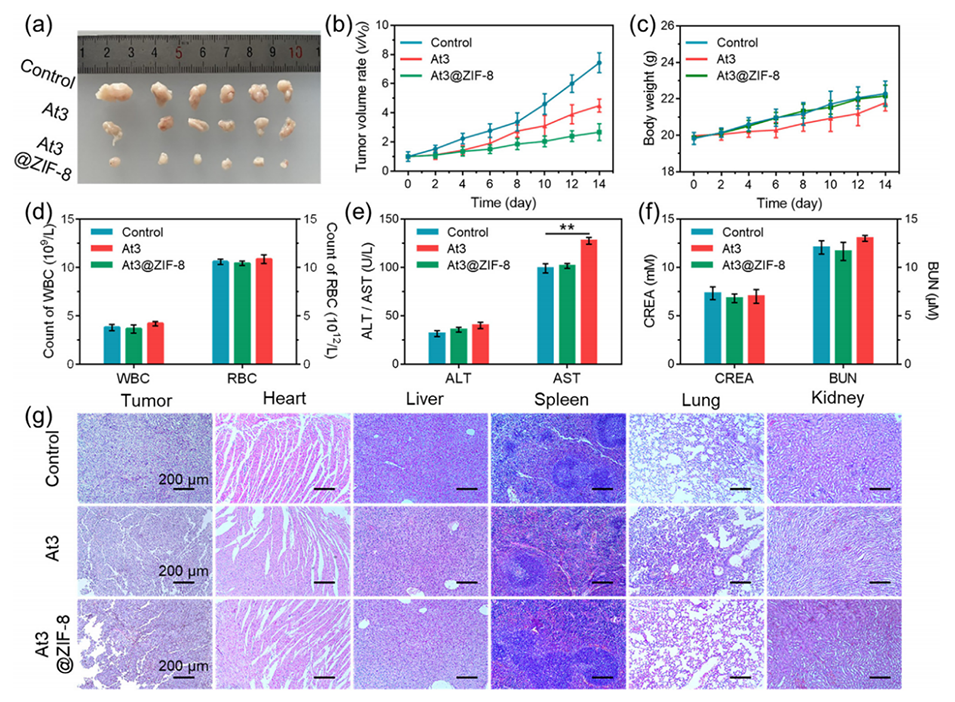
图7.At3和At3@ZIF-8 NPs的体内抗肿瘤研究。
论文链接:https://doi.org/10.1016/j.jcis.2023.03.172














