经导管动脉放射栓塞(TARE)对于晚期肝细胞癌(HCC)的治疗具有重要意义。然而,现有的放射性栓塞微球仍存在不可降解、尺寸不均匀、无法直接体内监测等问题,阻碍了TARE的发展。

近期,四川大学巨晓洁教授、四川大学华西医院张文杰等人开发了一种新型放射性栓塞剂——131I标记的甲基丙烯酸明胶微球(131I-GMs),用于治疗肝癌。相关研究以“Microfluidic Controllable Preparation of Iodine-131-Labeled Microspheres for Radioembolization Therapy of Liver Tumors”为题目,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、本研究开发了一种新型131I标记甲基丙烯酸明胶微球(131I-GMs),用于肝癌的经导管动脉放射栓塞治疗(TARE)。
2、通过简单的一步微流控方法制备油包水(W/O)乳液模板,经过紫外线照射获得均匀且可控尺寸的明胶微球。
3、放射性标记实验表明,氯胺T法可以将131I与GMs有效结合,所得131I-GMs在体外表现出良好的放射稳定性。
4、动物实验显示,131I-GMs能够在肝动脉中良好滞留,并对肝癌的进展具有显著的抑制作用,显示出其作为肝癌治疗的新型放射栓塞剂的潜力。
5、该微球具有可降解性、良好的生物相容性和可视化特性,为个性化治疗提供了新的可能性。
放射性标记微球(131I-GMs)的制备方法主要包括以下几个步骤:
1、微流控技术制备油包水(W/O)乳液模板:通过微流控设备,将内流体(包含去离子水、光引发剂和明胶)与外流体(大豆油和表面活性剂)混合,形成单分散的乳液模板。内流体的流速范围通常在50到300 μL/h,外流体的流速范围在1到6 mL/h,通过调节流速可以精确控制乳液模板的尺寸。
2、紫外线聚合:将收集到的乳液模板在紫外光照射下进行聚合,形成交联的明胶微球(GMs)。
3、干燥处理:制备完成的微球可以通过空气干燥或冷冻干燥进行干燥,以便于保存和后续使用。干燥后的微球在生理盐水中能够迅速恢复到其原始形状和尺寸。
4、放射性标记:使用氯胺-T方法将131I化学结合到微球上。具体步骤为将膨胀的微球与131I-NaI溶液和氯胺-T溶液混合,搅拌并在室温下孵育,随后用PBS洗涤以去除未反应的131I。
5、稳定性测试:制备的131I-GMs在体外进行放射性稳定性测试,以确保其在生理环境中的有效性。
通过这些步骤,制备出的131I-GMs具有均匀且可控的尺寸、良好的生物相容性和放射性稳定性,适合用于肝癌的放射栓塞治疗。
使用131I标记的甲基丙烯酸明胶微球(131I-GMs)进行经导管动脉放射栓塞治疗(TARE)具有以下主要优势:
1、可控尺寸和均匀性:通过微流控技术制备的131I-GMs具有均匀且可控的尺寸,这有助于实现个性化治疗,减少非靶向栓塞的风险。
2、生物相容性和可降解性:131I-GMs由明胶衍生物制成,具有良好的生物相容性和可降解性,能够在体内安全降解,减少对患者的潜在毒性。
3、优异的弹性:微球的弹性使其在通过导管注射时更加顺畅,避免在导管内的聚集,确保有效输送。
4、放射稳定性:131I-GMs在体外表现出良好的放射稳定性,能够在治疗过程中保持有效的放射性。
5、便于体内监测:131I不仅可以用于放射治疗,还能通过其发射的γ射线进行体内成像,便于监测微球在体内的分布和治疗效果。
6、显著的抗肿瘤效果:动物实验表明,131I-GMs能够有效抑制肝癌的进展,显示出良好的治疗潜力。
综上所述,131I-GMs作为一种新型放射栓塞剂,具备了多项优势,能够显著提高对肝癌的治疗效果。
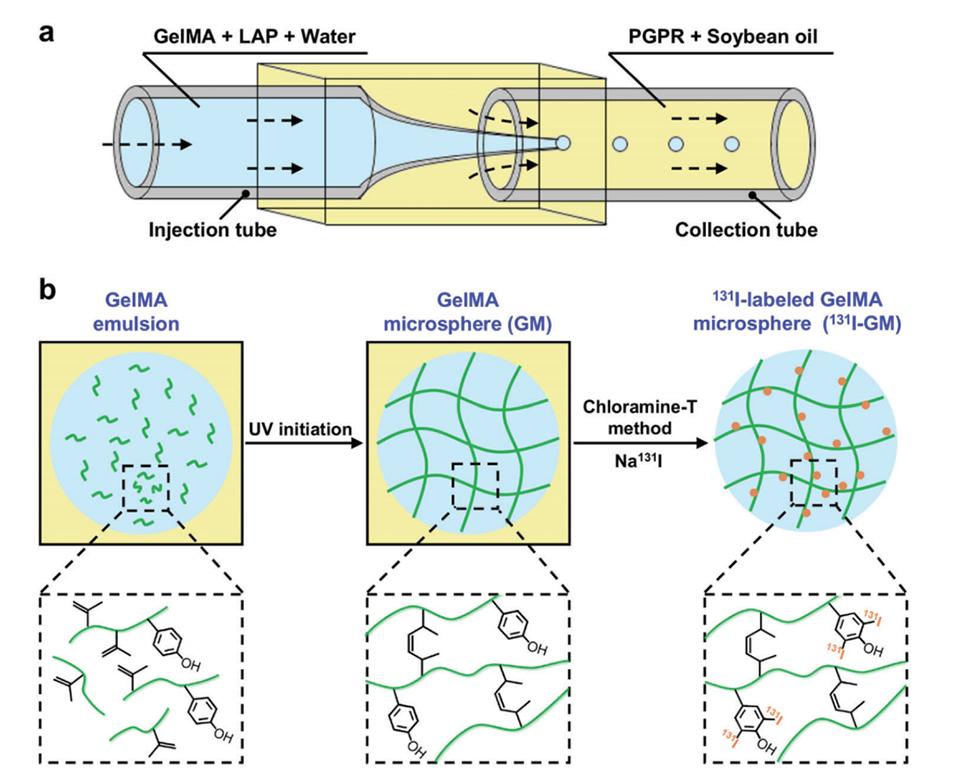
图1.制备131I标记的GelMA微球(131I-GMs)的示意图。a)用于制备W/O单乳液模板的微流体装置。b)GelMA微球(GMs)和131I-GMs的制备。
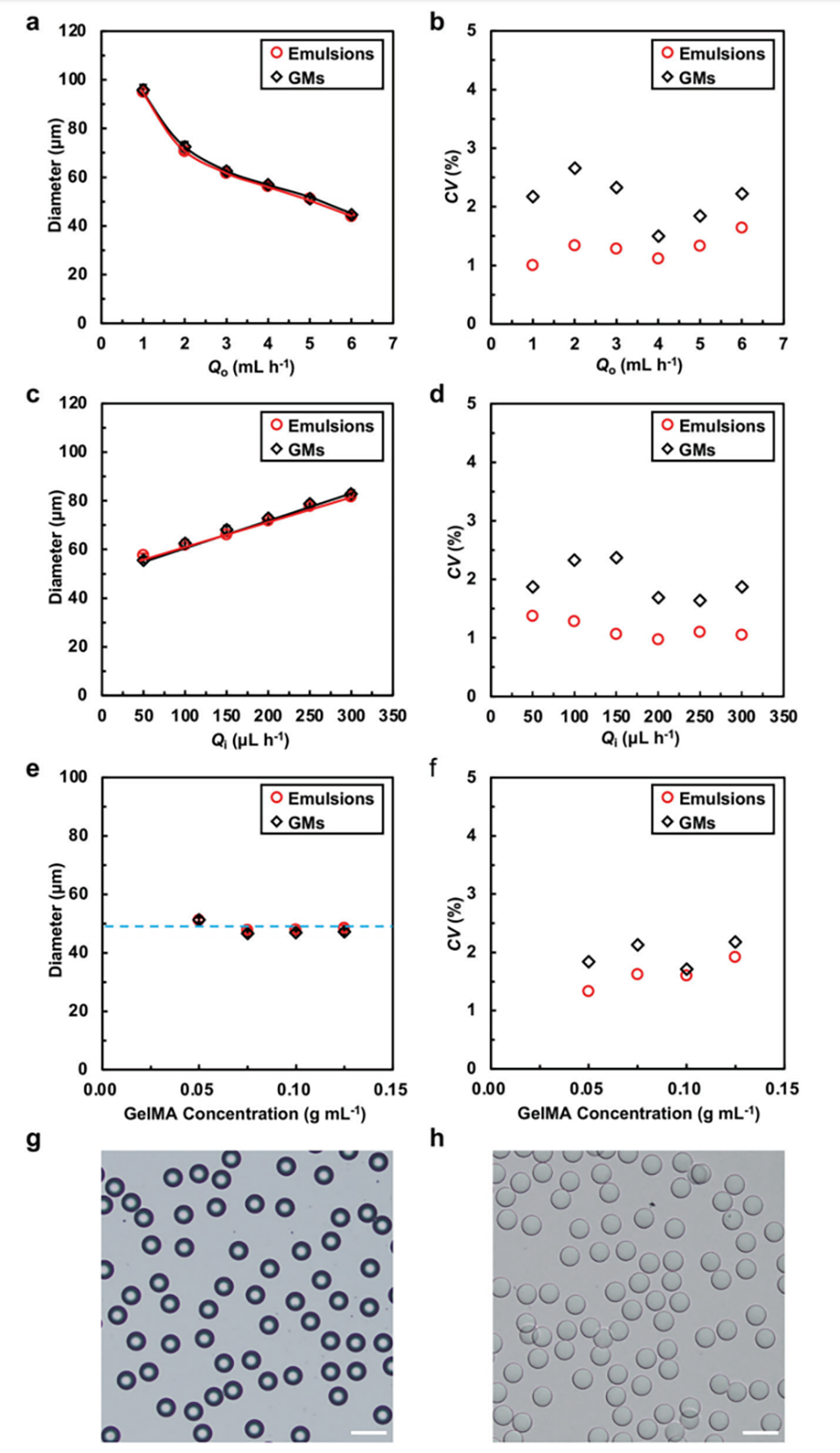
图2.当内部流体的流速为100μL h-1时,外部流体的流量对GelMA乳液和微球的a)直径和b)CV值的影响。当外部流体的流速为3 mL h-1时,内部流体的流速对GelMA乳液和微球的c)直径和d)CV值的影响。当内部流体和外部流体的流速分别为100μL h-1和5 mL h-1时,GelMA浓度对GelMA乳液和微球的e)直径和f)CV值的影响。当GelMA浓度为0.10 g mL-1,内部流体和外部流体的流速分别为100μL h-1和5 mL h-1时,g)GelMA乳液和h)微球的光学图像。比例尺=100μm。
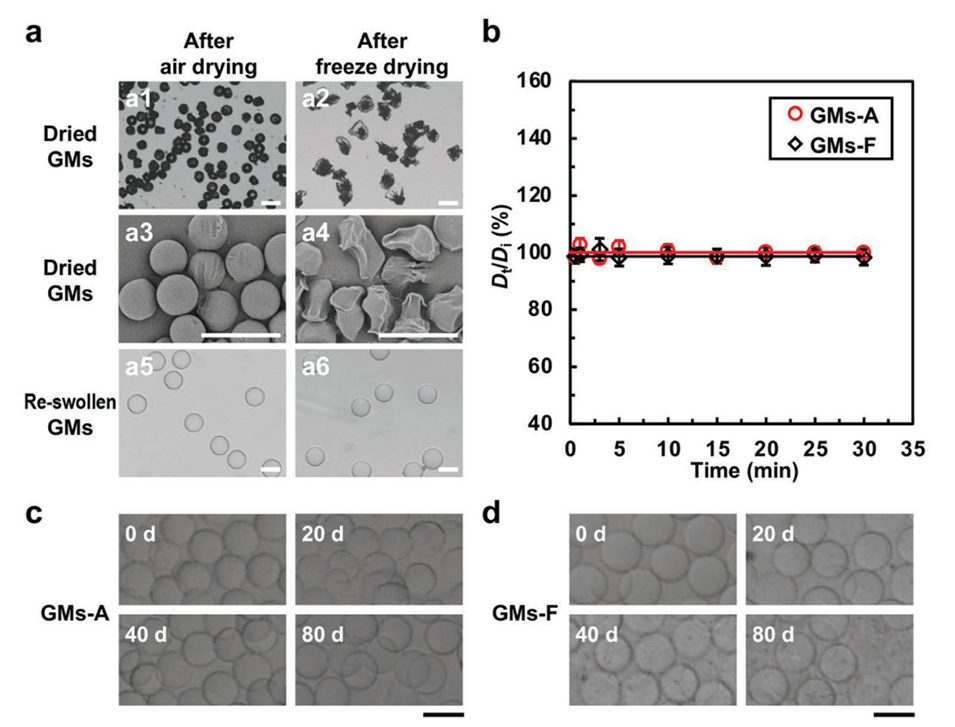
图3.a)GMs的形态表征:a1,2)干燥GMs的光学图像,a3,4)干燥GMs的扫描电镜(SEM)图像,a5,6)空气干燥后再溶胀的GMs(GMs-A)和冷冻干燥后再溶胀的GMs(GMs-F)的光学图像。b)空气干燥和冷冻干燥后PBS中GMs的溶胀恢复率Dt/Di随时间的变化。c)在FBS中孵育0、20、40和80天的GMs-A和d)GMs-F的光学图像;比例尺=50μm。
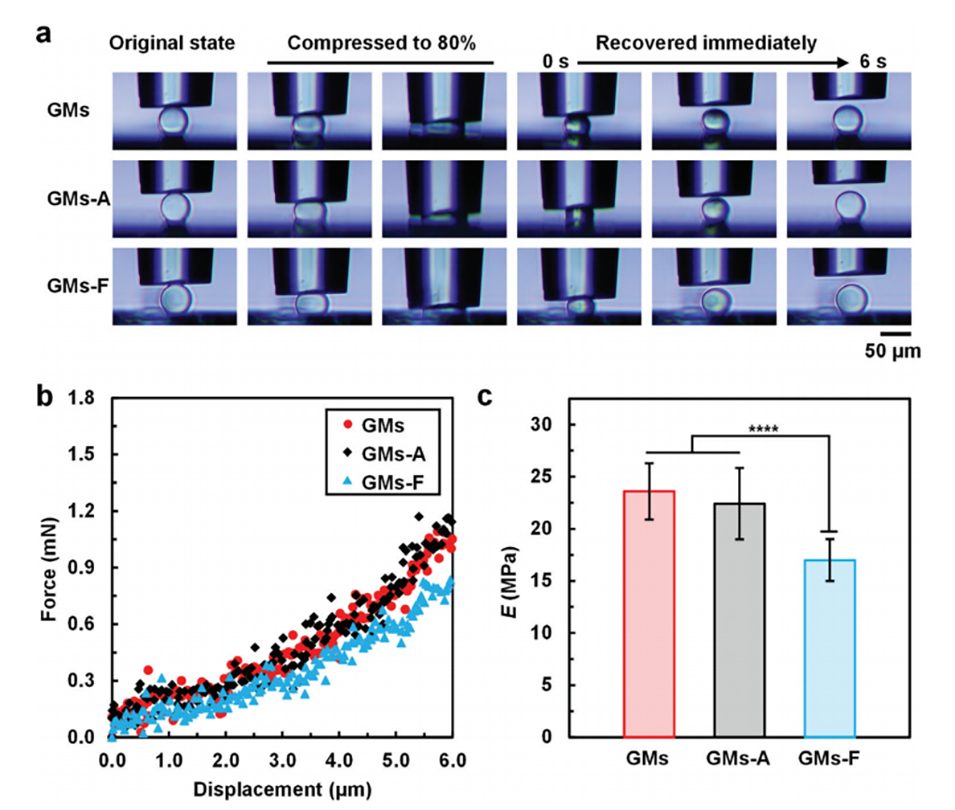
图4.不同GMs的弹性性能。a)压缩和恢复过程中不同GMs的快照。b)不同GMs的力-位移曲线。c)不同GMs的E值。
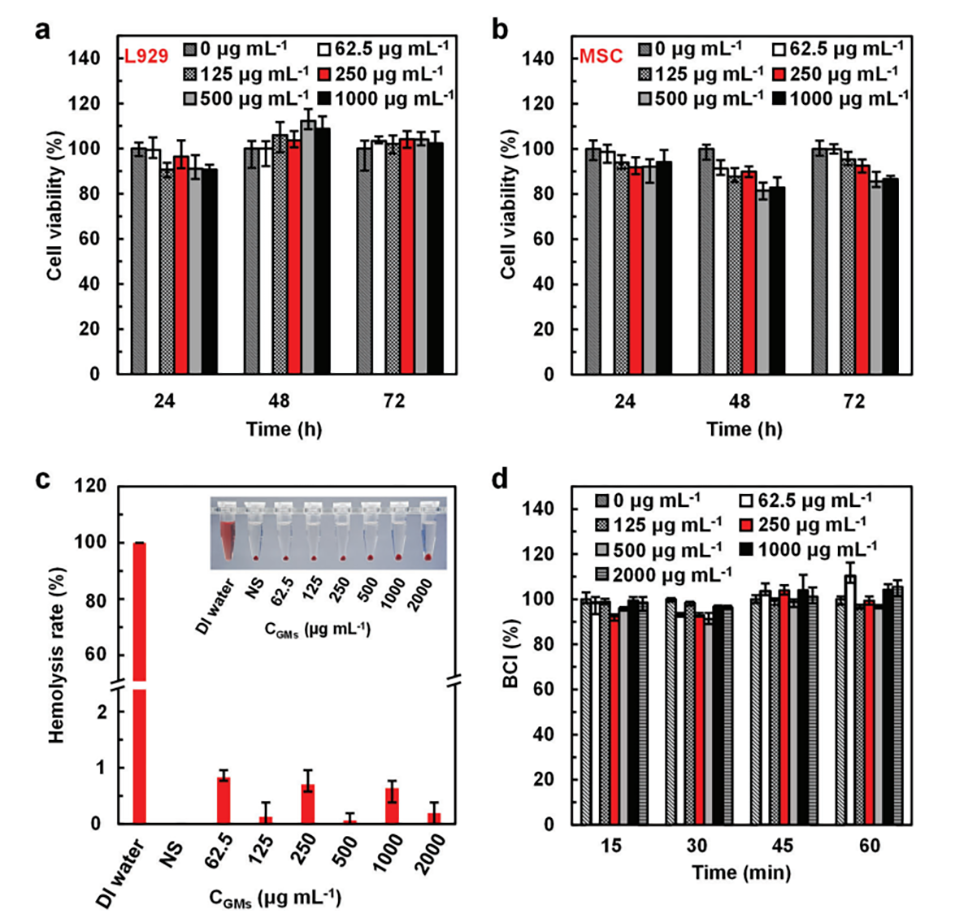
图5.GMs的体外生物相容性:a)L929细胞和b)MSC细胞与不同浓度GMs共孵育后的存活率。c)GMs的溶血率。d)GMs的BCI。
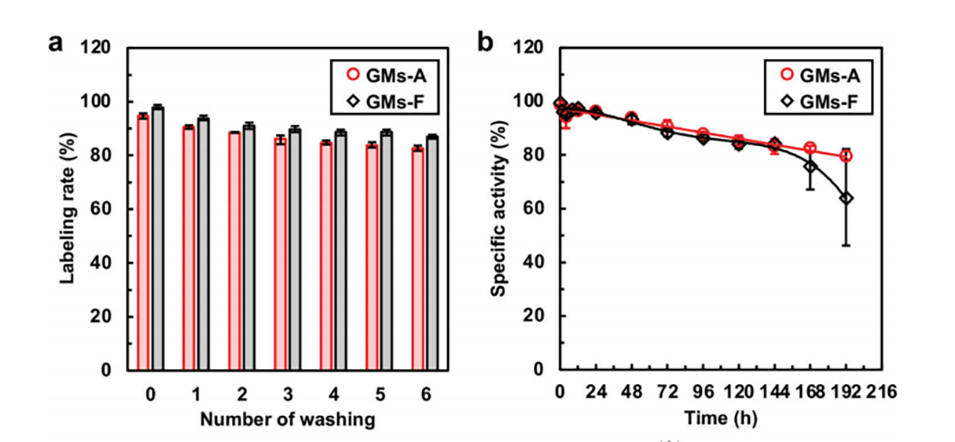
图6.GMs的放射性标记:a)不同131I-GMs的放射标记率,b)50%FBS中不同131I-GMs的放射化学图谱,n=3。
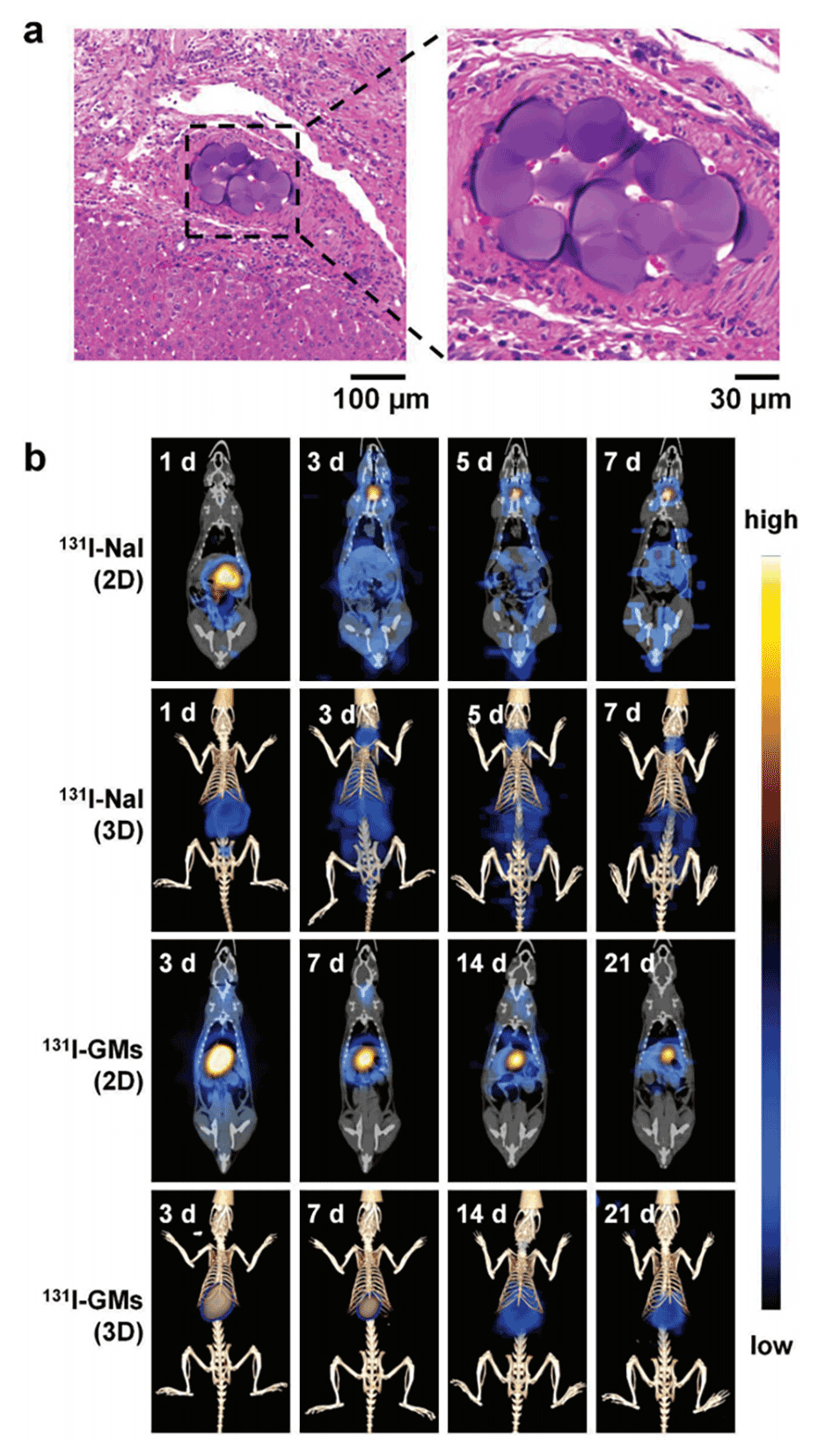
图7.a)GMs动脉栓塞后大鼠肝动脉H&E染色切片的显微照片。b)全身SPECT/CT成像显示经动脉注射后大鼠体内131I-NaI和131I-GMs的生物分布。
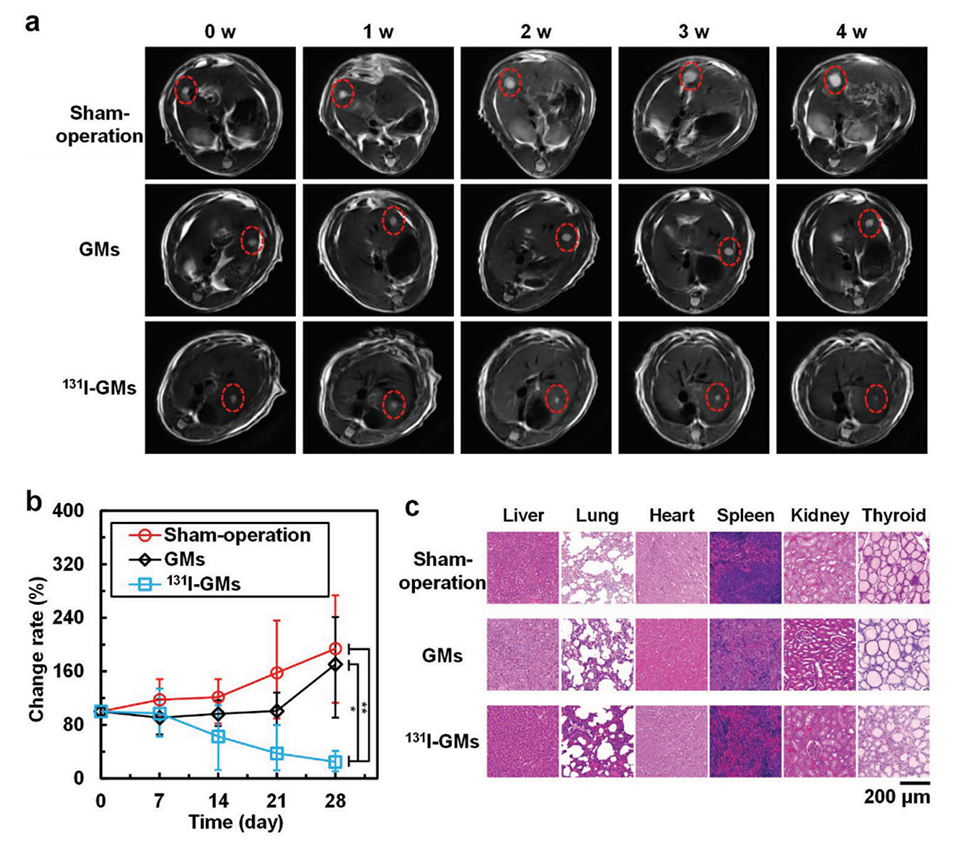
图8.a)MRI监测肿瘤生长。b)大鼠经动脉注射后肿瘤体积的变化率(n=10)。c)治疗30天后解剖的肝脏、肺、心脏、脾脏、肾脏和甲状腺的H&E染色图像。
论文链接:https://doi.org/10.1002/adhm.202300873














