
近期,德黑兰大学Vahid Bazargan团队采用微流控技术和数值模拟相结合的方法,精确控制载药PLGA微粒的尺寸和均匀性,为开发更可靠和可重复的药物递送系统提供了新途径。相关研究以“Size prediction of drug-loaded Polymeric (PLGA) microparticles prepared by microfluidics”为题目,发表在期刊《Journal of Drug Delivery Science and Technology》上。
本文要点:
1、使用玻璃微流体交叉连接液滴发生器创建了尺寸和均匀性精确可控的载药聚乳酸-羟基乙酸共聚物(PLGA)微粒。
2、利用基于流体体积(VOF)方法的数值模拟研究注入微器件的两种不混溶流体的行为:含疏水性药物和PLGA的二氯甲烷(DCM)作为分散相,聚乙烯醇(PVA)水溶液作为连续相。
3、DCM萃取和蒸发导致液滴收缩,以进一步将单分散乳液转化为PLGA微粒,并给出了滴液体积变化的数值关系。
4、数值结果与实验一致,展示了微流控方法在设计制备微球方面的潜力,减少了重复实验的需要,并强调了液滴微流控方法在调节直径和单分散性方面的重要性。
5、研究结果表明,将多功能微流控方法与数值方法相结合,可以开发出更可靠和可重复的药物递送系统。
流体体积(VOF)法在研究液滴生成过程中的贡献包括:
1、VOF方法是一种Eulerian多相流模型,可以用于观察连续相和分散相之间的界面演化。这对于理解微滴生成过程非常重要。
2、通过VOF模拟,可以预测微滴生成的模式(如挤压模式、滴落模式和喷射模式),并确定影响微滴尺寸的关键参数,如毛细数和流速比。
3、数值模拟结果可以与实验数据进行对比验证,从而建立微滴尺寸与关键参数之间的定量关系,如幂律关系。这些关系式可以用于预测微滴的最终尺寸。
4、将VOF模拟与实验结果相结合,可以大大减少反复实验的需求,提高微粒制备的可靠性和可重复性。这对于开发新的药物递送系统具有极大的价值。
总之,VOF方法作为一种有效的数值模拟工具,在理解和预测微流控设备中微滴生成行为方面发挥了关键作用,为微粒制备提供了可靠的指导。
本研究中关于微粒尺寸和均匀性的主要发现如下:
1、使用微流控技术可以精确控制PLGA微粒的尺寸和均一性。通过调节连续相和分散相的流速比,可以在挤压和滴落两种流态下生成不同尺寸的微滴,进而得到尺寸可控的PLGA微粒。
2、数值模拟结果与实验数据吻合良好,可以准确预测微滴尺寸。本研究提出了描述微滴尺寸与流速比和毛细管数之间关系的相关性方程。
3、在挤压流态下,微滴尺寸主要受分散相流速的影响,而在滴落流态下,连续相毛细管数对微滴尺寸的影响更大。
4、通过数值模拟和实验相结合的方法,可以预测微滴在溶剂蒸发过程中的收缩情况,从而得到所需尺寸的PLGA微粒。
5、以阿片拮抗剂纳曲酮为模型药物,成功制备了平均粒径70-80μm、均一性良好的PLGA微粒。这与商品化的长效纳曲酮制剂Vivitrol的粒径相当。
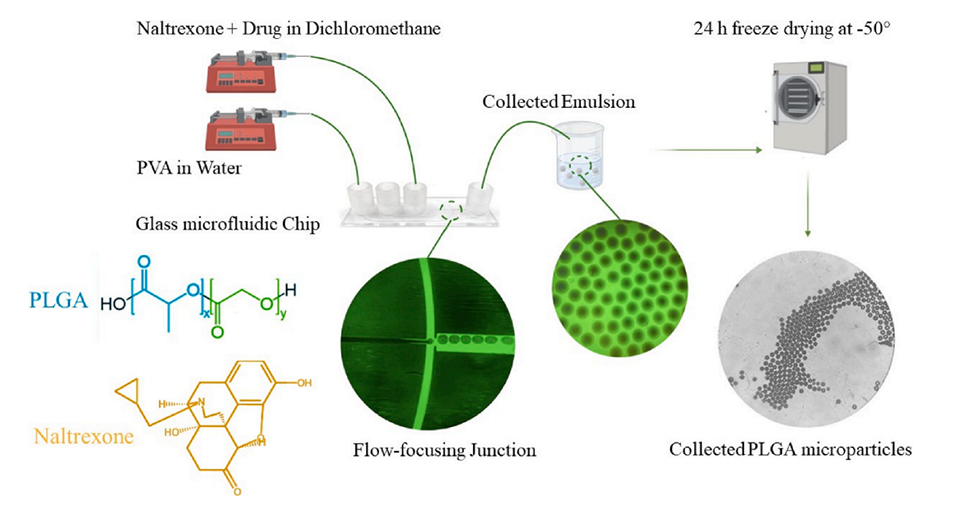
图1.该图描绘了使用玻璃微流体液滴发生器制备乳液后PLGA微粒的形成。
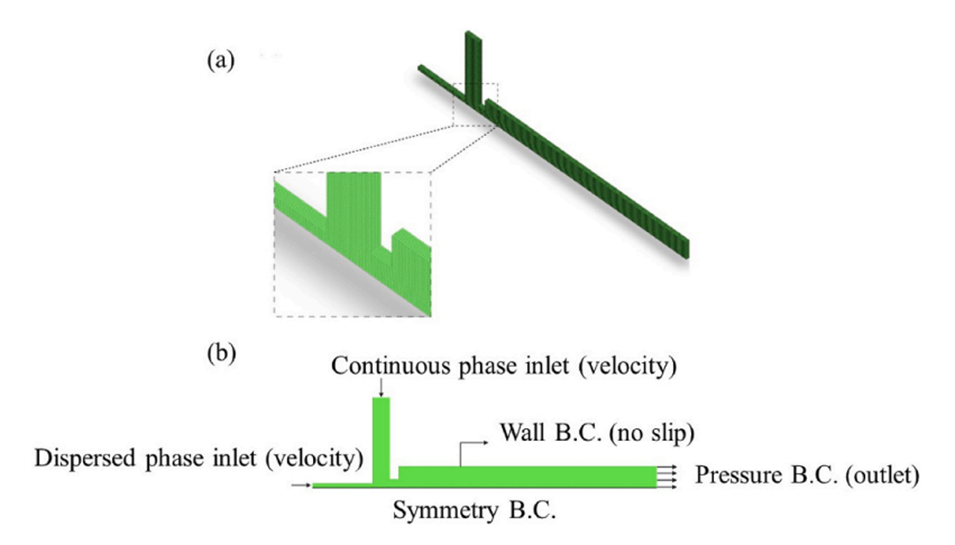
图2.(a)计算网格,(b)玻璃微流控芯片的边界条件示意图。

图3.流动聚焦微流体装置中水包油液滴演变的图像序列。
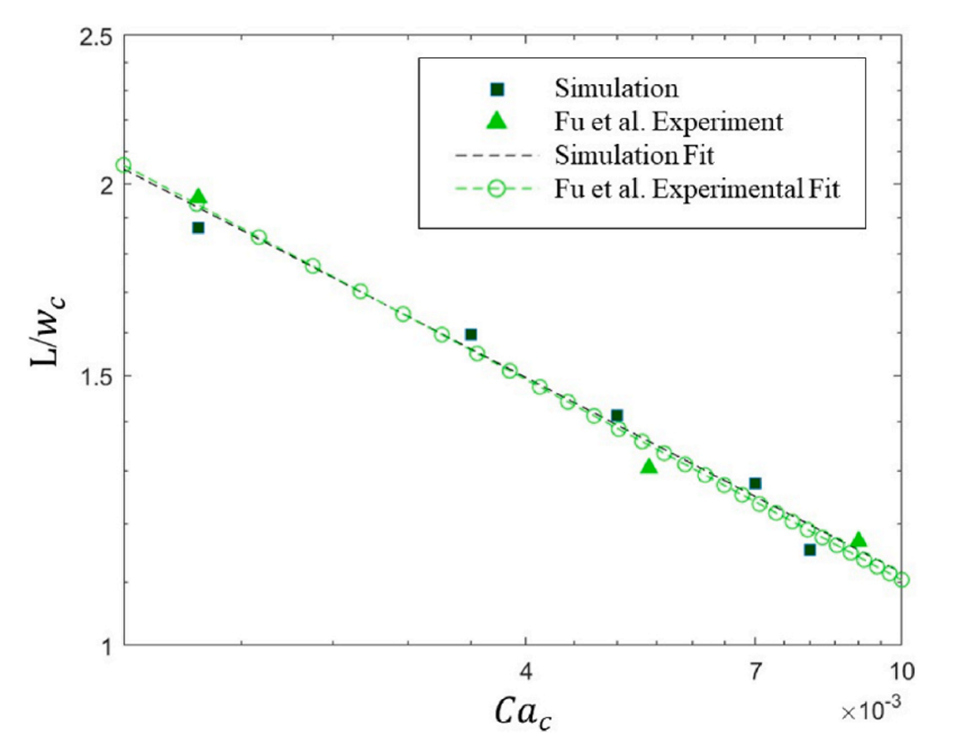
图4.在本文的数值模拟和Fu等人的研究中,无量纲液滴长度与Cac的函数关系。拟合线显示的一致性很高。
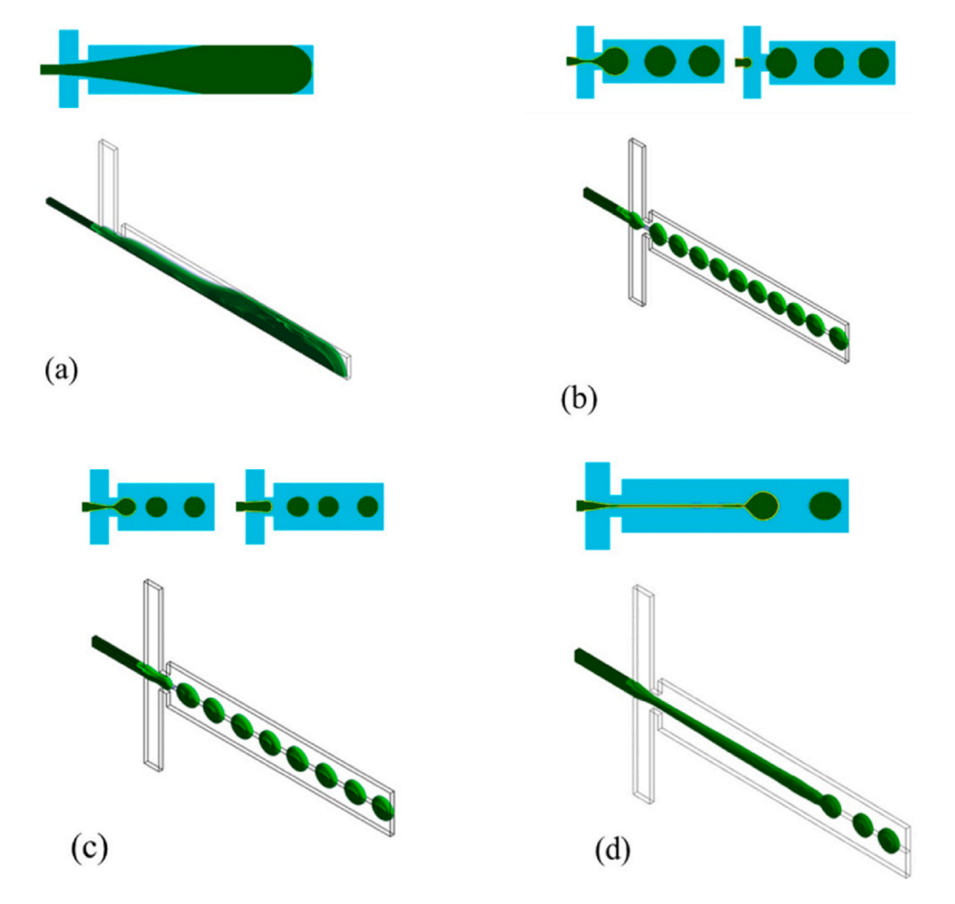
图5.玻璃微流体装置中典型的液滴形成流型。
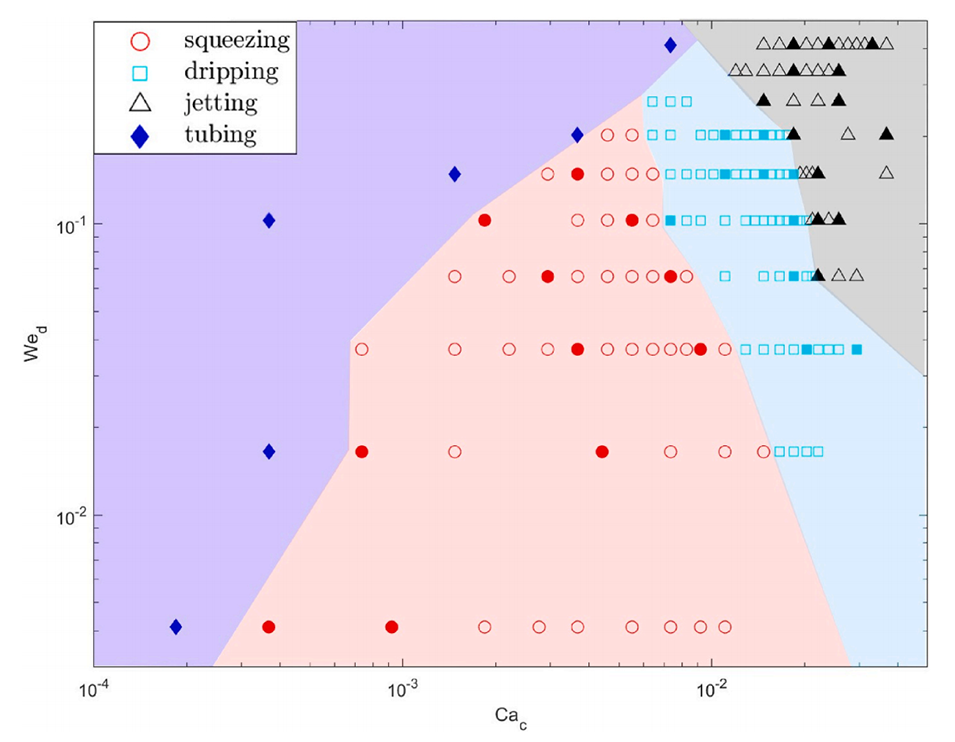
图6.连续相的毛细管数(Cac)和分散相的韦伯数(Wed)随液滴生成状态变化的相图。在数值和实验研究中,对粗体符号进行了观察。
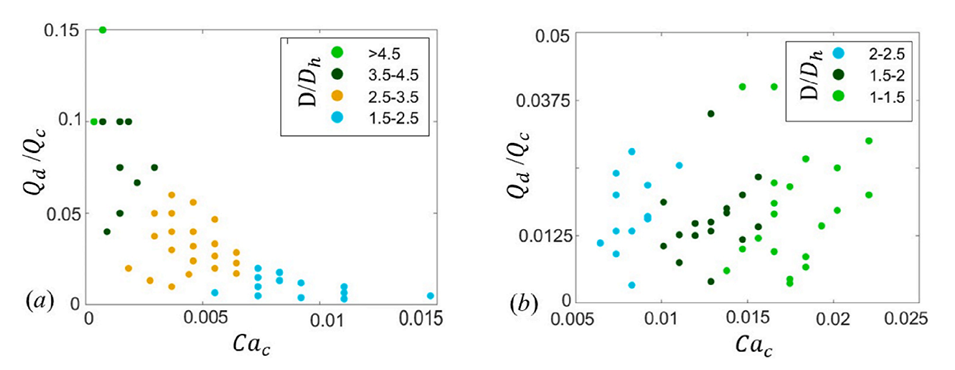
图7.在(a)挤压和(b)滴落状态下,无量纲液滴直径与连续相的流速比和毛细管数的函数关系。
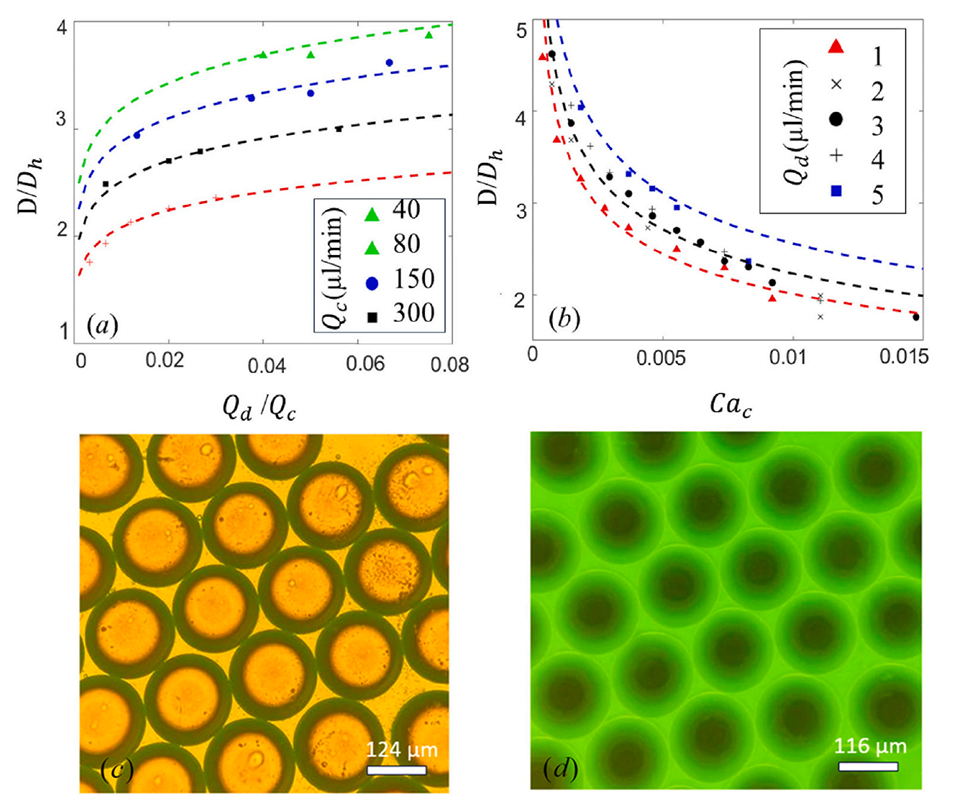
图8.挤压状态的液滴尺寸与(a)连续相的流速比和(b)毛细管数的关系。实验图像中显示了PLGA和纳曲酮各1%(w/w)的DCM乳液液滴在PVA溶液中以(c)Qd=1μL/min和Qc=200μL/min的流速在挤压状态下形成。(d)通过设置Qd=1μL/min和Qc=250μL/min形成的乳液的荧光显微镜图像。
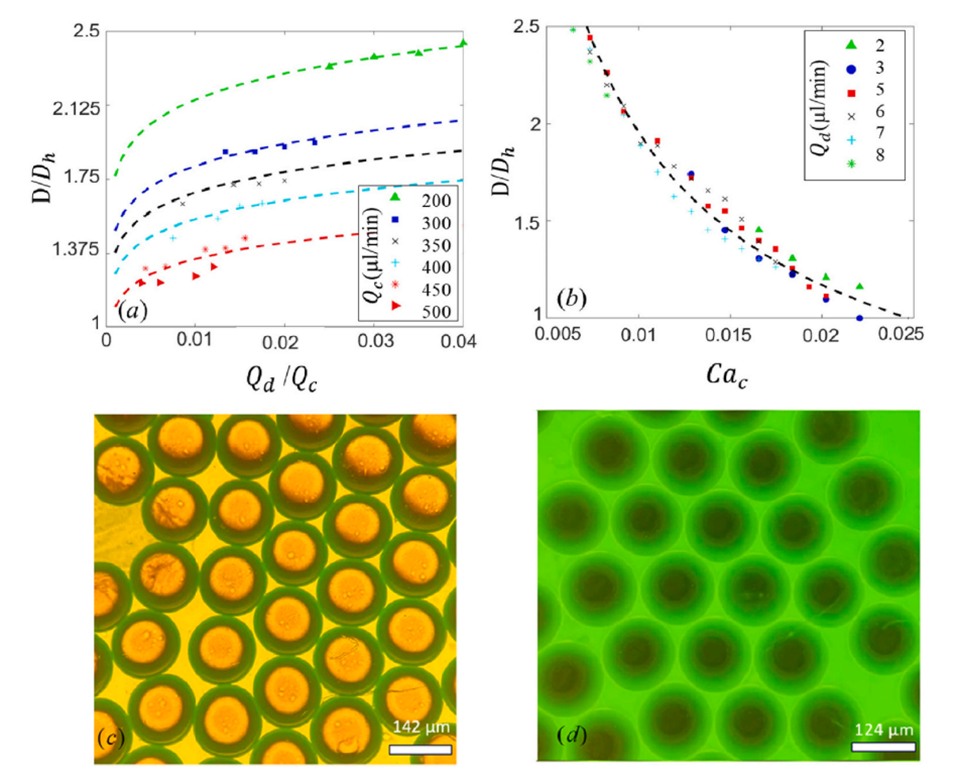
图9.滴落状态的液滴尺寸与(a)连续相的流速比和(b)毛细管数的关系。实验图像中显示了PLGA和纳曲酮各1%(w/w)的DCM乳液液滴在PVA溶液中以(c)Qd=6μL/min和Qc=300μL/min的流速在滴落状态下形成。(d)通过设置Qd=6μL/min和Qc=350μL/min形成的乳液的荧光显微镜图像。
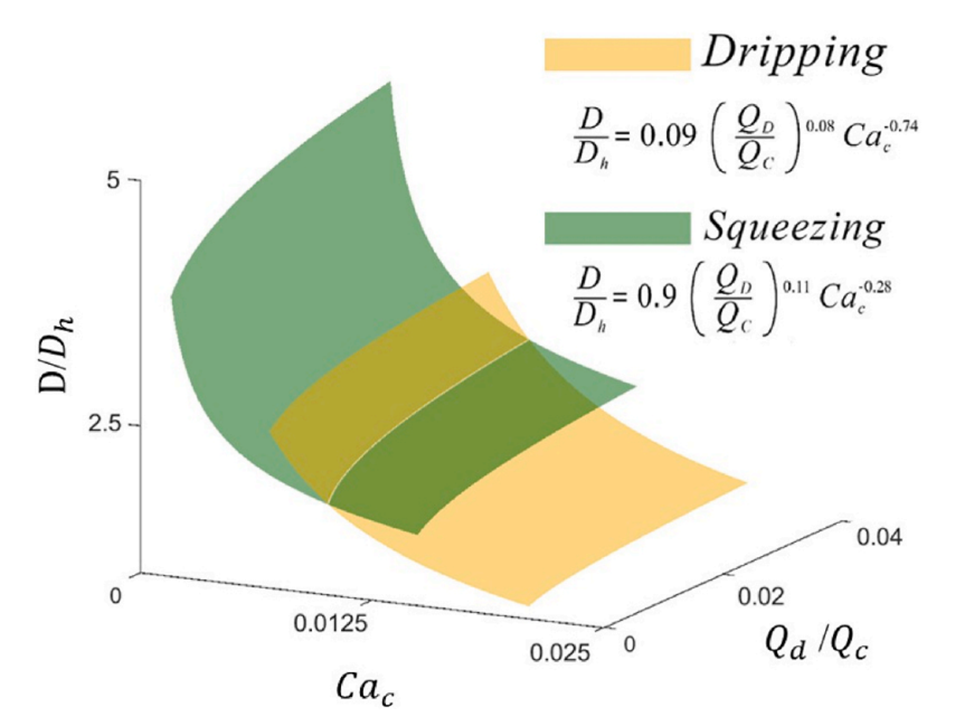
图10.连续相不同毛细管数下无量纲液滴直径与挤压和滴流状态下流速比的相关性。
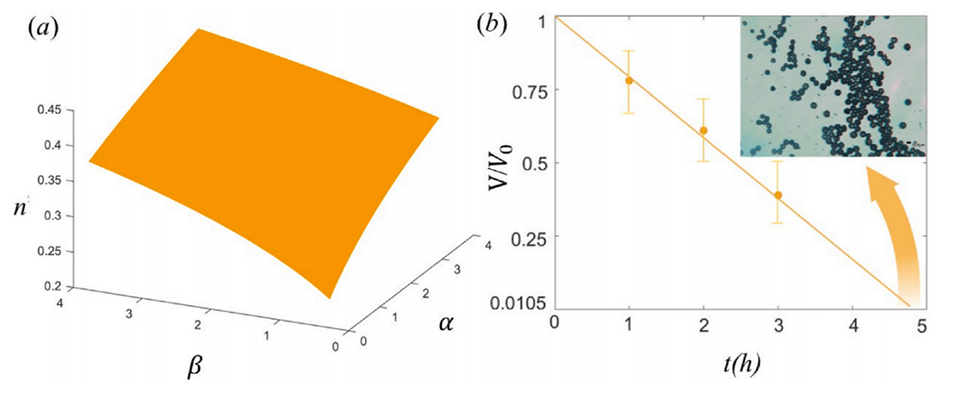
图11.(a)PLGA和药物浓度(α)和(β)对无量纲数n的影响。(b)收缩和硬化形成PLGA微球过程中液滴体积的变化(比例尺:200μm)。
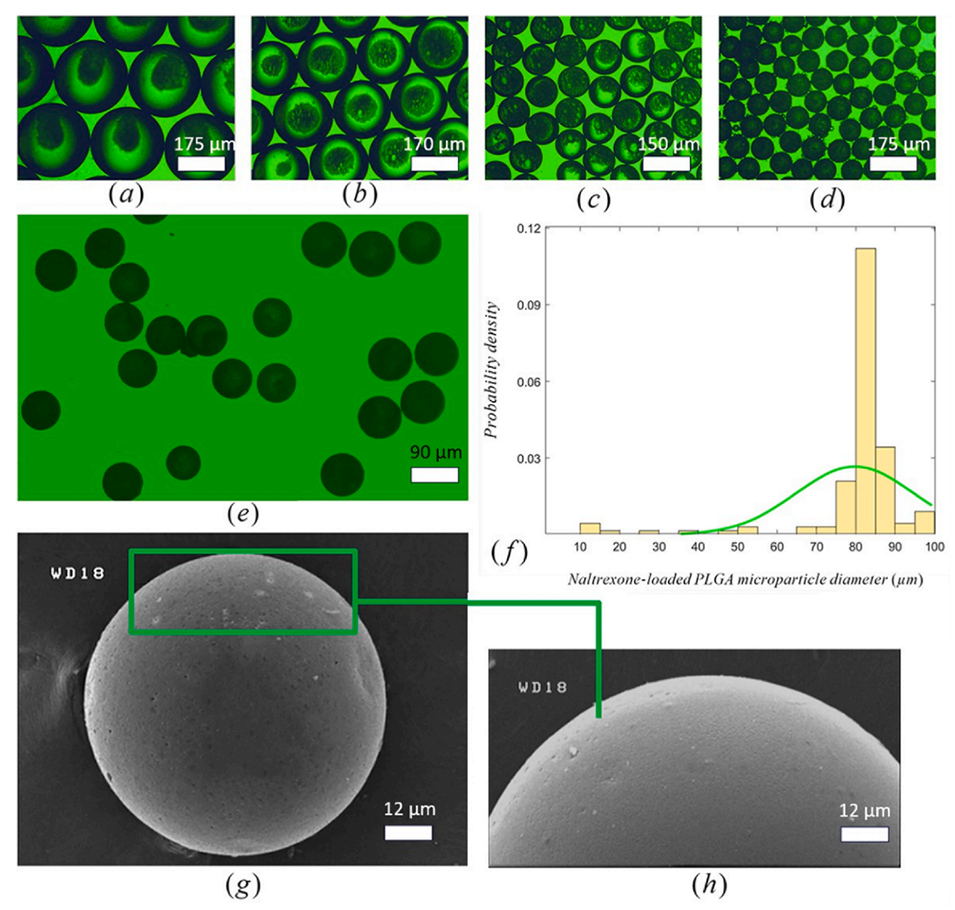
图12.由于DCM提取/蒸发导致液滴收缩和微粒形成的快照,(a)收集后负载纳曲酮的液滴,(b)收集后1小时的液滴;(c)收集后2小时的液滴;(d)收集后4小时的微粒;(e)用水冲洗以去除残留PVA后的微粒;(f)负载纳曲酮的微球尺寸分布(平均微球直径);(g,h)负载纳曲酮的微球的SEM图像。
论文链接:
https://doi.org/10.1016/j.jddst.2024.105776














