研究背景:
作为一种新兴的纳米技术,脂质体被认为是治疗各种疾病(如肿瘤、炎症和感染)的一种突破性策略。脂质体是由一个或多个磷脂双层壳和内部水相组成的封闭性囊泡,具有亲水性和疏水性的特点,能够同时包封水溶性和脂溶性分子。脂质体作为一种重要的纳米级药物递送系统,具有易制备、良好的生物相容性、生物降解性、低免疫原性和无毒性等优点。因此,脂质体不仅可以降低药物毒性、延长药物循环时间,还能实现靶向累积释放,在核酸治疗、CRISPR/Cas9疗法和免疫治疗中具有独特优势。
然而,脂质体的合理设计需要依赖于适当的配方和制备方法。目前报道的制备脂质体的方法存在一些局限性,如无法精确控制脂质体的粒径和多分散性、包封率较低,且不适合大规模生产,同时还存在能量密集的操作步骤。因此,开发更简洁高效的脂质体制备方法,并优先用于药物递送,具有重要意义。

导读:
近期,北京林业大学雷建都教授团队开发了一种新型微流控膜乳化装置,能够精确控制脂质体的尺寸和粒径分布,有效包裹水溶性和脂溶性药物,并对结直肠癌细胞显示出显著的抑制活性。相关研究以“Controlled production of liposomes with novel microfluidic membrane emulsification for application of entrapping hydrophilic and lipophilic drugs”为题目,发表在期刊《Journal of Industrial and Engineering Chemistry》上。
本文要点:
1、本研究创新性地设计并制造了一种新型微流控膜乳化装置,结合微流控和膜乳化原理,系统探究了处方因素和工艺参数对制备脂质体的影响。
2、通过调整处方因素和工艺参数,可以精确控制脂质体粒子尺寸,所得脂质体具有良好的稳定性。
3、本研究有效地将亲水性烟酰胺单核苷酸(NMN)和疏水性和厚朴酚(HNK)共同封装,实现了两种多靶点协同抗肿瘤药物的分级释放,其对结肠癌细胞的抑制活性明显高于游离药物。
4、此外,该技术还被拓展应用于药物递送微球平台的构建,实现了高粘度海藻酸钙微球的均匀可控制备,为高效构建药物递送系统平台提供了有价值的指导。
使用微流控膜乳化技术制备脂质体的主要优点包括:
1、精确控制脂质体尺寸和粒径分布:通过调整处方因素和工艺参数,如注射速度、搅拌速度、膜材料和孔径等,能够精确控制制备的脂质体的尺寸和多分散性。
2、高包封效率:该方法支持亲水性(NMN)和疏水性(HNK)药物在脂质体内的有效共包封,实现高包封率。
3、药物控释:共包封脂质体能够实现亲水性和疏水性药物的分级释放,有利于联合治疗。
4、可扩展性和可重复性:微流控膜乳化方法在脂质体制备中显示出良好的可重复性,与传统方法相比具有规模化生产的潜力。
5、多功能性:该技术还被拓展应用于药物递送微球的制备,展现了其在构建药物递送系统平台方面的广泛适用性。
将NMN和HNK共同包封于脂质体中可以提高其治疗效果,主要体现在以下几个方面:
1、提高细胞摄取:NMN@HNK@脂质体能够被HCT-116肿瘤细胞有效吸收,细胞摄取实验证实了这一点。
2、增强抗肿瘤活性:细胞毒性实验结果表明,与单独使用HNK相比,NMN@HNK@脂质体对HCT-116肿瘤细胞的抑制作用显著增强。
3、实现可控释放:脂质体能够实现NMN和HNK的分级释放,有利于联合治疗。NMN作为亲水性药物能够快速释放,而疏水性HNK则缓慢释放。
4、良好的生物相容性:NMN@HNK@脂质体表现出较低的溶血活性,具有良好的生物安全性。
综上所述,将NMN和HNK共同包封于脂质体中,能够提高其细胞摄取,增强抗肿瘤活性,实现可控释放,同时具有良好的生物相容性,从而显著改善了其治疗效果。这种联合给药的方式为肿瘤治疗提供了新的策略。
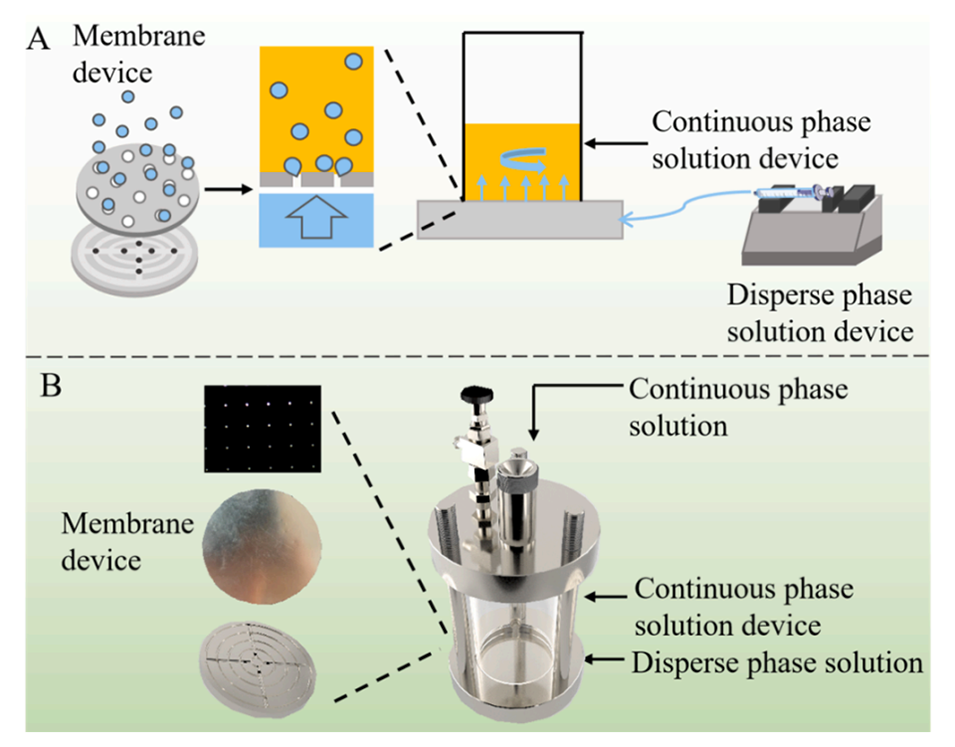
图1.新型微流控膜乳化装置示意图。
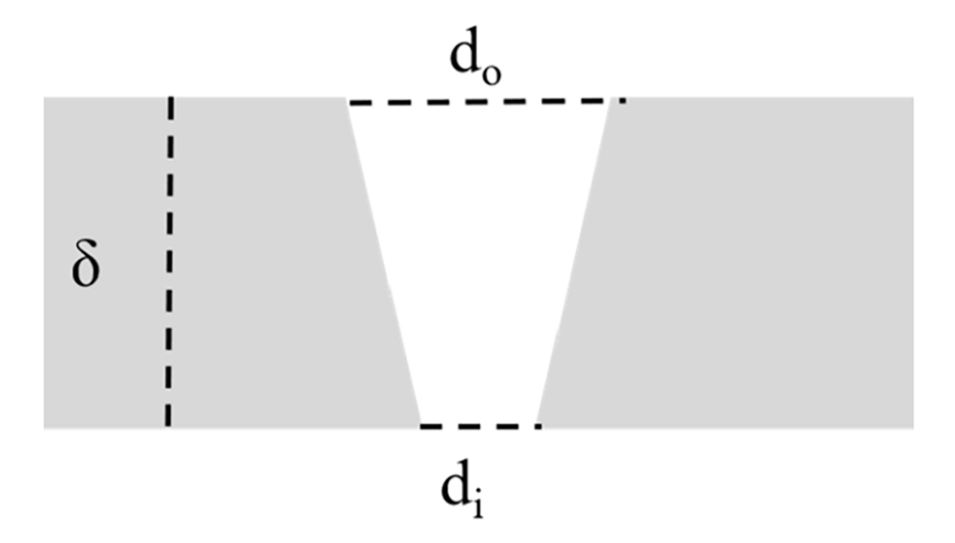
图2.膜孔锥度示意图。
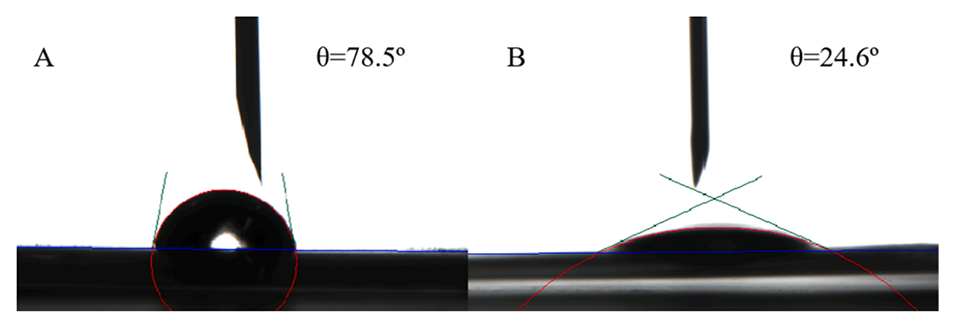
图3.A-B)分别为连续相和分散相与不锈钢膜表面的接触角。
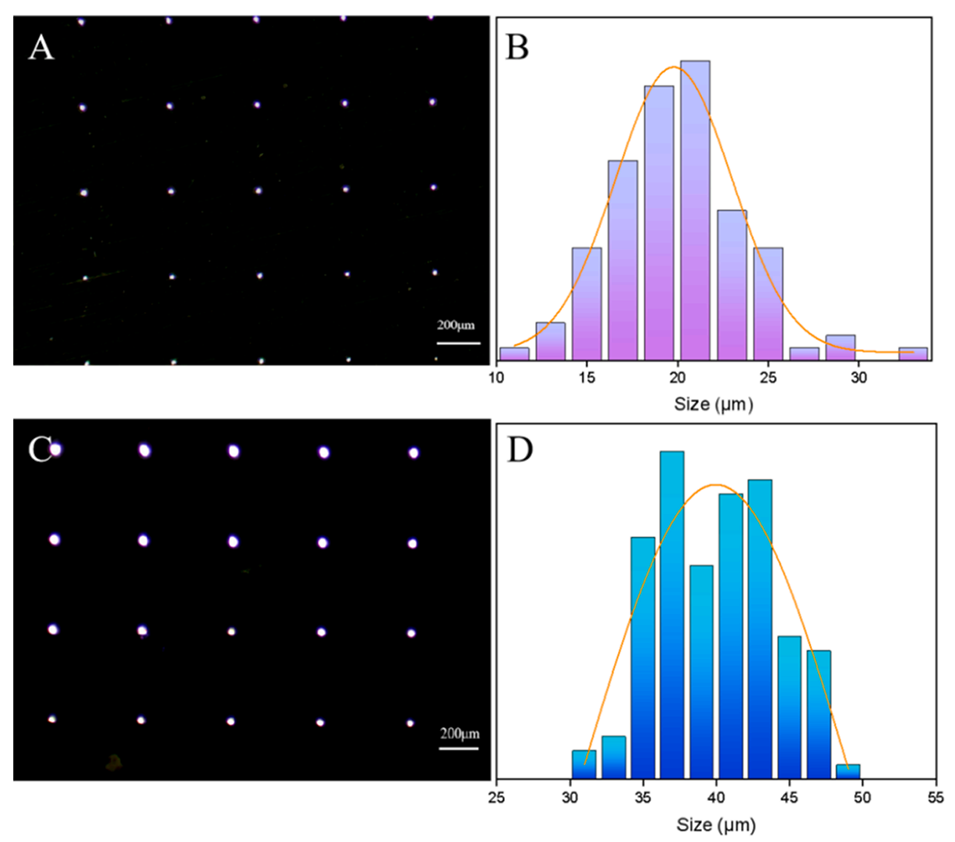
图4.A-B)膜1的显微照片和孔径分布;C-D)膜2的显微照片和孔径分布。
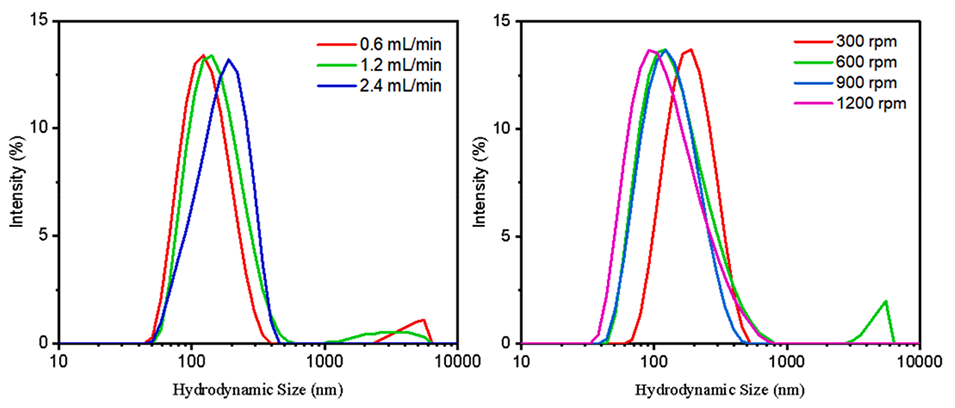
图5.注射和搅拌速度对LNP尺寸的影响。
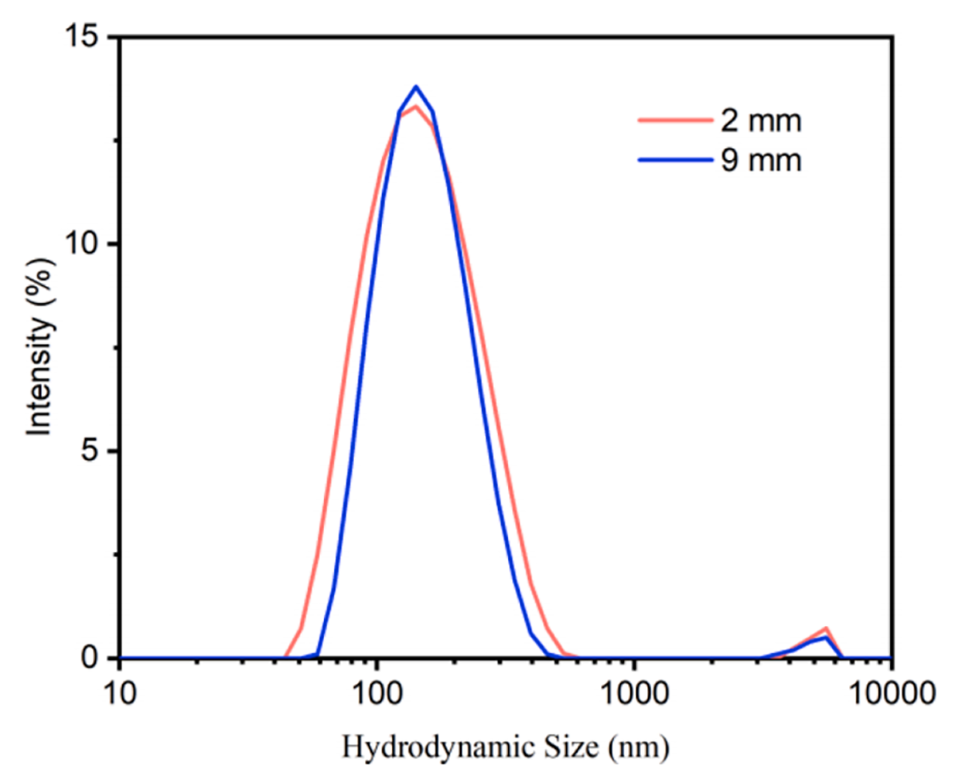
图6.搅拌装置和膜之间的距离对LNP尺寸的影响。
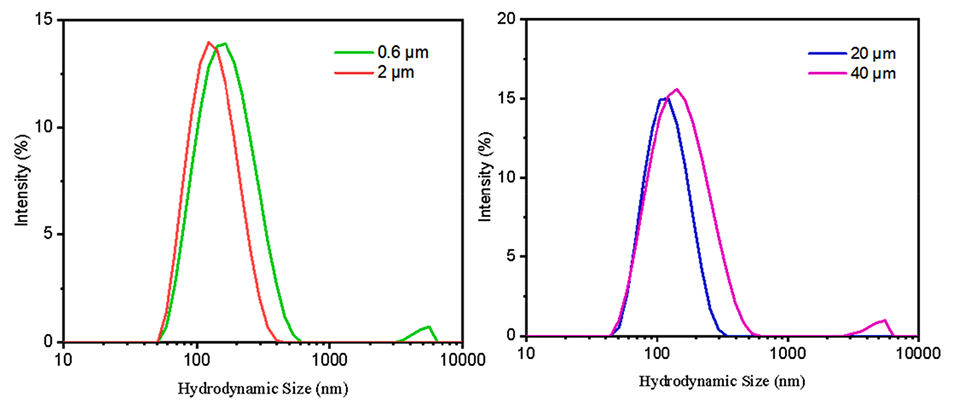
图7.膜材料和孔径对LNP尺寸的影响。
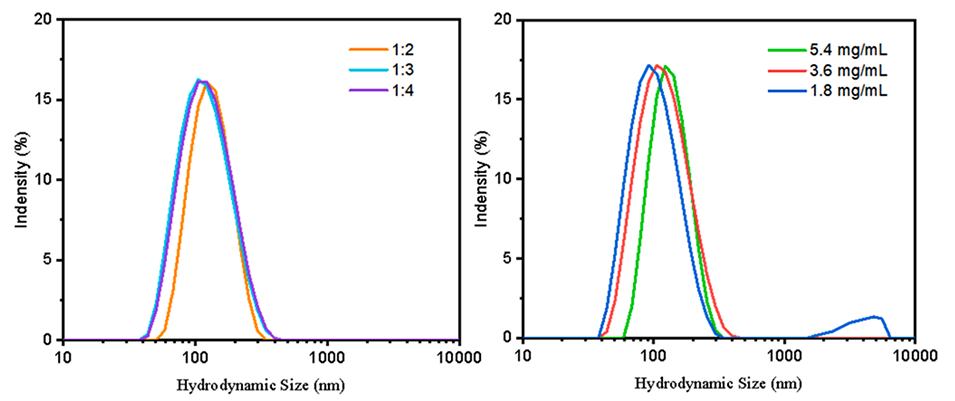
图8.有机相与水的比例和磷脂浓度对LNP尺寸的影响。
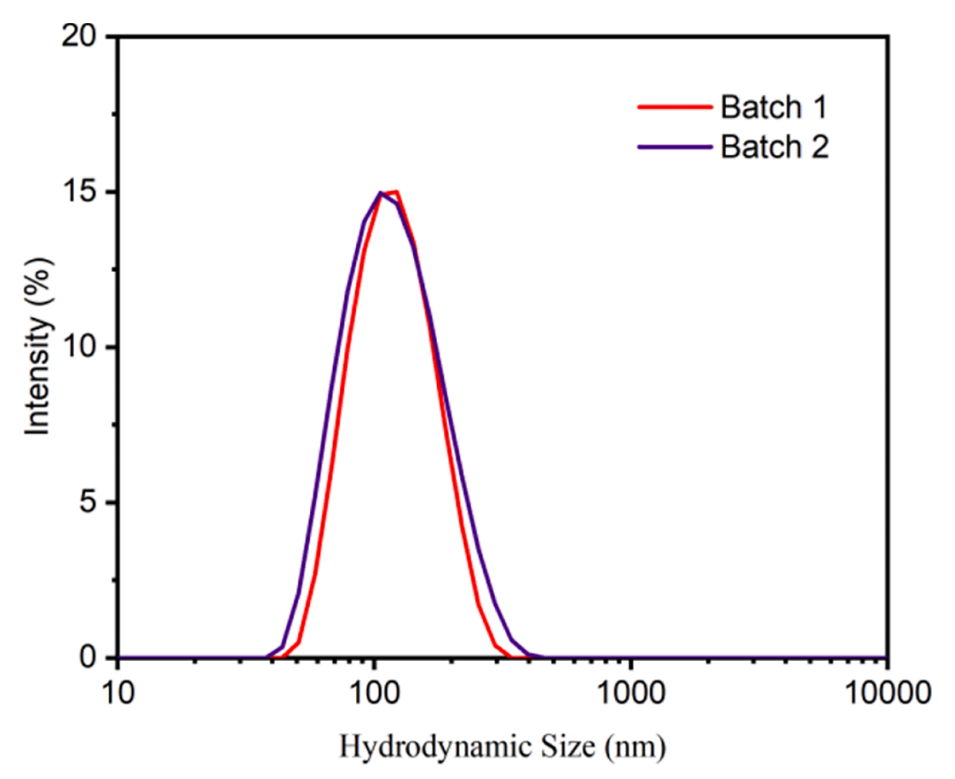
图9.在最佳条件下制备的脂质体的可重复粒度分布图。
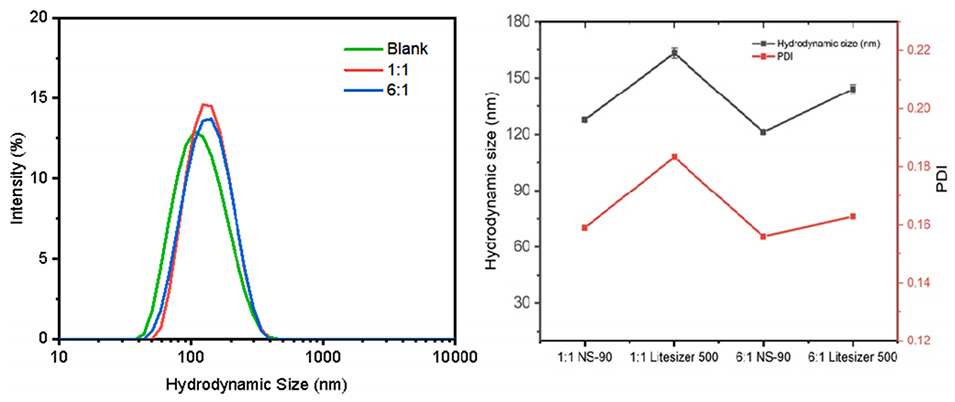
图10.不同氮磷比和不同仪器下NMN包封LNP的粒度分布。
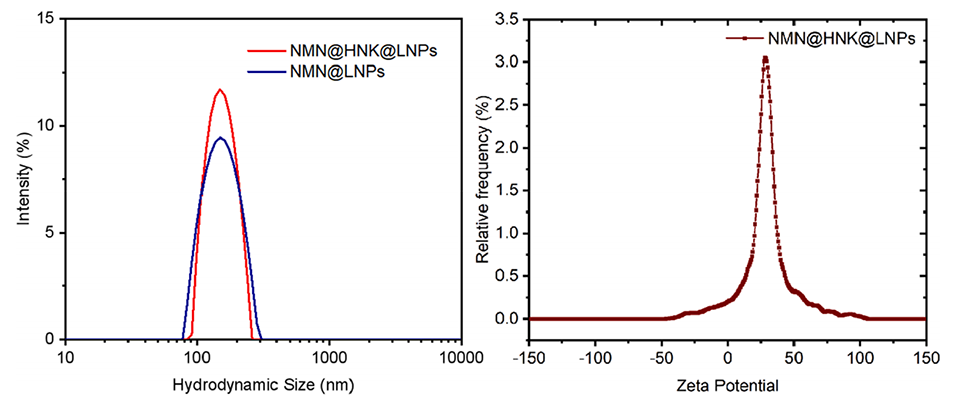
图11.NMN和HNK包封LNP的粒径分布和ζ电位。
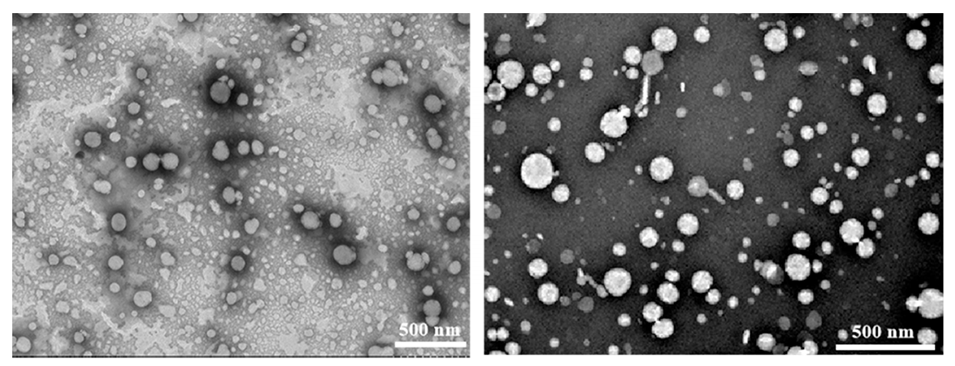
图12.NMN@LNPs和NMN@HNK@LNPs的TEM图像。
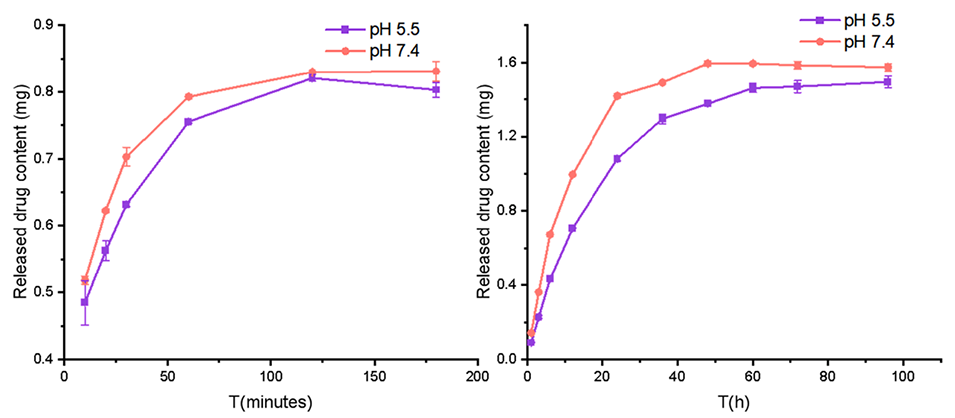
图13.NMN和HNK在不同pH环境中的体外释放。
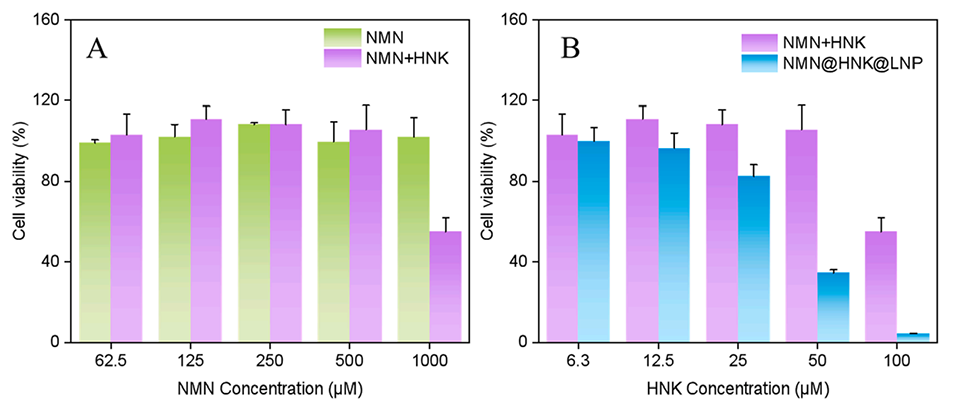
图14.CCK8测定NMN、HNK与NMN的共混物和NMN@HNK@LNP脂质体对HCT116细胞的作用。
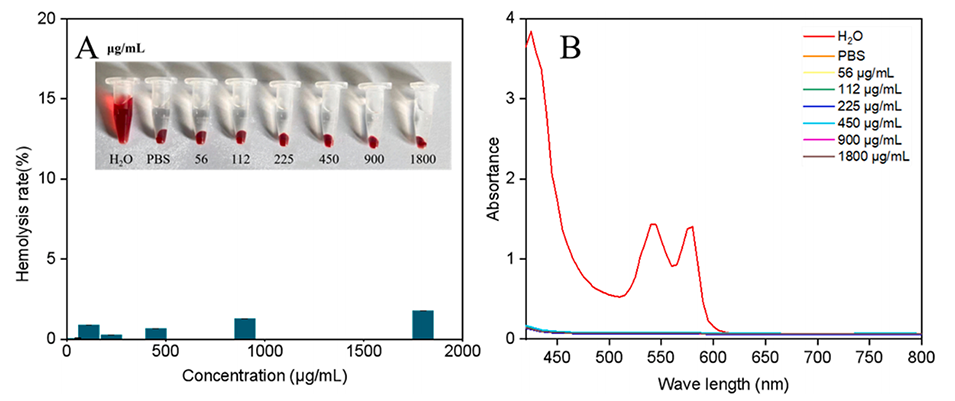
图15.不同NMN@HNK@LNPs浓度下的红细胞溶血分析。
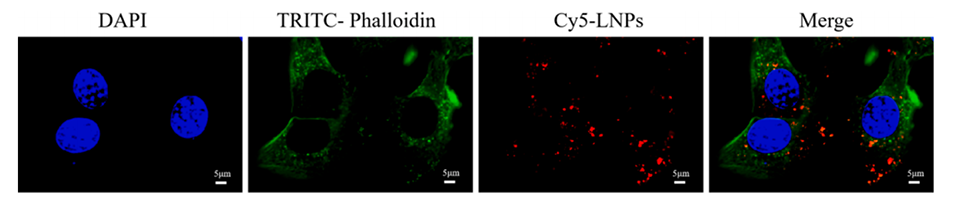
图16.经CY5标记NMN@HNK@LNPs(CY5-LNPs)处理后HCT-116细胞的CLSM图像。
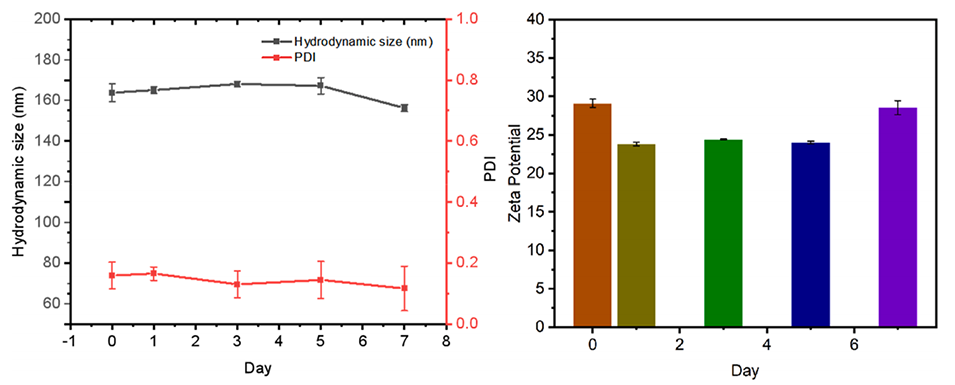
图17.制备的负载脂质体的稳定性。
论文链接:https://doi.org/10.1016/j.jiec.2023.10.051
下一篇:ccc














