高载药量聚合物微球因其能够减少赋形剂用量、降低副作用并增强治疗效果,在生物医学领域具有广阔的应用前景。尽管,药物-载体材料相容性等热力学因素被广泛认为是影响微球载药能力的重要因素,但这些因素无法充分解释在具有相似相互作用的聚合物和药物组合中观察到的载药量差异。

近期,华中科技大学李威博士团队通过液滴微流控平台研究了聚合物结晶性对药物负载能力的影响,发现非晶态聚合物能更好地抑制药物在固化过程中的扩散,从而实现更高的药物负载量。并以此原理设计出高药物负载的PCL-PLLA微球,在治疗痛风性关节炎中展现了优异的治疗效果。相关研究以“Polymeric Microspheres with High Mass Fraction of Therapeutics Enabled by the Manipulation of Kinetics Factor During Emulsion Droplet Solidification”为题目,发表在期刊《Advanced Functional Materials》上。
本文要点:
1、本研究通过操控乳液液滴固化过程中的动力学因素,开发了高药物负载的聚合物微球,显著提高了药物负载能力。
2、研究发现,与结晶性聚合物相比,非晶态聚合物在液滴固化过程中能更有效地阻碍药物扩散,从而提高药物负载量。
3、基于这一原理,通过随机共聚合(如PCL-PLLA),成功将结晶性聚合物的药物负载量提高了6.2–22.2倍。
4、以吲哚美辛为模型药物的PCL-PLLA微球在痛风性关节炎治疗中表现出优异的疗效。
5、本研究揭示了聚合物结晶性对液滴固化动力学及药物负载能力的影响,为高效药物包封聚合物的设计提供了新思路。
高药物负载聚合物微球在生物医学领域具有多项优势:
1、减少辅料使用:高药物负载量意味着在治疗中可以使用更少的辅料,从而降低了副作用和潜在的毒性。
2、提高治疗效果:通过增加药物浓度,能够更有效地治疗疾病,尤其是在局部给药时,如关节内注射。
3、延长药物释放时间:高药物负载微球能够实现药物的持续释放,延长药物在体内的作用时间,减少患者需要频繁用药的次数。
4、改善患者依从性:由于减少了给药频率,患者的依从性得以提高,降低了因忘记用药而导致的治疗失败风险。
5、优化治疗方案:在需要高剂量药物的情况下,如急性痛风性关节炎,高药物负载微球能够在有限的注射体积内提供足够的药物浓度,从而提高治疗效果。
综上所述,高药物负载聚合物微球在提高药物生物利用度、降低副作用及改善患者体验等方面具有显著优势。
聚合物的结晶性对药物负载过程的影响主要体现在以下几个方面:
药物扩散的限制:结晶聚合物在固化过程中会形成紧密的晶体结构,这限制了药物分子在聚合物基质中的扩散。相比之下,非晶态聚合物由于缺乏这种紧密的结构,能够更好地容纳药物分子,从而提高药物的负载能力。
固化过程的动力学:在固化过程中,结晶聚合物的收缩时间较短(约10-20分钟),而非晶态聚合物的收缩时间则较长(约40-60分钟)。这种差异意味着在结晶聚合物中,药物分子更容易在固化过程中逸出,从而导致药物负载量降低。
药物浓度梯度:结晶聚合物的存在会导致药物在液滴内的浓度梯度增加,药物分子更容易从液滴中扩散到外部环境中。这种现象进一步降低了药物的负载效率。
聚合物的改性:通过随机共聚合的方法,可以合成非晶态的聚合物(如聚己内酯-聚乳酸共聚物),这种聚合物在药物负载能力上显著优于其结晶态的同类聚合物(如聚己内酯和聚乳酸)。研究表明,非晶态聚合物的药物负载能力可以提高6.2到22.2倍。
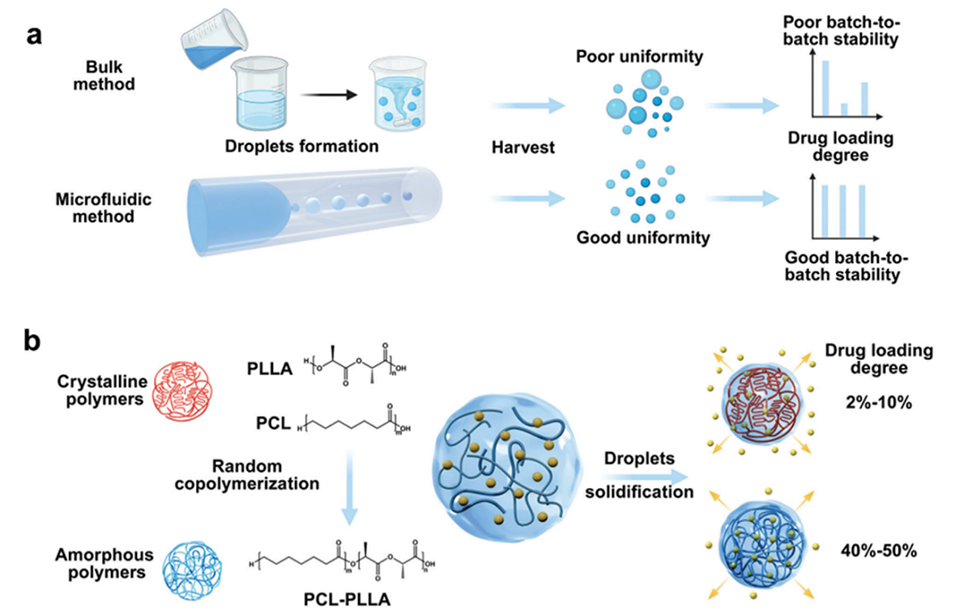
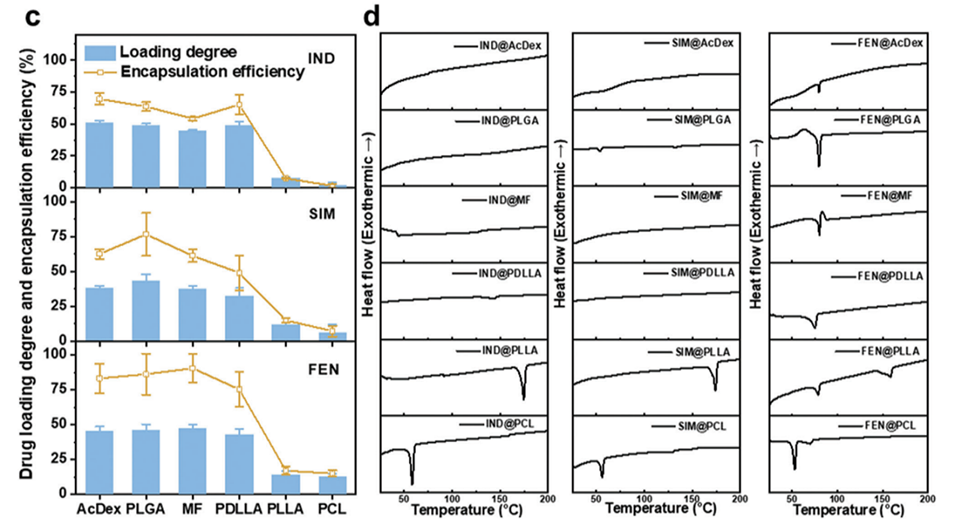
图1.微流控乳液法制备载药聚合物微球。
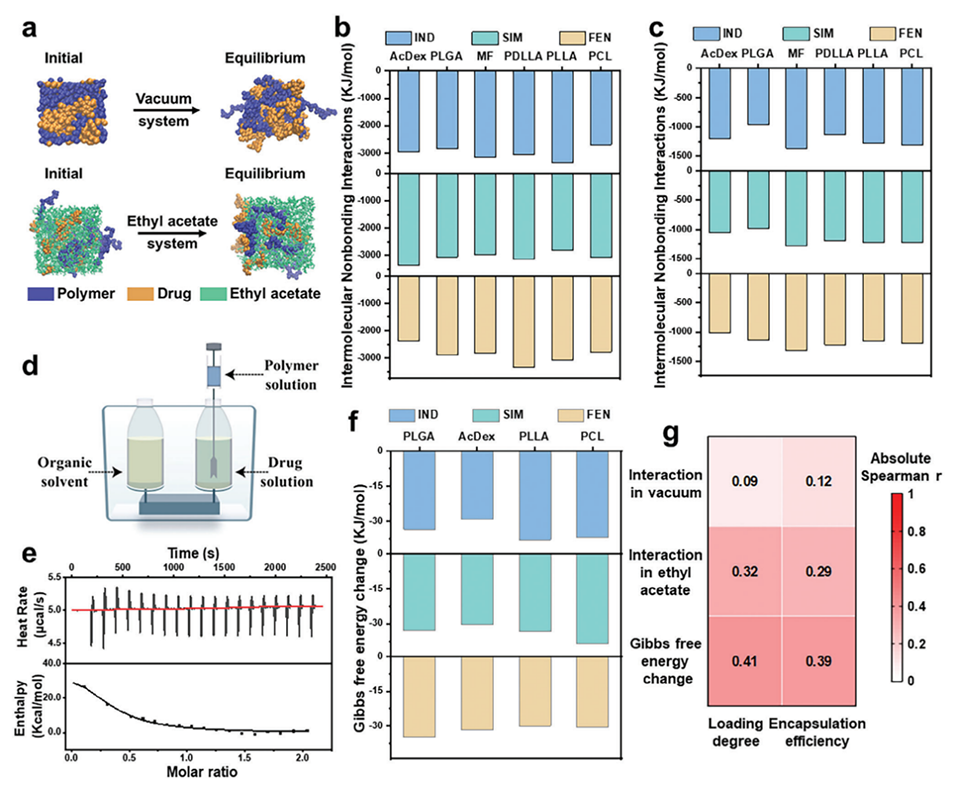
图2.药物和聚合物之间的热力学相互作用。
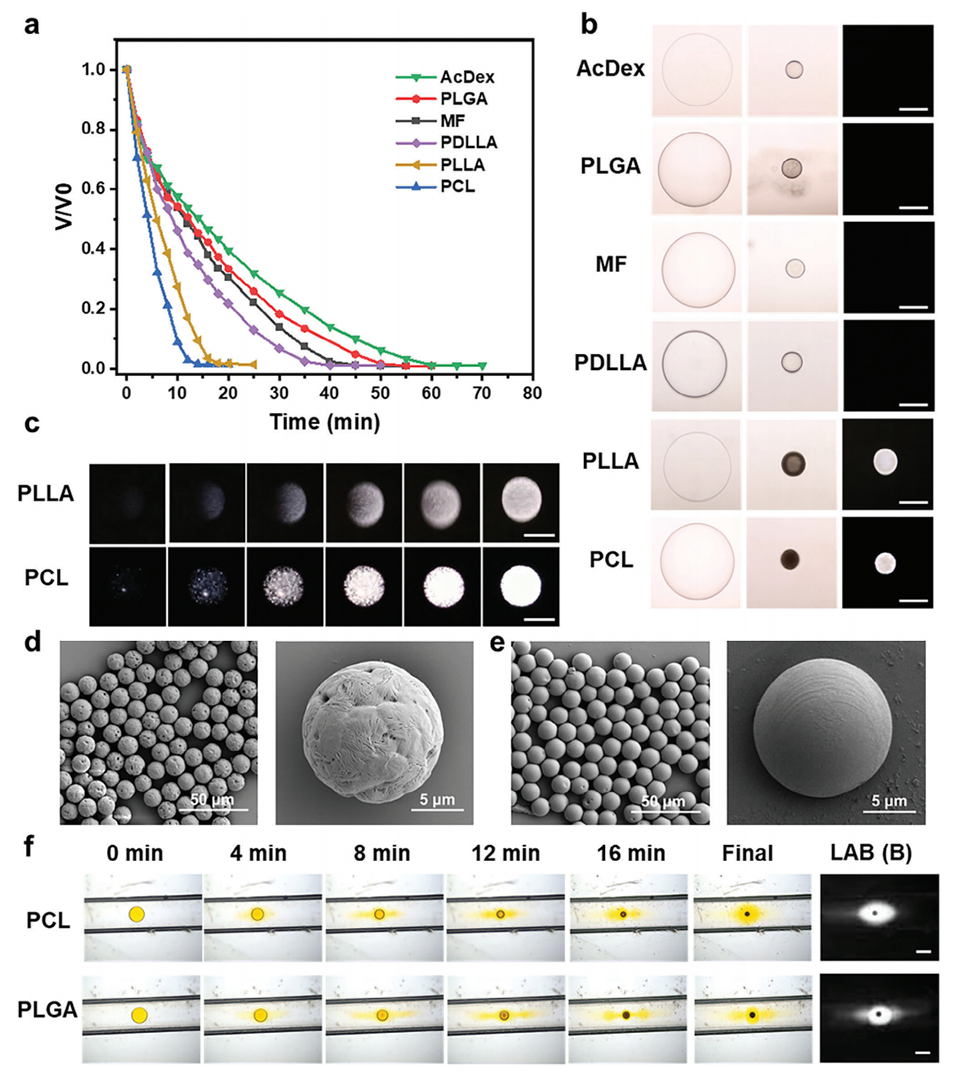
图3.聚合物微球的液滴固化过程。
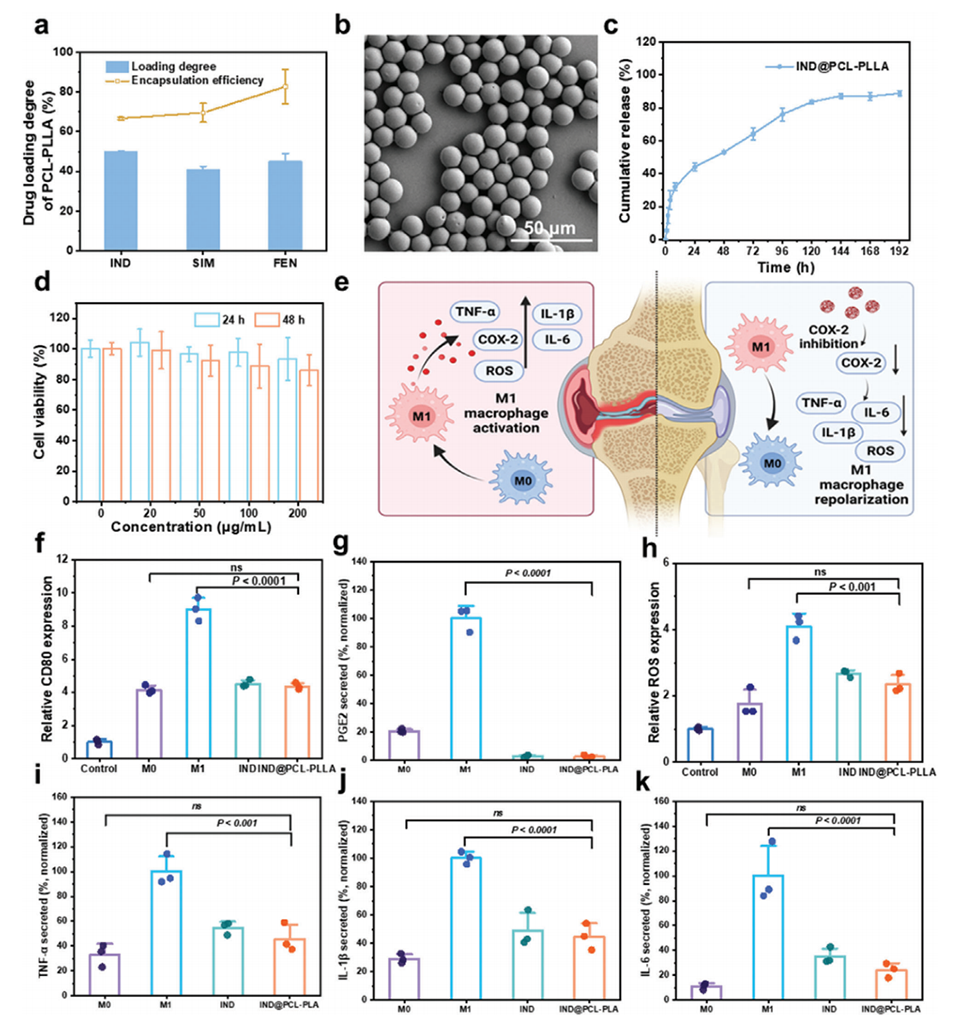
图4.IND@PCL-PLLA微球对脂多糖刺激骨髓源性巨噬细胞的炎症抑制作用。
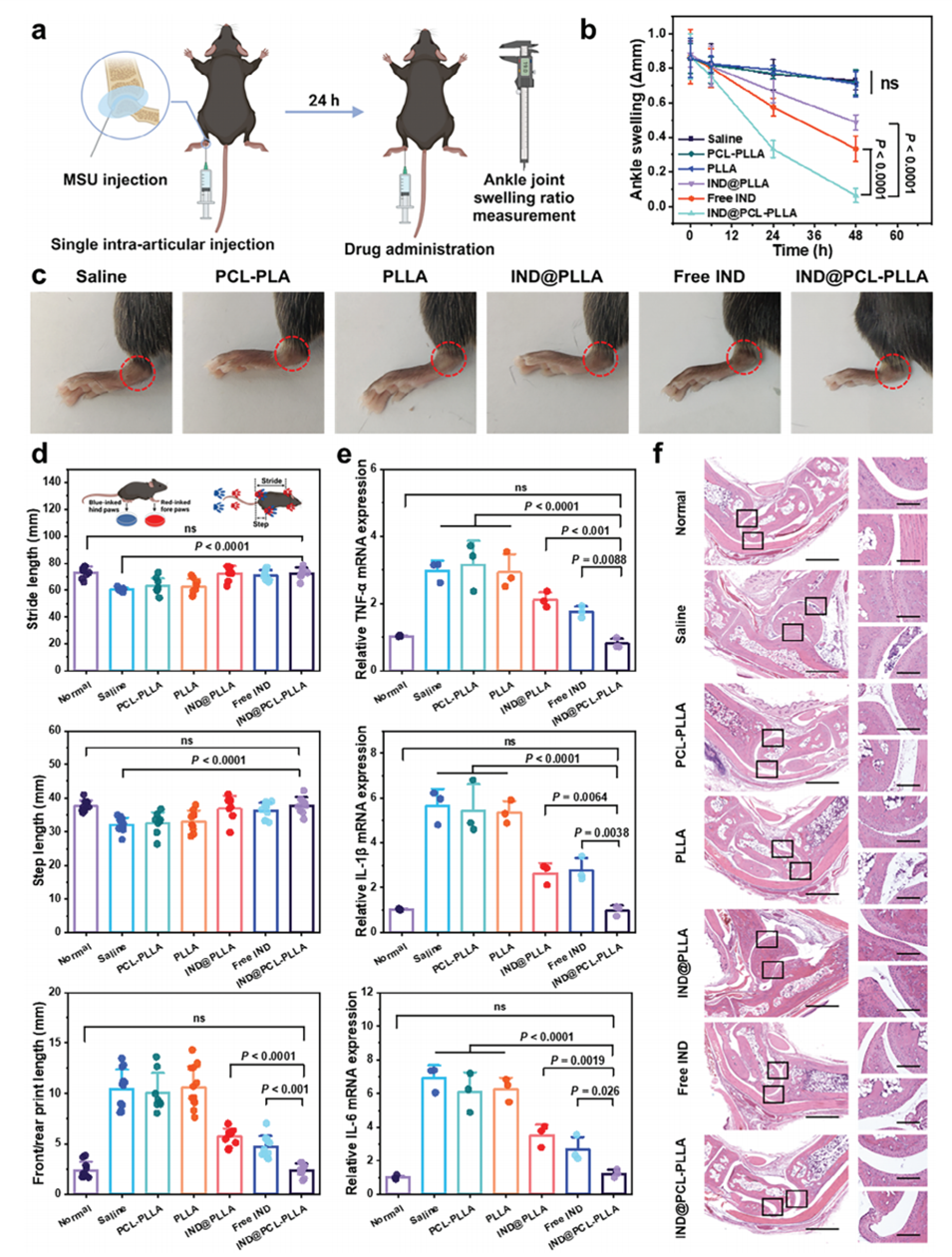
图5.局部递送IND@PCL-PLLA微球在痛风性关节炎小鼠模型中显示出治疗效果。
论文链接:https://doi.org/10.1002/adfm.202417307














