小干扰RNA(siRNA)作为一种新型基因治疗工具,可通过沉默特定基因来治疗多种疾病。然而,siRNA在体内易被快速清除(如通过肝脏积累),通常需要频繁注射以维持治疗效果,这不仅增加了患者的不适,还可能带来安全风险。尽管纳米颗粒载体和化学修饰(如FDA批准的ONPATTRO和Leqvio等药物)已显著延长了siRNA的体内稳定性和疗效,但仍存在急性毒性、暴露峰值高等问题。

为解决这些局限,有研究人员提出了一种基于PLGA微胶囊的新型递送策略,通过缓慢释放化学修饰的siRNA,实现单次注射即可维持长效基因沉默的目标。相关研究以“Syringable Microcapsules for Sustained, Localized, and Controllable siRNA Delivery”为题目发表于期刊《ACS Applied Materials & Interfaces》。
本文要点:
1、本研究提出了一种基于微胶囊的新方法,用于延长小干扰RNA(siRNA)的局部活性。
2、通过微流控技术,使用FDA批准的可生物降解聚乳酸-羟基乙酸共聚物(PLGA)制备了具有均一尺寸分布和壳厚的微胶囊,具有近100%的药物包封效率和高载药量(8900 μg siRNA/1 mg聚合物)。
3、平均直径为40 μm的微胶囊表现出优异的注射性能,可通过27至32 G的针头注射。
4、体外释放测试显示两种配方可持续释放3个月,随后在小鼠皮下注射实验中验证了其体内释放效果。
5、结果表明,微胶囊有效保护siRNA免受降解,实现了长达3个月的持续释放,相较于未包封的siRNA显著延长了药效。该方法为siRNA的可控、局部和长效递送提供了新思路。
通过微流控技术制备微胶囊的具体步骤如下:
1、微流控芯片的制备:
使用AutoCAD设计微流控芯片的图案,并将其打印在光刻掩膜上。通过光刻技术将图案转移到涂有SU-8光刻胶的硅片上,经紫外光曝光后,硅片依次在65°C和95°C下烘烤,未交联的SU-8通过PEGMA溶剂洗去,直至通道清晰可见。
将聚二甲基硅氧烷(PDMS)与固化剂按10:1的重量比混合,充分除气后倒入带有图案的硅片模具中。将模具放置在150°C下加热30分钟,使PDMS固化后剥离形成PDMS层。
使用2 mm直径的打孔器在PDMS层上制作进出口孔。随后,对PDMS层和玻璃载片进行氧等离子处理(30 W,20秒)以活化表面,将PDMS层粘附到清洁的玻璃载片上,并在150°C热板上加热5分钟以确保牢固粘合,最终形成完整的微流控芯片。
2、表面处理:
对微流控设备进行氧等离子体处理(100 W,1分钟),向亲水段注入10%(w/v)聚乙烯醇(PVA)溶液,同时用气流阻挡疏水段。
用真空吸出多余的PVA溶液,并在150°C下烘烤30分钟,使PVA与PDMS形成共价键。
3、微胶囊生成与表征:
在微流控设备中生成水包油包水(W/O/W)双乳液。内水相:1%(w/v)PVA溶液,含10 mg/mL胆固醇修饰的siRNA或1 mg/mL的10 kDa FITC-葡聚糖。中间油相:2-8%(w/v)PLGA溶解于二甲基碳酸酯(DMC)中。外水相:3%(w/v)PVA溶液。
使用倒置显微镜(10×物镜)和高速摄像机监控双乳液的形成,调整流速直至双乳液生成稳定。
将生成的双乳液直接收集到含有1 mL 3% PVA的玻璃瓶中,静置以使聚合物固化,形成微胶囊。
通过共聚焦激光扫描显微镜(CLSM)观察微胶囊的形态,使用ImageJ软件测量微胶囊的尺寸和壳层厚度。
4、微胶囊的注射性测试:将微胶囊悬液装入不同规格的注射器中(27-32 G),通过注射测试其可注射性,并在注射后观察微胶囊的形态变化和回收率。
5、冻干和重构测试:将标记的siRNA与未标记的siRNA混合,制备微胶囊后进行冻干,观察冻干对微胶囊的影响。
6、体外释放测试:将微胶囊转移到含有1×PBS缓冲液的瓶中,定期收集上清液,使用RiboGreen RNA测定法测量释放的siRNA的量。
使用微胶囊递送小干扰RNA(siRNA)具有以下优势:
1、延长药效持续时间:微胶囊能够实现siRNA的缓慢释放,单次注射即可维持长达3个月的药效,避免了频繁注射的需求。
2、保护siRNA稳定性:微胶囊有效防止siRNA在体内被快速降解或清除,提高其稳定性和治疗效果。
3、高封装效率与载药量:通过微流控技术制备的微胶囊具有接近100%的药物封装效率和高载药量(8900 μg siRNA/1 mg聚合物),显著提升递送效率。
4、良好的注射性能:平均直径为40 μm的微胶囊可通过27至32 G的针头注射,适用于多种注射途径(如皮下、肌肉、脑室内等)。
5、可控释放:微胶囊的壳厚和组成可调,能够实现siRNA的可控释放,优化药物的药代动力学特性。
6、生物相容性和安全性:采用FDA批准的可生物降解材料PLGA制备,减少了急性毒性和暴露峰值高的问题,提高了安全性。
综上,微胶囊递送系统为siRNA的局部、长效和可控释放提供了高效、安全的解决方案。
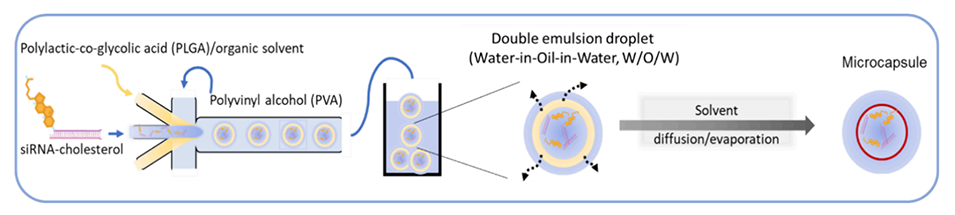
图1.在基于PDMS的微流体设备中,使用水包油包水(W/O/W)双乳液作为模板制备PLGA微胶囊的工艺示意图。
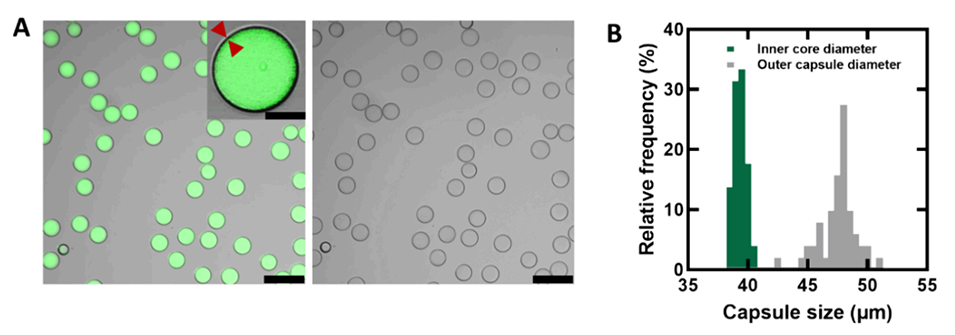
图2.(A)使用CLSM成像的含有10kDa FITC葡聚糖染料的PLGA微胶囊的荧光(绿色,左)和亮场(灰色,右)图像;比例尺,100μm。插图:单个微胶囊的放大图像,红色箭头表示胶囊的外壳;比例尺,20μm。(B)微胶囊直径和内核直径分布的直方图。
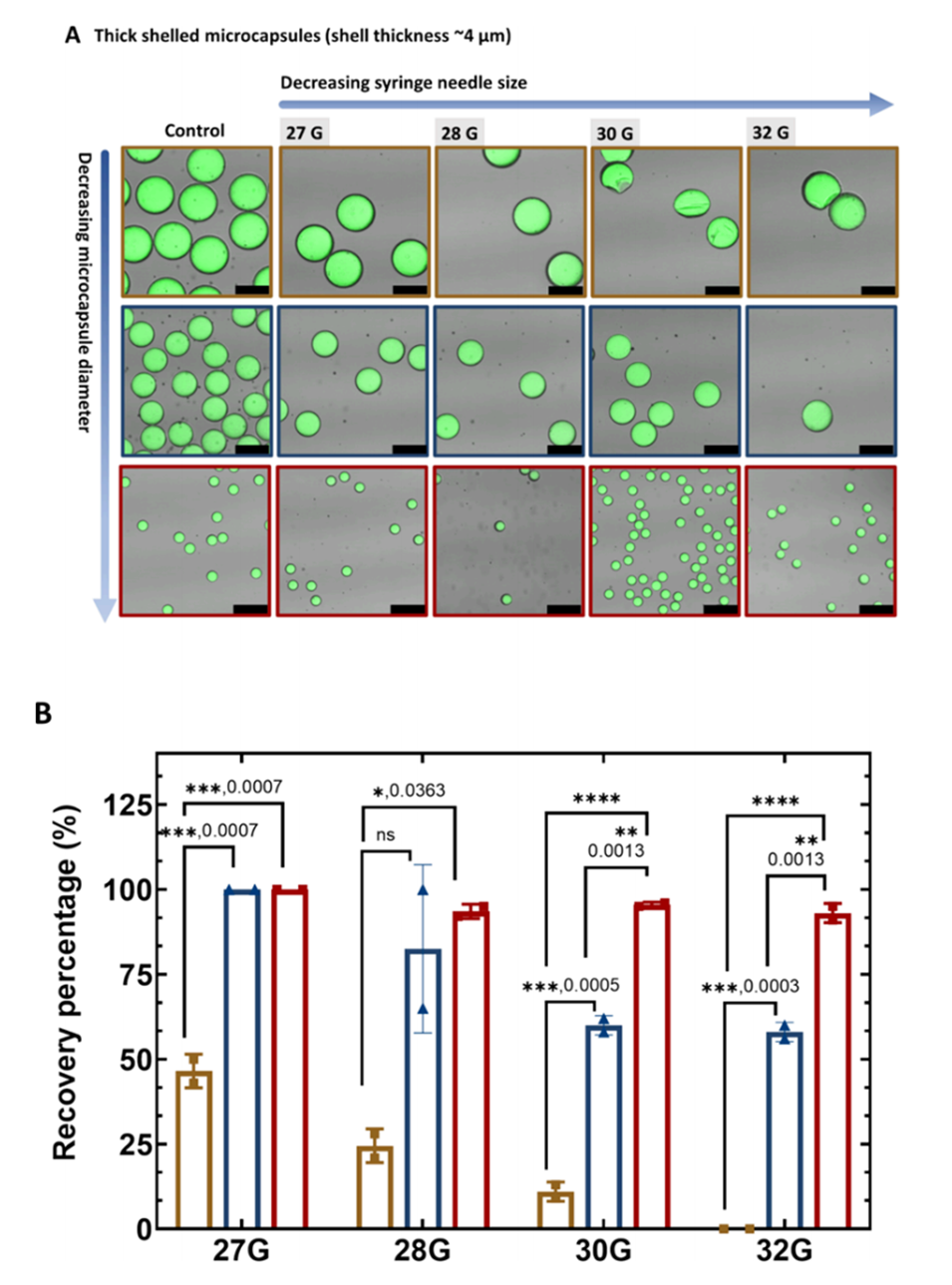
图3.不同尺寸和壳厚的厚壳微胶囊的可注射性。
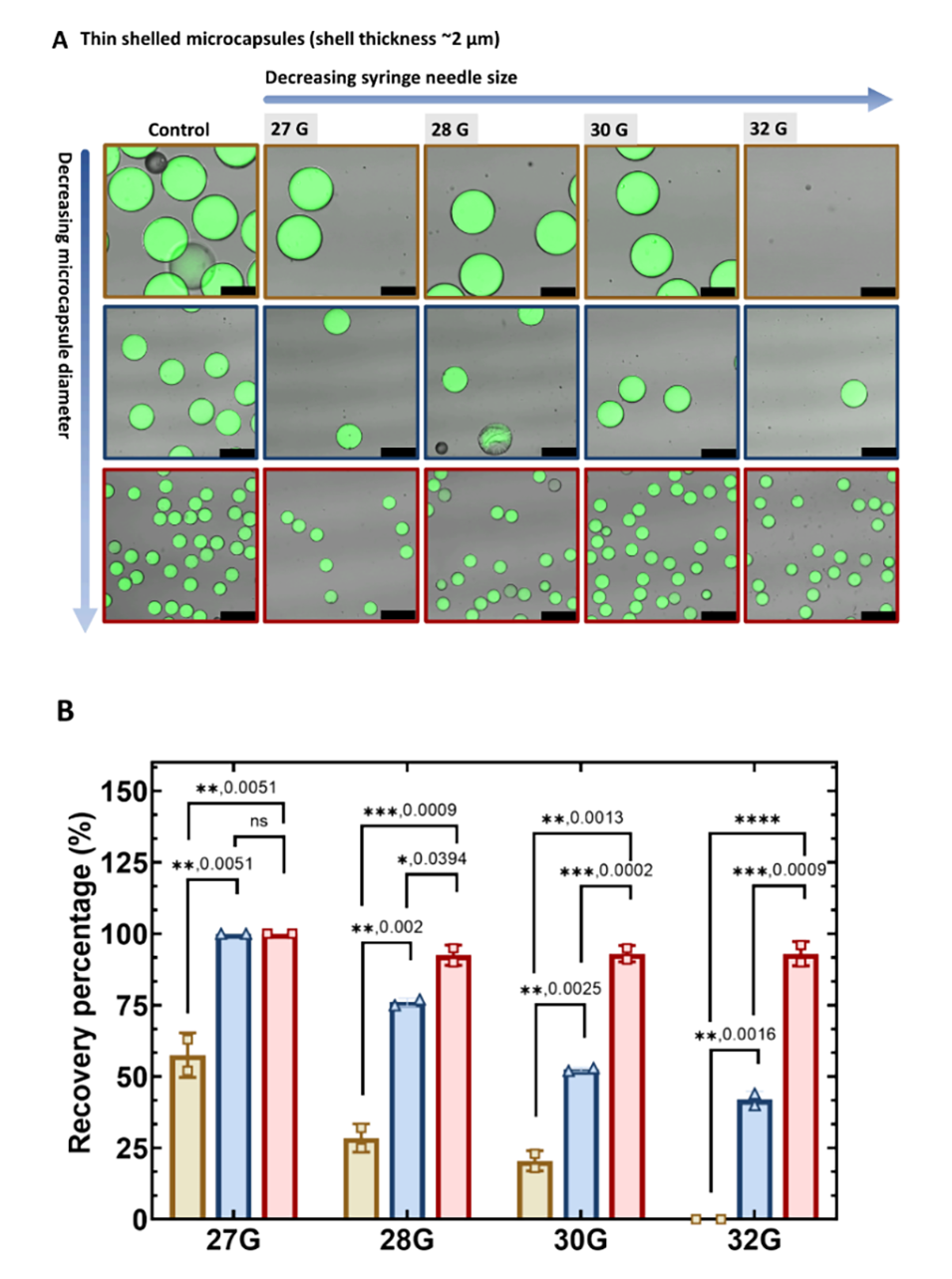
图4.不同尺寸和壳厚的薄壳微胶囊的可注射性。
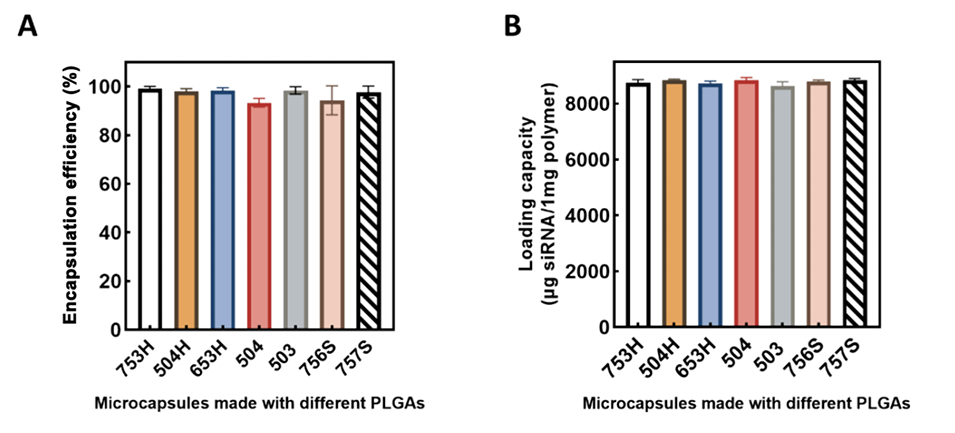
图5.用不同PLGA制成的微胶囊的siRNA包封效率(A)和载量(B)。数据显示为平均值±标准差。
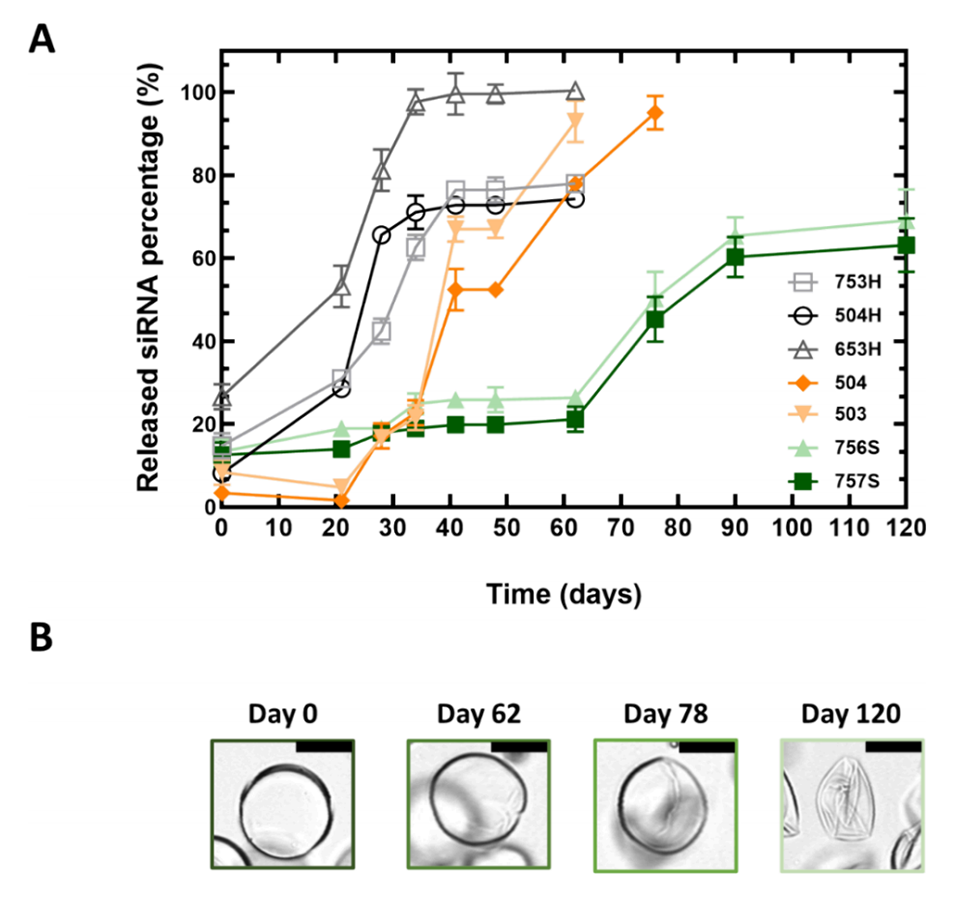
图6.微胶囊中siRNA的体外释放特性。
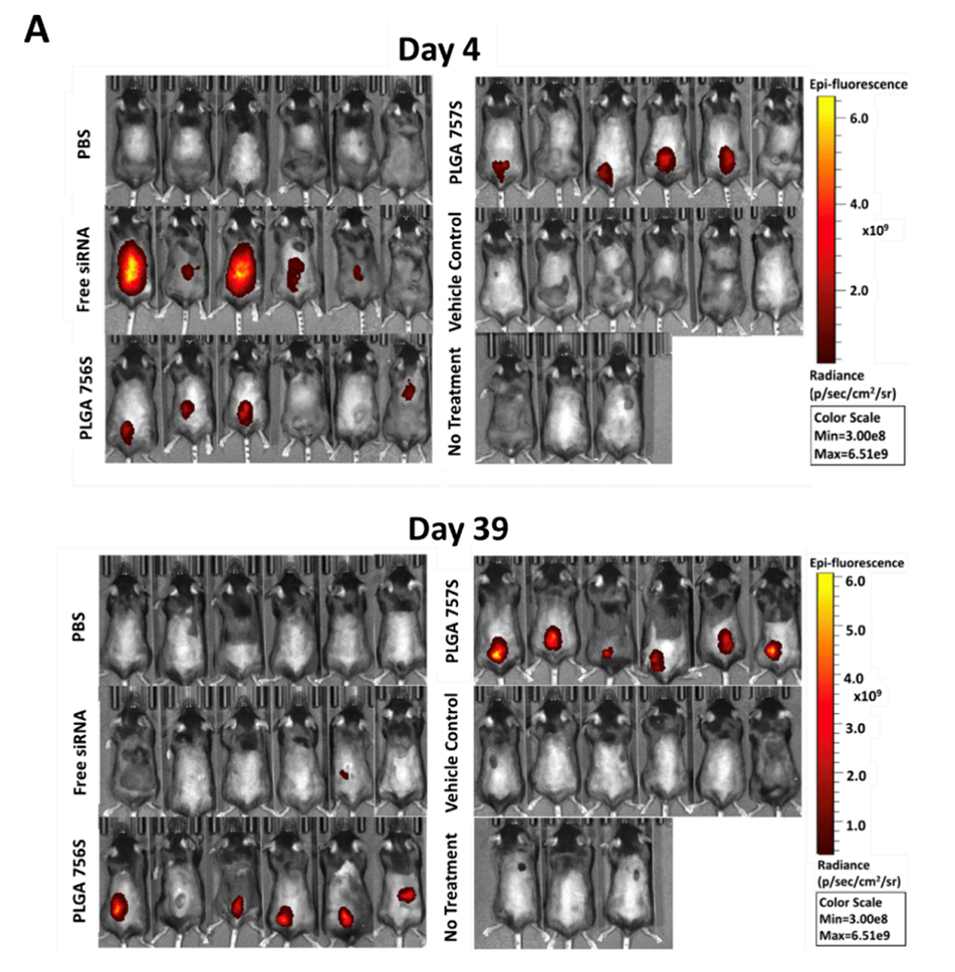
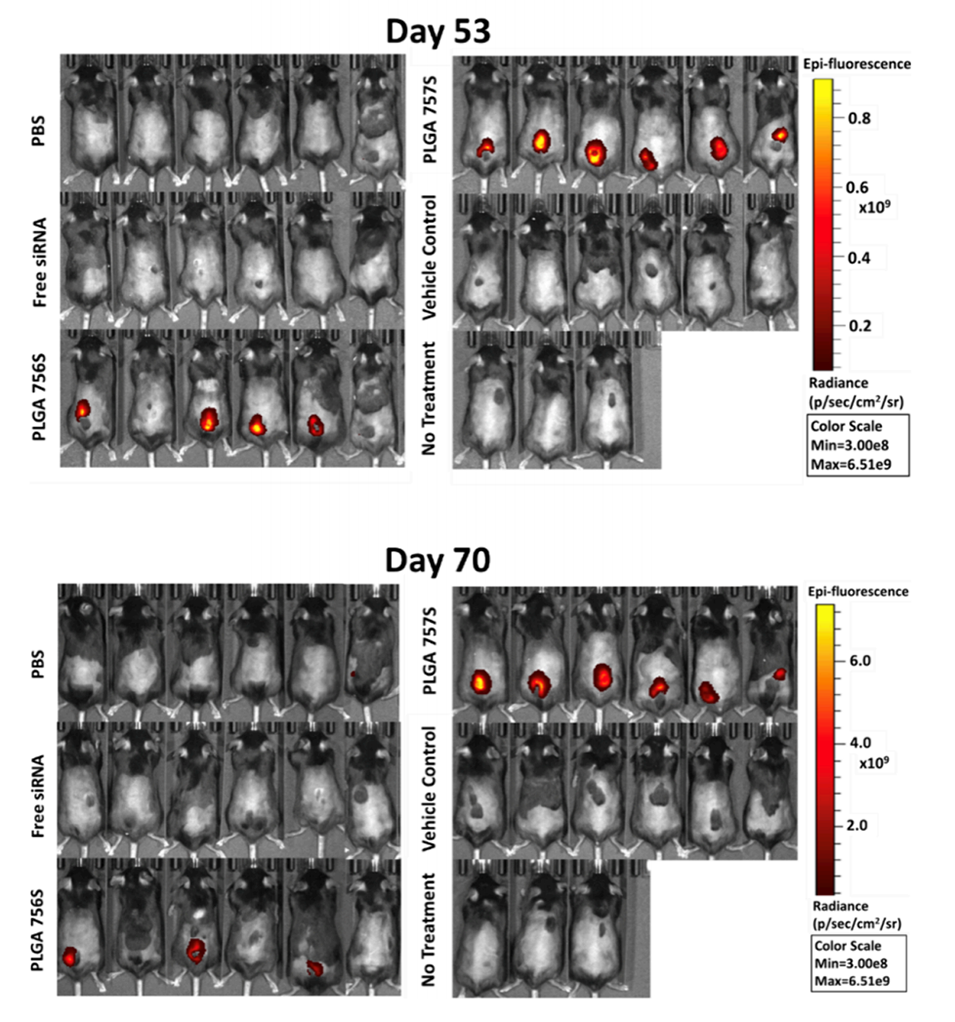
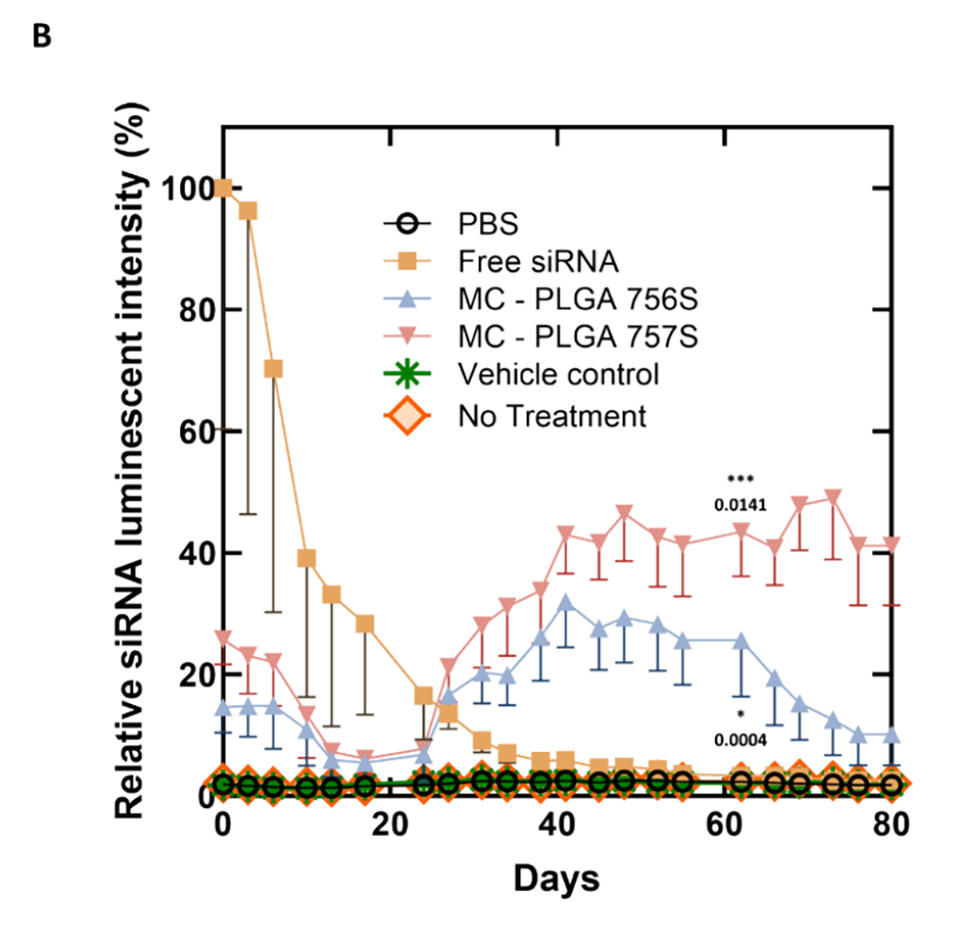
图7.小鼠皮下注射微胶囊中siRNA的体内释放曲线。
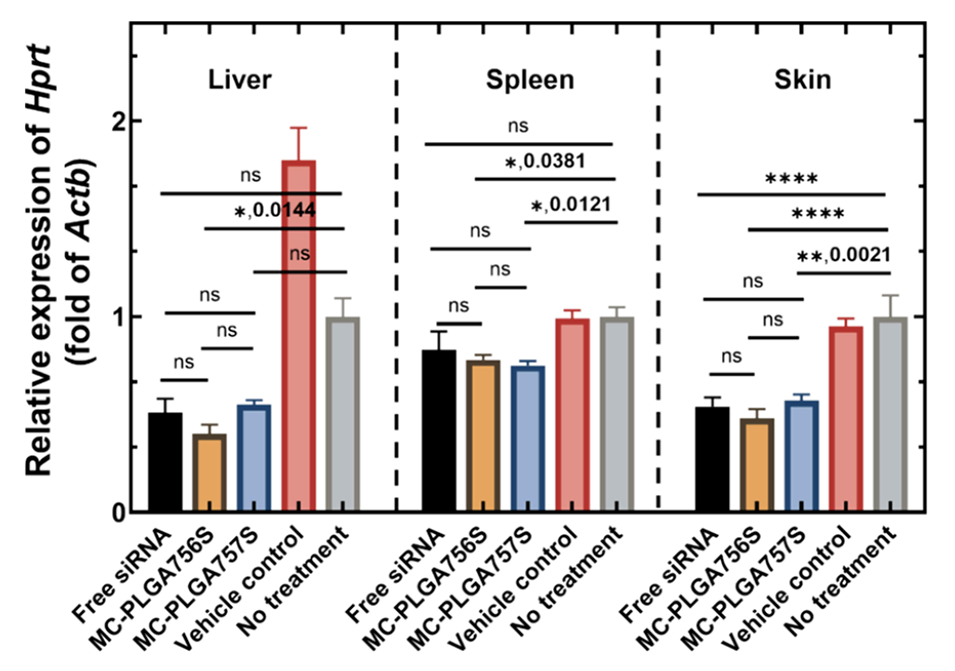
图8.第90天收集的肝脏、脾脏和皮肤组织中Hprt的相对基因表达水平,以相对于Actb的表达倍数表示。每个柱状图表示几何平均值±标准误差,以表达倍数形式呈现。统计分析方法为单因素方差分析,并使用Tukey事后检验进行多重比较(α=0.05),6次生物学重复,****p<0.0001;***p<0.001;**p<0.01;*p<0.05;ns:无显著差异。
论文链接:https://doi.org/10.1021/acsami.4c12805














