
微流控乳液模板技术可制备具有可调组成和结构的功能性微胶囊,但传统方法受限于乳液各相间的不混溶性,难以实现多样化的壳材料设计。近期,有研究人员提出了一种利用氟碳油基三重乳液模板结合界面表面活性剂络合的新策略,以克服传统多相乳液在微胶囊生产中的局限性。相关研究以“A Universal Strategy for Microcapsule Diversity via Interfacial Surfactant Complexation in Fluorocarbon Oil‐Based Triple Emulsions”为题目,发表在期刊《Advanced Functional Materials》上。
本文要点:
1、本文提出了一种基于氟碳油的三相乳液模板策略,通过在核心相与壳相之间引入全疏性(既疏水又疏油)的氟碳油层,突破了传统乳液模板在壳材料选择上的限制。
2、通过界面处带相反电荷的表面活性剂络合作用,显著增强了乳液的稳定性,使其适用于多种固化方法(如聚合、冷冻和溶剂去除)。
3、该方法无需复杂的表面活性剂设计或扩展系数的精确控制,能够制备具有水性或油性核心的微胶囊,并实现水基或油基壳材料的多样化设计。
4、实验验证了不同壳材料(如水凝胶、琼脂糖和PMMA)和固化方法的可行性,并展示了高效封装活性生物分子的能力。
5、该策略为化妆品、食品、药物递送和细胞治疗等领域提供了通用平台,显著拓展了微胶囊技术的应用潜力。
氟碳油基三重乳液在微胶囊制备中的优势主要体现在以下几个方面:
1、全疏性(Omniphobicity)
氟碳油同时具有疏水和疏油特性,作为核心相与壳相之间的中间层,可以解耦两者的不相容性。
这种特性支持在单一平台上封装极性(如水性)和非极性(如油性)核心物质,从而突破传统乳液模板的限制。
2、多样化壳材料选择
氟碳油的引入显著扩展了壳材料的选择范围,从水基到油基材料均可使用。
通过不同的固化方法(如聚合、冷冻和溶剂去除),可以制备多种功能性微胶囊,包括水凝胶壳、热响应性壳和疏水性聚合物壳。
3、增强乳液稳定性
通过界面表面活性剂的电荷复合(如阴离子表面活性剂Krytox 157与阳离子表面活性剂的结合),显著提高了乳液的动力学稳定性。
这种稳定性使乳液在高温(如90°C)或长时间储存(如7天)后仍能保持完整性,减少了固化过程中的破裂和融合。
4、支持多种固化方法
氟碳油基乳液无需对铺展系数进行精细控制或复杂的表面活性剂合成,即可支持多种固化方法,包括:
聚合:用于制备光聚合壳材料。
冷冻:用于制备热响应性水凝胶壳(如琼脂壳)。
溶剂去除:用于制备疏水性聚合物壳(如PMMA壳)。
5、抗生物污染性
氟碳油层能够有效防止蛋白质和其他生物分子在微胶囊界面的吸附。
这一特性对于药物递送和生物相容性应用非常重要,能够保护活性生物分子(如蛋白质)在微胶囊中的稳定性。
6、广泛的应用潜力
氟碳油基三重乳液模板的通用性和灵活性,使其适用于多个领域,包括食品、化妆品、药物递送和细胞治疗等。
其多样化的设计能力为微胶囊技术提供了新的可能性。
在微胶囊制备中,表面活性剂络合的作用机制如下:
1、增强乳液稳定性:
表面活性剂络合通过静电相互作用增强了乳液的稳定性,使得不同类型的表面活性剂能够在乳液界面形成非共价络合物,从而有效降低界面张力,增强乳液的整体稳定性。
2、促进多种固化方法的应用:
由于增强的稳定性,表面活性剂络合使得氟碳油基三重乳液能够适应多种固化方法(如聚合、冷冻和溶剂去除),这为微胶囊的多样化设计提供了更多的可能性,满足不同应用需求。
3、防止生物分子吸附:
表面活性剂络合还赋予了微胶囊抗生物污染的特性,能够有效防止生物分子(如蛋白质)在界面处的吸附,从而提高微胶囊的功能性,特别是在生物医药应用中。
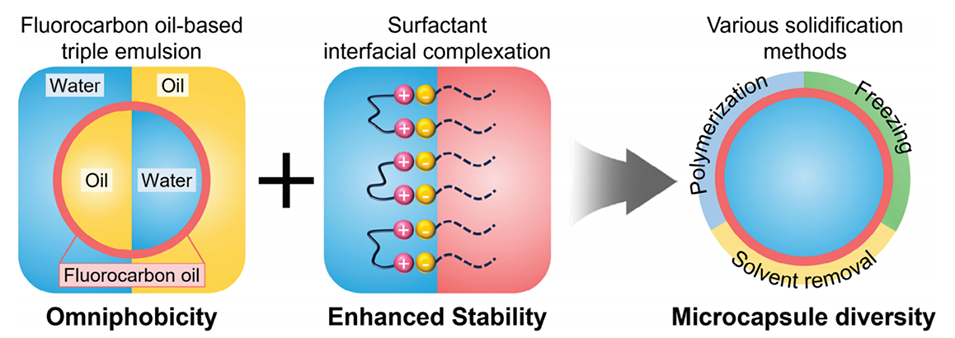
图1.通过氟碳油基三重乳液中的界面表面活性剂络合作用实现微胶囊多样性的示意图。具有全疏性特性的氟碳油中间层可解耦核心相与壳相之间的不相容性限制,而界面表面活性剂的络合作用提供了增强的乳液稳定性,从而支持多种固化方法的使用。
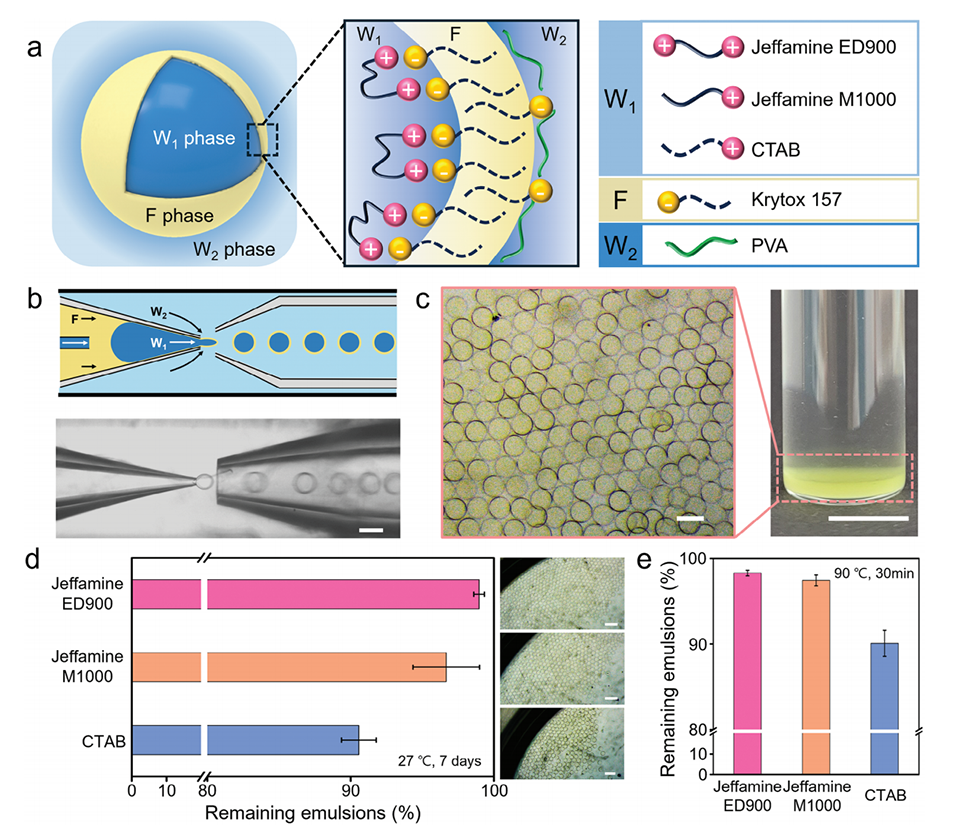
图2.a)水包氟碳油包水(W1/F/W2)双乳液的示意图,用于确定表面活性剂界面络合对乳液稳定性的影响。b)用于生产具有超薄氟碳油壳的双乳液的玻璃毛细管微流体装置的示意图和光学图像。比例尺为200μm。c)所得W1/F/W2双乳液的光学图像和照片,该双乳液在水性核中含有0.0075wt%的Jeffamine ED900,在包含FC 70的氟碳油中含有3wt%的Krytox 157。为了便于观察,将少量的绿色荧光染料(荧光素)加入到水性核(W1)中。比例尺分别表示200μm(左)和1cm(右)。d)稳定性图,比较了在室温(27°C)下孵育7天后,不同水相核心中表面活性剂类型对剩余完整乳液比例的影响。右侧的光学图像显示了乳液在7天后的状态。所有比例尺均表示为500μm。e)热稳定性图,比较了在90°C下暴露30分钟后,不同水相核心中表面活性剂类型对剩余完整乳液比例的影响。
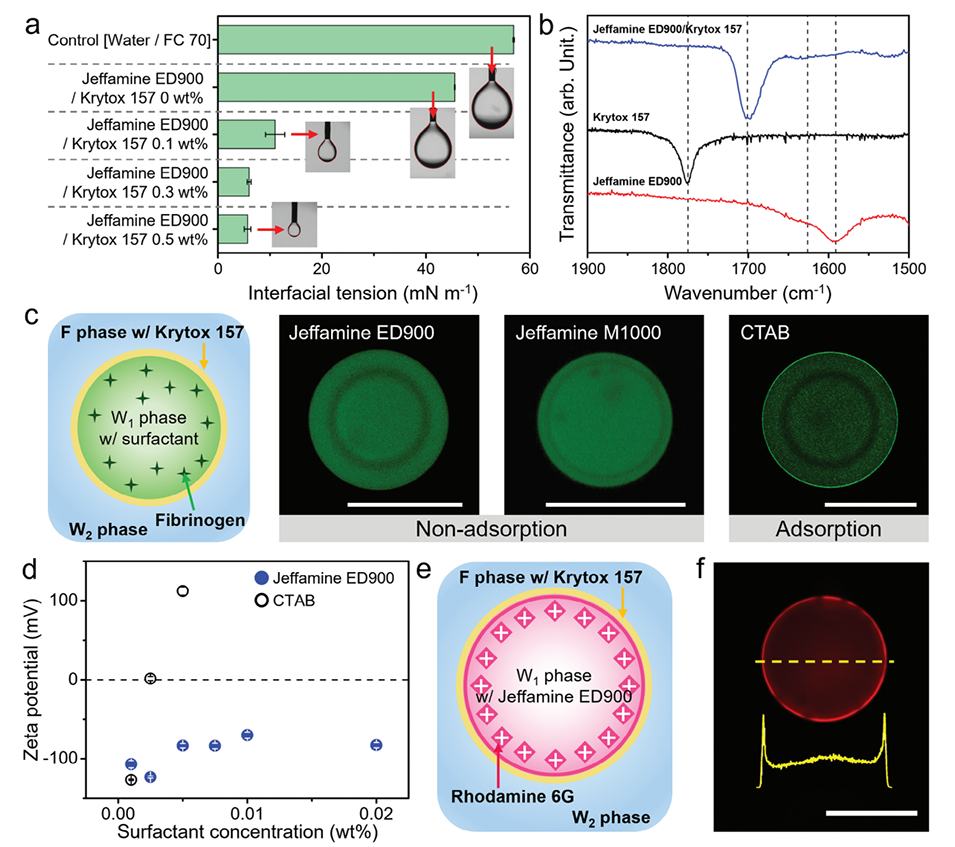
图3.a)显示不同表面活性剂浓度下,水相与氟碳油相(FC 70)之间界面张力(IFT)值的图。插图为悬滴法测量中悬挂液滴的形态光学图像。b)Jeffamine ED900、Krytox 157及其络合物的红外(IR)光谱图。c)包含Alexa 488标记纤维蛋白原的水相核心W1/F/W2双乳液的示意图和共聚焦显微镜图像,比较不同表面活性剂类型的影响。d)不同表面活性剂类型和浓度下,含有3 wt% Krytox 157的FC 70液滴分散于连续水相介质中的Zeta电位分布图。e)含有正电荷红色荧光染料(罗丹明6G)的W1/F/W2双乳液的示意图及f)荧光显微镜图像,乳液水相核心中加入Jeffamine ED900和Krytox 157。插图中的黄色曲线显示了双乳液中红色荧光的空间分布强度剖面。所有比例尺为200μm。
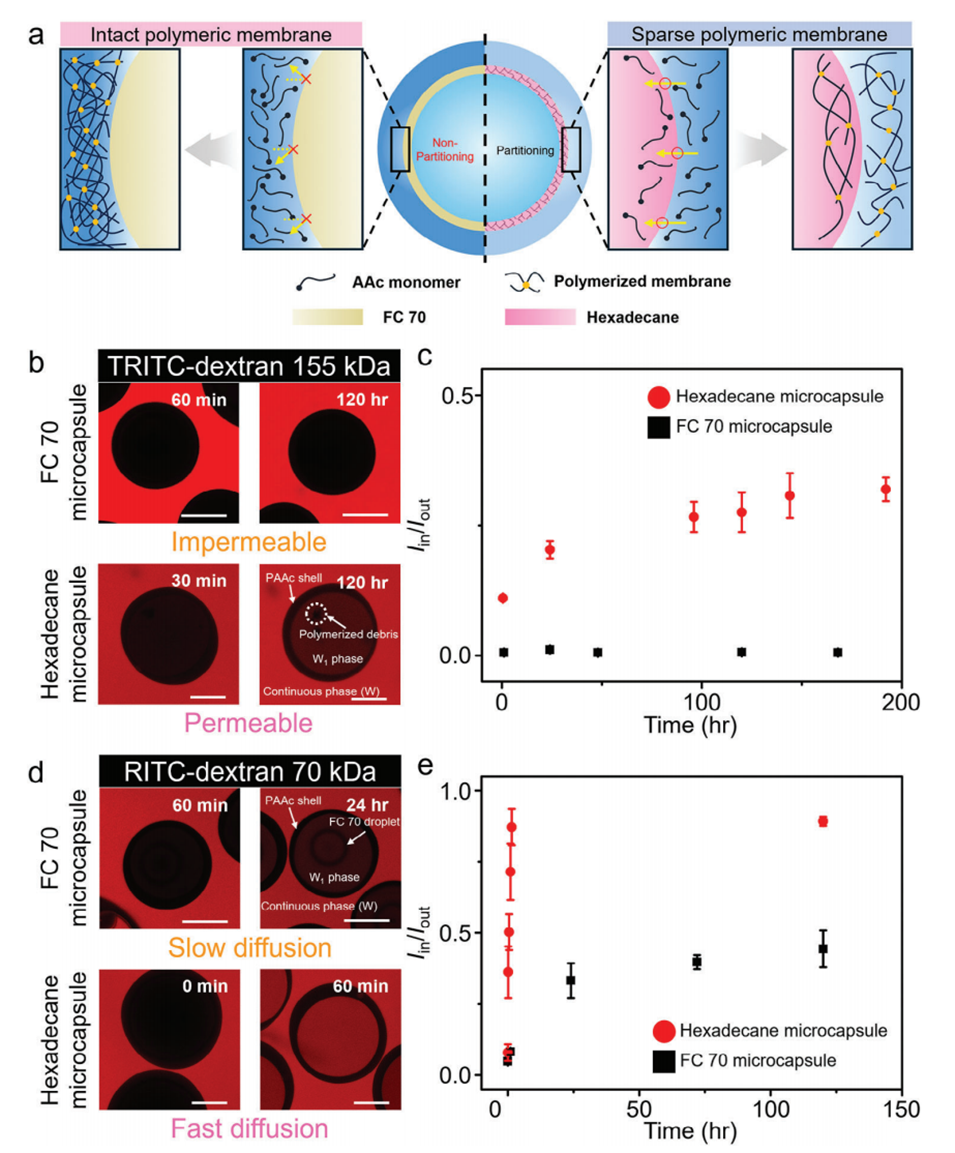
图4.a)与十六烷类似物相比,氟碳油基三重乳液在AAc基微胶囊生产中的应用示意图。b,c)使用TRITC-葡聚糖(155 kDa)的延时共聚焦显微镜图像和荧光强度分布图,分别展示了以FC 70(FC 70微胶囊)或十六烷(十六烷微胶囊)为中间层的三重乳液制备的AAc基微胶囊。d,e)使用RITC-葡聚糖(70 kDa)的延时共聚焦显微镜图像和荧光强度分布图,分别展示了以FC 70(FC 70微胶囊)或十六烷(十六烷微胶囊)为中间层的三重乳液制备的AAc基微胶囊。所有比例尺为200μm。
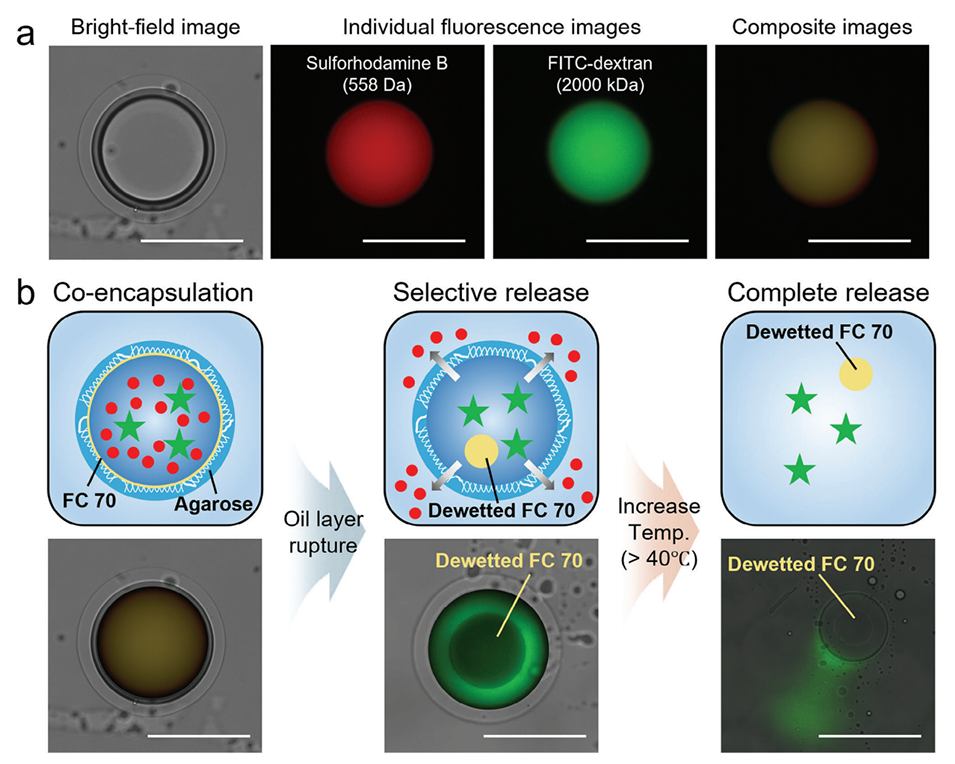
图5.a)明场图像、单独荧光图像及复合图像展示了含有中间层FC 70的琼脂糖微胶囊,该微胶囊在水相核心中封装了两种具有不同颜色和分子量的模型亲水性物质:硫基罗丹明B(红色,分子量=558 Da)和荧光素异硫氰酸酯(FITC)标记的葡聚糖(绿色,分子量=2000 kDa)。b)一系列复合图像显示了多组分货物从琼脂糖微胶囊中通过油层破裂然后溶解的顺序释放。所有比例尺为200μm。
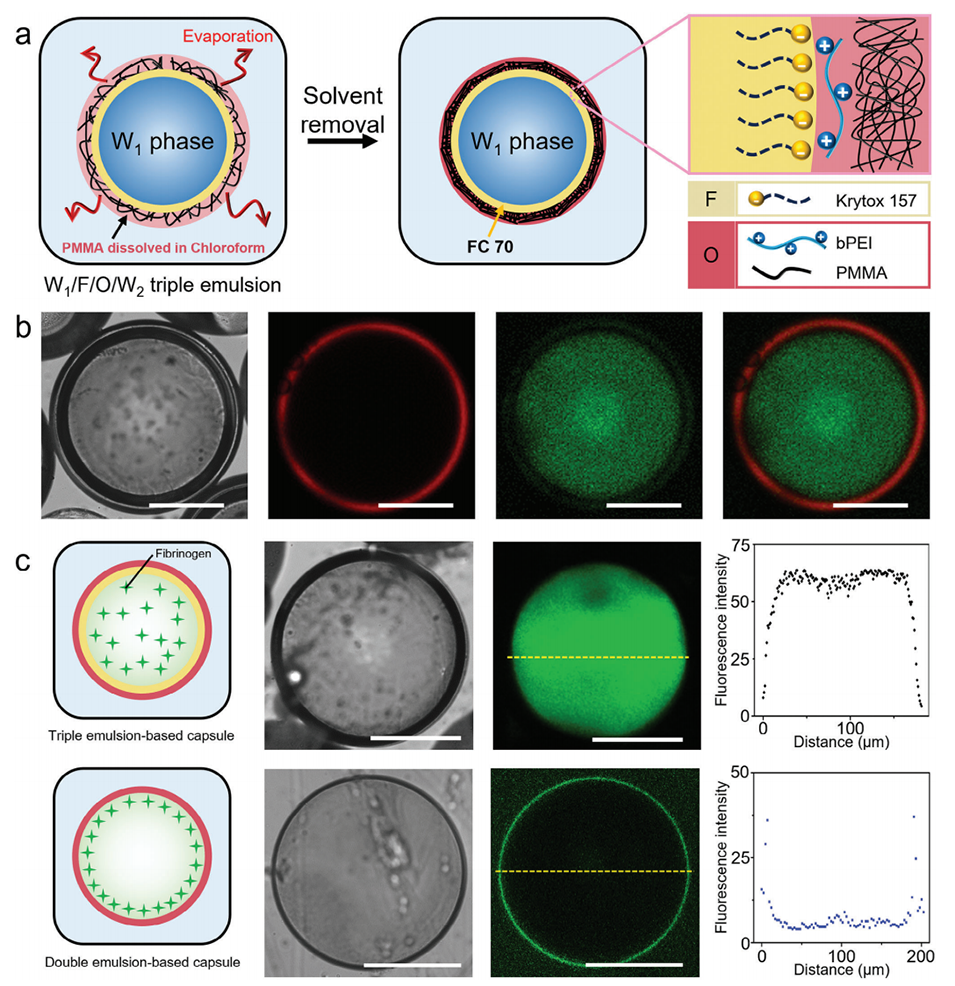
图6.a)通过溶剂去除生产薄壳微胶囊时,表面活性剂-聚电解质在W1/F/O/W2三重乳液外界面(F/O)络合的示意图。b)明场图像、单独荧光图像及复合图像显示成功制备了具有FC 70层的薄壳PMMA微胶囊。荧光素(绿色荧光染料)和尼罗红(红色荧光染料)分别掺入水性核(W1)和油壳相(O)中,以便于可视化。c)封装Alexa 488纤维蛋白原(绿色)的三重和双乳液模板微胶囊的示意图、光学和共聚焦显微镜图像,以及空间分辨强度分布图。所有比例尺为200μm。
论文链接:https://doi.org/10.1002/adfm.202417921














