尽管微流体混合在RNA负载脂质纳米颗粒(RNA-LNP)生产中相较于传统方法具有精确的尺寸控制、均匀分布和高封装效率等优势,但其商业化应用仍面临挑战,尤其是设备表面在长时间操作中容易发生污垢积累,影响性能和可靠性。

为了应对这一挑战,有研究人员提出使用全氟十氢萘(PFD)的固定化液体润滑涂层来创建一个可以排斥多种LNP成分的防污表面,以解决微流控芯片在RNA-LNP生产过程中的表面污染问题。相关研究以“Robust, Scalable Microfluidic Manufacturing of RNA–Lipid Nanoparticles Using Immobilized Antifouling Lubricant Coating”为题目,发表在期刊《ACS Nano》上。
本文要点:
1、使用固定化全氟十氢萘(PFD)润滑层形成防污表面,并将其应用于交错人字形微流控混合芯片(SHM),实现了超过3小时的稳定运行,相比传统方法性能提升15倍。
2、该技术在包含256个SHM混合器的并行化平台上表现出良好的扩展性,支持商业化生产速率。
3、实验验证表明,该方法生产的LNP在理化性质及体内外性能上与未涂层芯片一致。
4、通过抑制表面结垢,该技术显著提升了RNA-LNP生产的可靠性和稳定性,为多种材料的微流控制造提供了新思路。
使用微流控技术生产RNA-LNP相比传统的批量生产方法,具有以下优势:
1、精确控制:微流控技术能够更精确地控制RNA-LNP的颗粒尺寸、形态和封装效率,确保产品的一致性和可重复性。
2、均匀分布:微流控混合能够在微米尺度上实现快速混合,避免了传统批量混合中常见的混合不均匀性,从而提高了封装效率和降低了颗粒的多分散性。
3、高效生产:微流控设备支持并行化设计,能够在单个芯片上集成多个混合单元,从而实现高通量生产,适合商业化应用。
4、减少表面污染:通过使用固定化的液体润滑层(如全氟十氢萘),微流控设备能够有效抑制表面污染,延长设备的稳定运行时间,提升生产的可靠性。
5、适应性强:微流控技术能够适应多种溶剂和复杂的反应环境,适合用于RNA-LNP的生产,而传统方法在这方面的适应性较差。
6、符合制药标准:微流控芯片通常采用硅和玻璃材料,具有良好的溶剂兼容性和高压操作能力,符合制药工业的严格要求。
综上所述,微流控技术在RNA-LNP生产中提供了更高的精度、效率和可靠性,推动了RNA基药物和疫苗的开发与应用。
固定化液体润滑层如何解决微流控设备的结垢问题?
1、形成稳定的防污表面:固定化液体润滑层(如全氟十氢萘)通过与全氟化基底结合,形成一层稳定的液体薄膜,具有疏水性和疏油性,能够排斥RNA-LNP的多种成分。
2、减少颗粒沉积:润滑层的光滑特性使颗粒难以附着在设备表面,从而显著降低结垢风险。
3、延长设备运行时间:实验表明,未涂层芯片在10分钟内会发生结垢,而使用润滑层的芯片可稳定运行超过3小时,性能提升超过15倍。
4、保持产品质量:润滑层能够防止通道堵塞,确保RNA-LNP的粒径均匀性和封装效率,维持高质量生产。
固定化液体润滑层相比传统防污涂层有哪些优势?
1、适应复杂环境:传统涂层(如PEG、两性离子涂层等)主要用于水相环境,而固定化液体润滑层在水/乙醇混合溶剂环境中仍能保持稳定。
2、防污效果更持久:传统涂层在RNA-LNP生产中通常在20分钟内失效,而润滑层可稳定运行超过3小时。
3、减少设备清洗需求:润滑层显著降低了表面污染,减少了清洗频率,提高了生产效率。
4、易于集成:润滑层技术可与硅/玻璃基底兼容,适合制药工业的高压操作和溶剂环境。
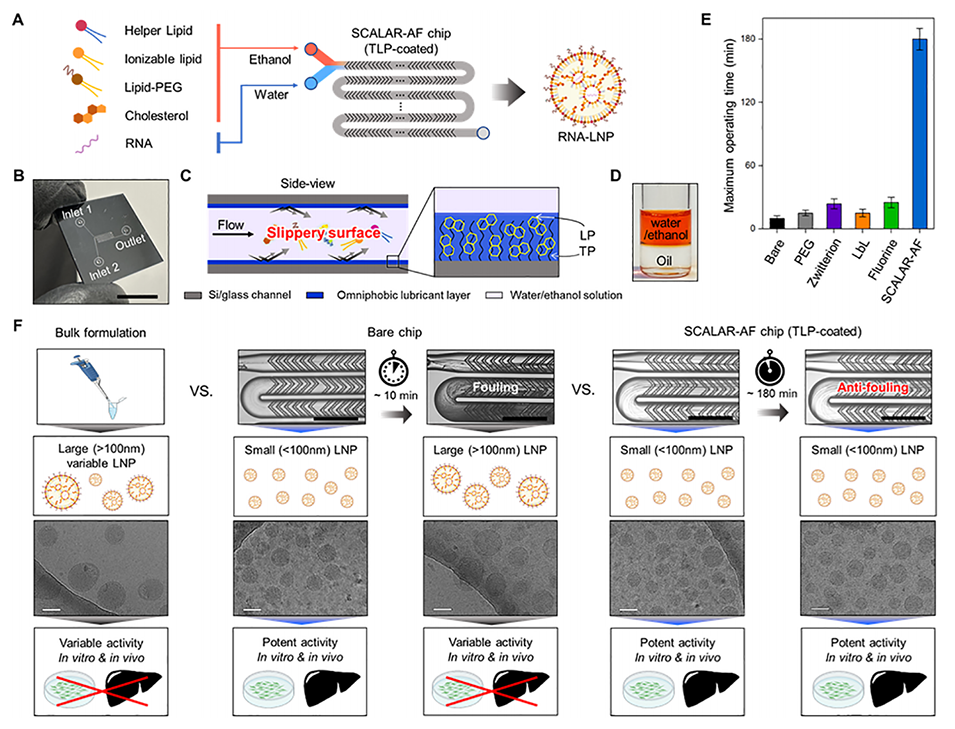
图1.(A)使用SCALAR-AF芯片进行RNA-LNP稳健制造的示意图。(B)带有交错人字形微混合器的SCALAR-AF芯片照片。比例尺:10 mm。(C)RNA-LNP在涂有润滑层表面上的抗污行为示意图,显示固定的全氟碳(TP)与基底结合,从而使液态全氟十氢萘(LP)形成稳定的薄膜并附着在表面上。(D)照片展示了水/乙醇(3:1)混合溶液与润滑油相之间的不相容性。(E)绘制了不同表面处理的微流控混合芯片的最大操作时间的图表。(F)示意图和显微镜图像显示抗污微流控芯片能够生产更小且更均一的LNP,用于高效的RNA递送,而批量制备和传统微流控芯片生产的LNP更大且不均一,因设备内部结垢导致RNA递送不精确且不可靠。比例尺:300 μm。冷冻电镜(cryo-TEM)图像显示了通过批量制备、裸芯片和涂有润滑层的芯片在污垢形成前后生产的RNA-LNP。比例尺:100 nm。
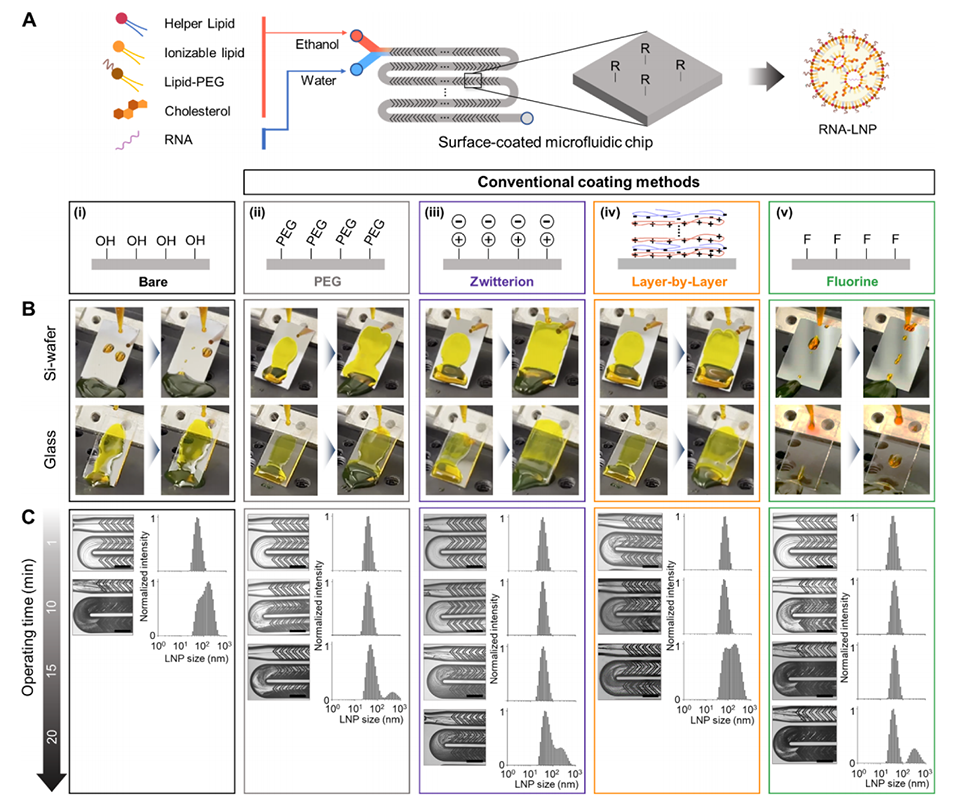
图2.(A)展示了在微流控芯片中测试的各种表面涂层方法的示意图,包括裸芯片、PEG、两性离子、层层自组装(LbL)和氟涂层。(B)显示了在45度倾斜角下,水/乙醇(3:1)混合溶液在不同涂层的Si和玻璃基材上的润湿/不润湿情况的照片。(C)左侧列出照片,右侧为动态光散射(DLS)结果,展示了不同芯片在操作时间内的污垢行为和LNP尺寸变化。
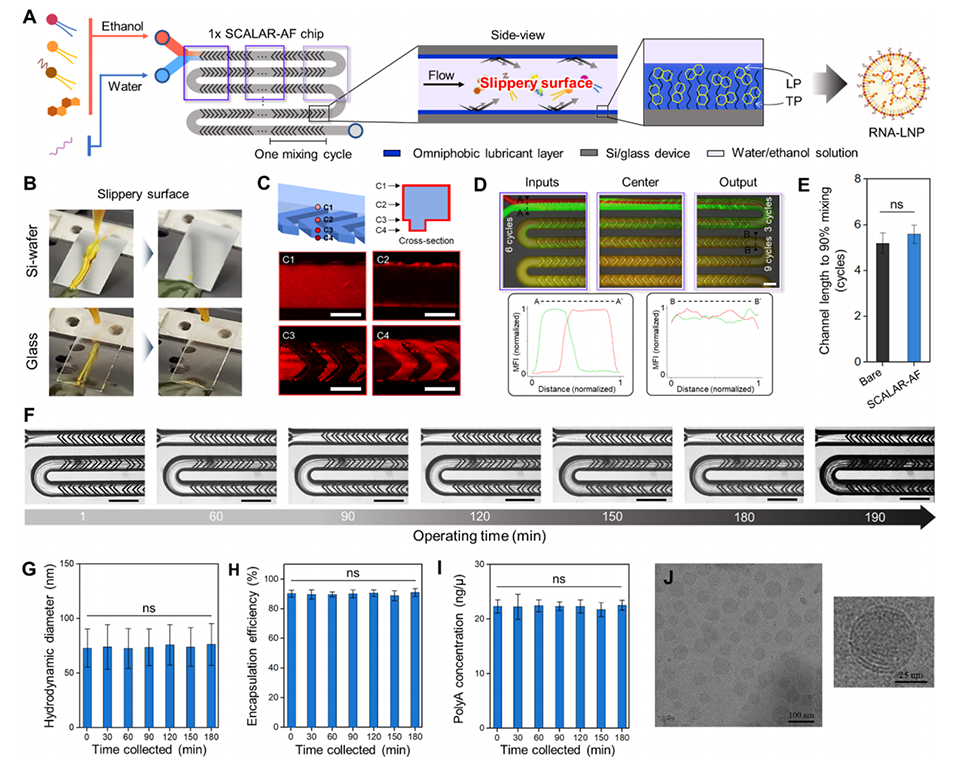
图3.(A)由TLP涂层SCALAR-AF芯片生产RNA-LNP的示意图。(B)显示了在45度倾斜角下,水/乙醇混合物在TLP涂层的Si和玻璃基材上的排斥性照片。(C1-C4)显示了在不同高度下,微流控设备表面润滑油层的共聚焦显微镜图像。(D)显微图像揭示了1×SCALAR-AF芯片中优异的混合效率;尼罗红乙醇和FITC水溶液通过通道流动,以量化沿通道不同位置的混合效率。(E)混合效率定量分析(±标准偏差),通过裸芯片和1×SCALAR-AF芯片达到90%混合所需的通道长度计算得出(n=3,单因素方差分析,ns:p>0.05)。(F)连续显微照片显示在约180分钟内进行RNA-LNP配制时未出现严重污染。比例尺:150μm。(G-I)1×SCALAR-AF芯片在1至180分钟内生成的polyA LNPs的物理表征。(G)1至180分钟内生成的polyA LNPs的动态光散射直径(±标准偏差),(H)包封效率(±标准偏差),以及(I)RNA浓度(±标准偏差)(n=3,单因素方差分析,ns:p>0.05)。(J)1×SCALAR-AF芯片生成的polyA LNPs的冷冻电镜(Cryo-TEM)图。比例尺:100 nm和25 nm。
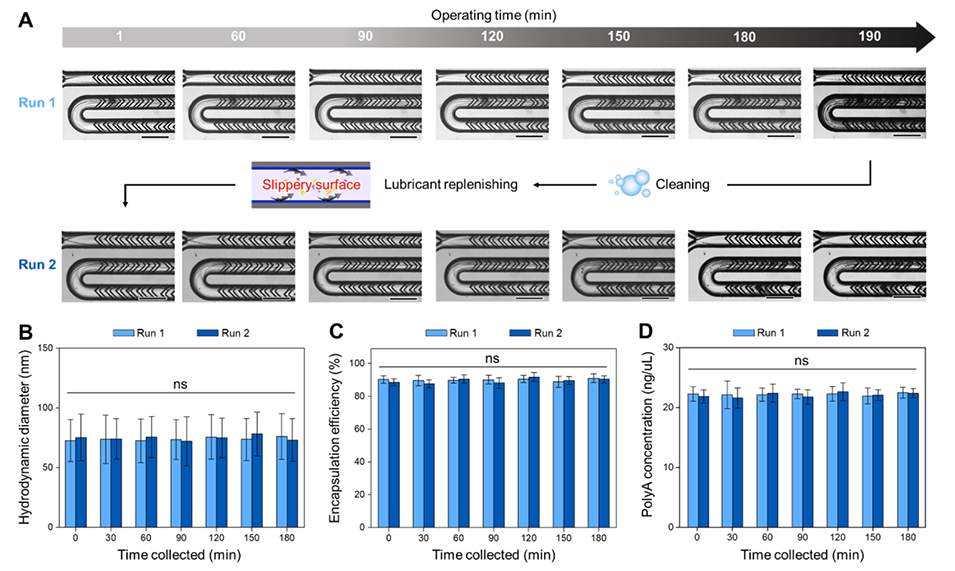
图4.(A)连续显微照片显示在约180分钟内进行两次polyA LNP配制时未出现严重污染。设备经过1%Triton-X100清洗、氮气吹扫,然后进行乙醇清洗,并再次用氮气吹扫。随后,应用全氟十氢萘(PFD)液体形成润滑层以创建防污表面。补充后的SCALAR-AF芯片通过排斥多个LNP成分展现了防污性能。比例尺:150μm。(B-D)两次连续运行中1×SCALAR-AF芯片生成的polyA LNPs的物理表征。(B)1至180分钟内生成的polyA LNPs的动态光散射直径(±标准偏差),(C)包封效率(±标准偏差),和(D)RNA浓度(±标准偏差)(n=3,单因素方差分析,ns:p>0.05)。
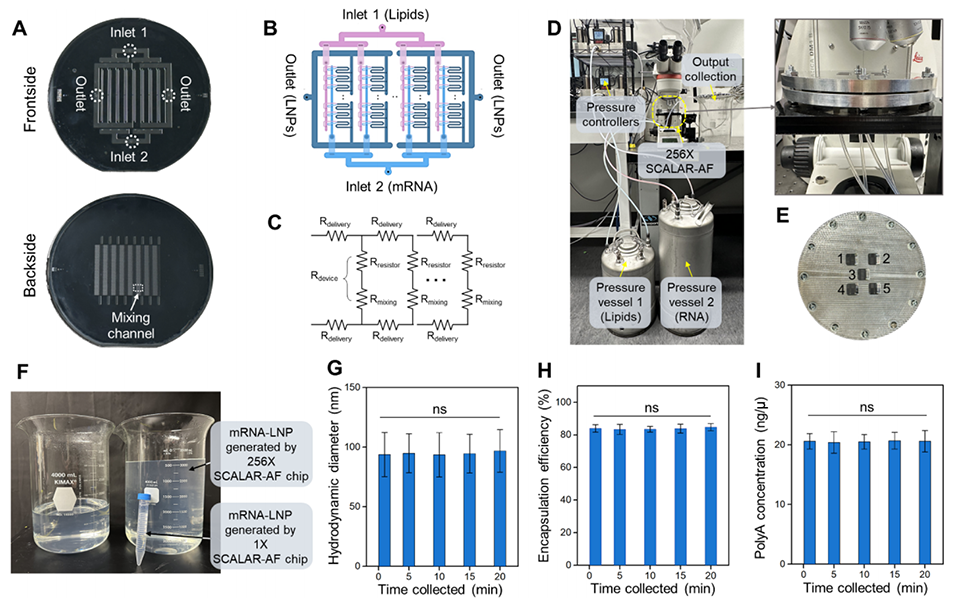
图5.(A)256×SCALAR-AF芯片的正面和背面照片。(B)芯片设计的示意图,展示了分支几何结构和梯形设计架构的集成,以确保输入物料在每个混合单元中的均匀分布。该示意图不按比例绘制。(C)输送通道(Rdelivery)、电阻器(Rresistor)、混合通道(Rmixing)以及单个混合通道单元(Rdevice)的电路模型。(D)照片展示了通过定制的压力驱动流系统,利用256×SCALAR-AF芯片扩大RNA-LNP生产规模的实验装置。(E)展示256×SCALAR-AF芯片的组装铝制支架的照片,其正面提供了用于观察不同位置的窗口。(F)拍摄的图像展示了256×和1×SCALAR-AF芯片生产LNPs的相对吞吐量,结果分别为256×芯片在20分钟内生成了4.8L(装在3.5L烧杯中)和1×芯片在10分钟内生成了0.012L(装在15mL Falcon离心管中)。(G)256×SCALAR-AF芯片生成的polyA LNPs的动态光散射直径(±标准偏差),(H)包封效率(±标准偏差),以及(I)RNA浓度测量结果(±标准偏差)(n=3,单因素方差分析,ns:p>0.05)。
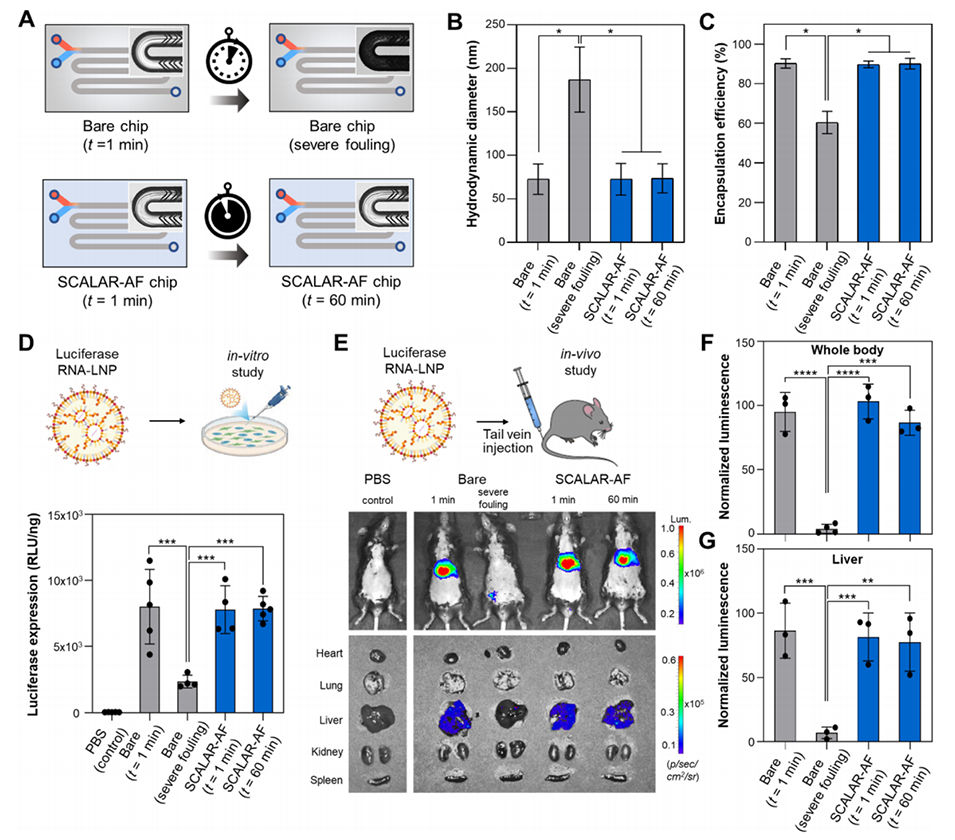
图6.(A)示意图展示了裸芯片(在t=1分钟时及严重污染后)和TLP涂层SCALAR-AF芯片(在t=1和60分钟时)生成的荧光素酶RNA-LNPs。(B)使用每种设备生成的荧光素酶RNA-LNPs的DLS结果(动态光散射,±标准偏差)(n=3,单因素方差分析和Tukey多重比较,*p<0.05)。(C)通过RiboGreen检测量化每种设备生成的RNA包封效率(±标准偏差)(n=3,单因素方差分析和Tukey多重比较,*p<0.05)。(D)配制的荧光素酶RNA-LNPs以60 ng/60,000个细胞的剂量施用于HeLa细胞;在6小时后通过发光量化荧光素酶表达水平(n=4-5,单因素方差分析和Tukey多重比较,***p<0.001)。(E)配制的荧光素酶RNA-LNPs以每只鼠4μg的剂量通过尾静脉注射给药。LNP给药后6小时的代表性IVIS成像,显示全身(上图)及解剖器官(下图)的荧光素酶表达。(F)LNP给药后6小时全身荧光素酶信号的量化(n=3-4,单因素方差分析和Tukey多重比较,***p<0.001;****p<0.0001)。(G)肝脏中荧光素酶信号的量化(n=3,单因素方差分析和Tukey多重比较,**p<0.01;***p<0.001)。
论文链接:
https://doi.org/10.1021/acsnano.4c12965














