水凝胶微球作为功能性三维(3D)细胞载体在细胞附着和生长方面备受关注,具有细胞治疗和生物医学研究的潜力。脱细胞外基质(dECM)衍生的水凝胶保留了天然组织的物理和生物特性,具有高生物活性和组织特异性,可促进组织再生。

近期,中山大学全大萍教授、白莹副教授团队开发了一种二级温控微流控系统,用于高效制备无化学交联的dECM水凝胶微球,这些微球具有高生物活性和组织特异性,可用于3D细胞培养、细胞移植及再生医学研究。相关研究以“Bioactive Decellularized Extracellular Matrix Hydrogel Microspheres Fabricated Using a Temperature-Controlling Microfluidic System”为题目,发表在期刊《ACS Biomaterials Science & Engineering》上。
本文要点:
1、本研究开发了一种新型二级温控微流控系统,可高效制备原始dECM水凝胶微球。
2、以猪脱细胞外周神经基质(pDNM)为模型材料,无需额外支撑材料或化学交联即可生成稳定的pDNM微球(pDNM-MSs),通过调节水/油相流速比实现精确的尺寸控制。
3、pDNM-MSs在14天内保持球形和纳米纤维超微结构,且支持雪旺细胞、PC12细胞和神经干/祖细胞的附着、生长和增殖,表现出优于市售明胶微球的性能。
4、该dECM水凝胶微球为3D细胞培养和功能化提供了高生物活性微环境,具有广泛的生物医学应用前景。
温控微流控系统(TSTC-MS)利用dECM溶胶的温度敏感性(溶胶-凝胶转变特性),在低温下形成乳液,在高温下完成凝胶化,从而实现了无需化学交联剂的dECM水凝胶微球的高效制备。具体步骤如下:
1、系统组成:TSTC-MS由PDMS微流控芯片、两个注射泵、一个加热磁力搅拌器、两根聚四氟乙烯管(内径1.0 mm)和一根硅胶管(内径2.0 mm)组成。
2、水油相混合:水相主要由dECM溶胶(pDNM-sol)组成,油相为含有20%(v/v)Span 80的矿物油。在0~4℃的环境温度下,水相和油相在微流控芯片内混合形成乳液。
3、乳液形成与凝胶化:乳液从微流控芯片的出口流入连接的硅胶管,硅胶管浸没在37℃的水浴中。在37℃的温度下,dECM溶胶发生凝胶化,形成水凝胶微球。
4、去除残余油相:凝胶化后的微球被转移到双层液体浴中(由相分离的乙醚和PBS溶液组成)。通过二乙醚去除残余的矿物油,随后将微球浸泡在PBS溶液中。
5、微球收集与清洗:通过离心(2000 rpm)收集微球沉淀,并用PBS溶液清洗三次以去除残留杂质。
6、尺寸调控:通过调节水相和油相的流速比(例如水相流速为66.7、100、200 μL/h,油相流速为1000、1500、3000、5000、7000 μL/h),可以精确控制微球的尺寸分布。
使用脱细胞外基质(dECM)水凝胶微球进行细胞培养具有以下优势:
1、高生物活性:dECM保留了天然组织中的功能性分子和纳米纤维超微结构,可促进细胞粘附、延展和增殖以及组织特异性功能(如细胞迁移和定向分化),提供接近天然组织的生理微环境。
2、组织特异性:dECM来源于特定组织,具有与原始组织相关的生物学特性,能够更好地支持目标组织的再生和功能恢复。
3、三维微环境:dECM水凝胶微球提供了三维(3D)培养环境,增强了细胞与基质的相互作用,有利于氧气、营养物质和代谢废物的交换,从而维持细胞活力。
4、无化学交联剂:通过温控微流控系统制备的dECM水凝胶微球无需化学交联剂,避免了化学处理对细胞活性的潜在影响,同时保持了较高的孔隙率和生物相容性。
5、尺寸可控性:微流控技术可精确调控微球尺寸,适应不同细胞类型的培养需求。
6、多功能性:dECM水凝胶微球可作为细胞载体,用于细胞移植、药物释放和组织再生等多种生物医学应用。
综上,dECM水凝胶微球为细胞培养提供了高度仿生的微环境,具有广泛的应用潜力。
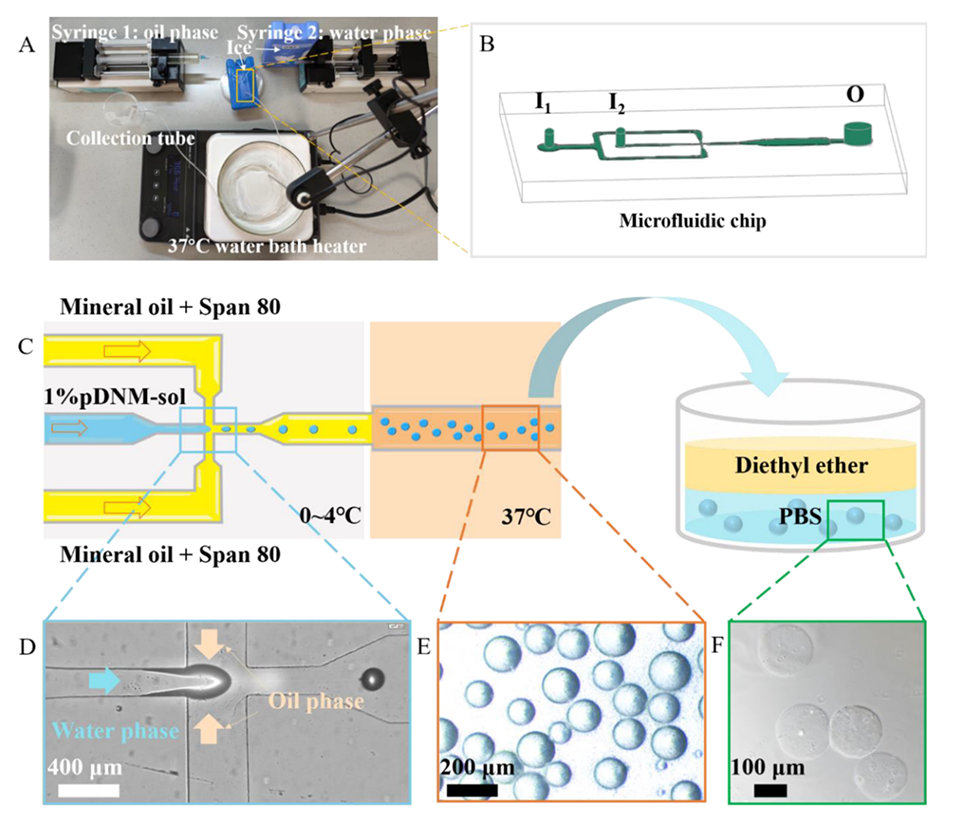
图1.使用二级TSTC-MS制备pDNM水凝胶微球。
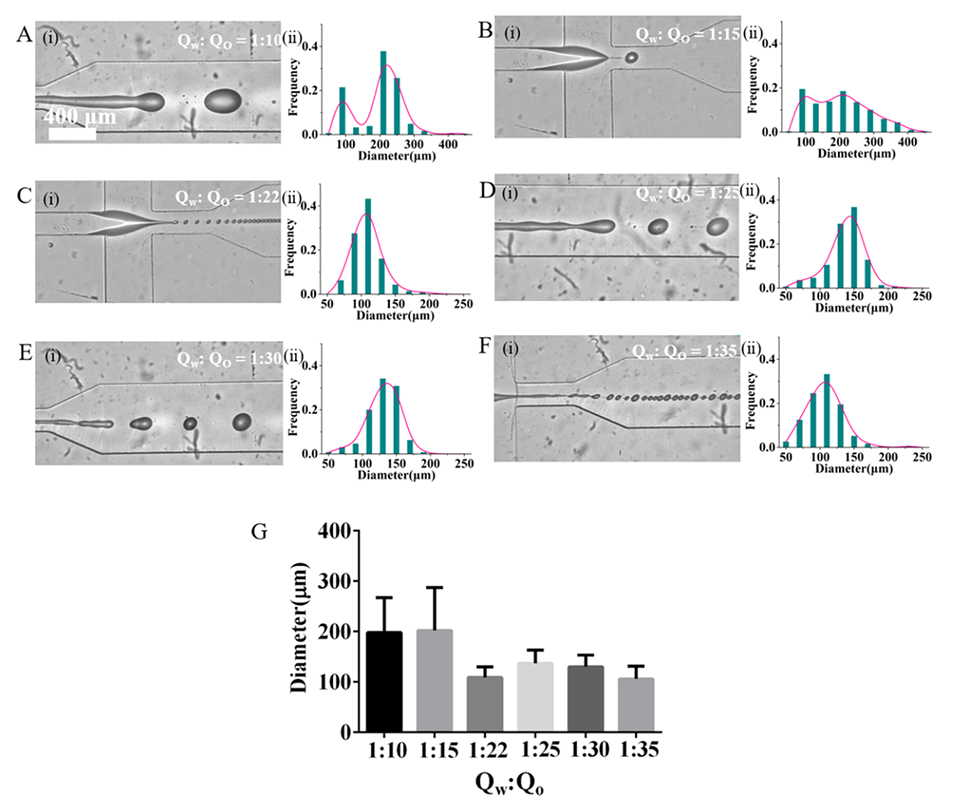
图2.分散在矿物油中的pDNM-MSs的制备和粒径分布。

图3.pDNM水凝胶微球的微观表征。
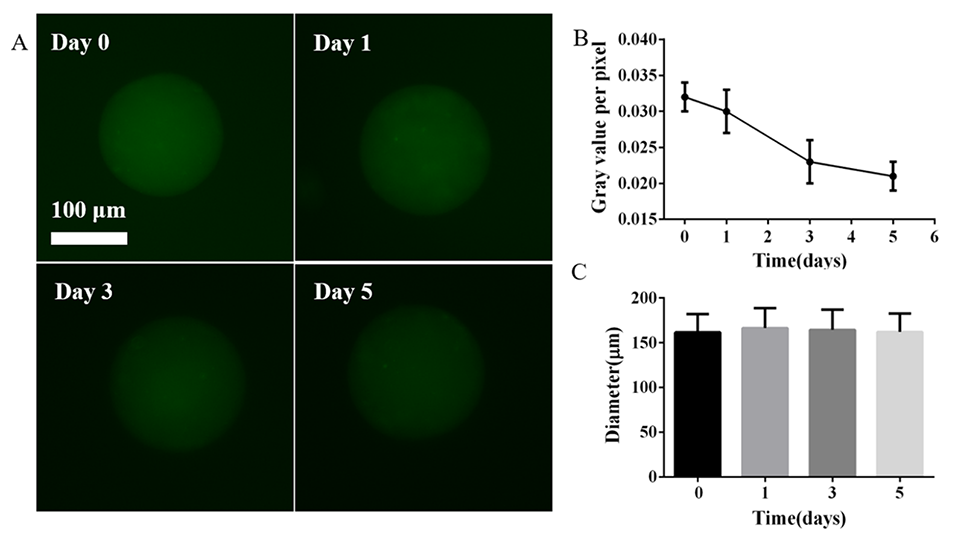
图4.pDNM-MSs中负载的FITC-葡聚糖的持续释放。
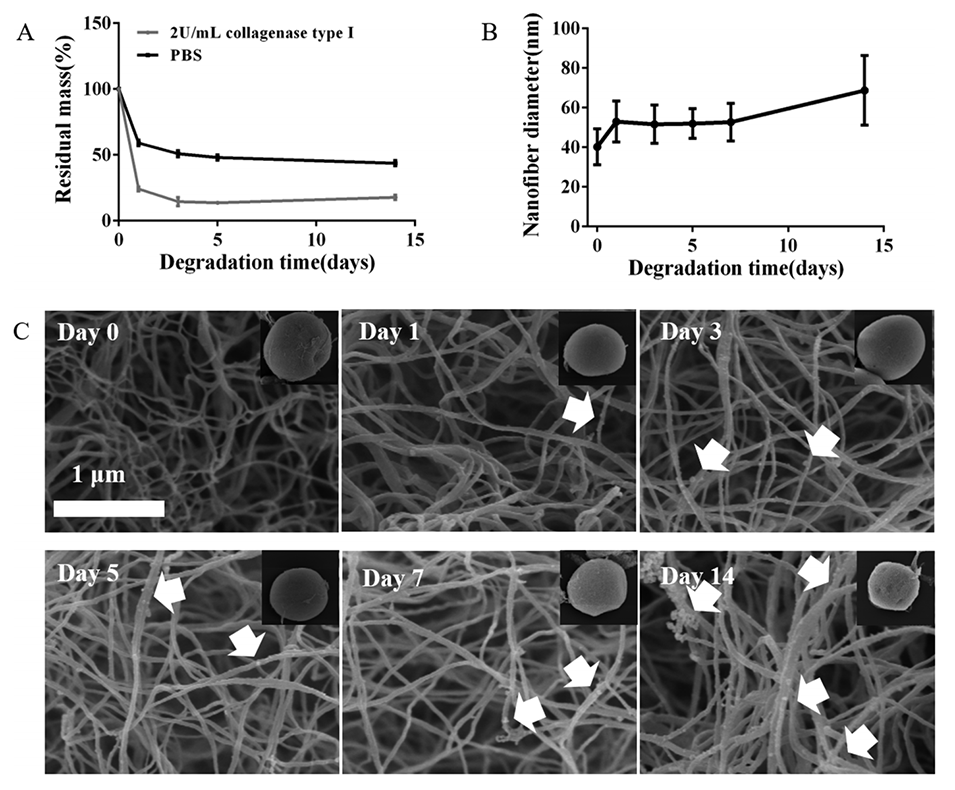
图5.pDNM-MSs在PBS溶液中的降解和形态变化。
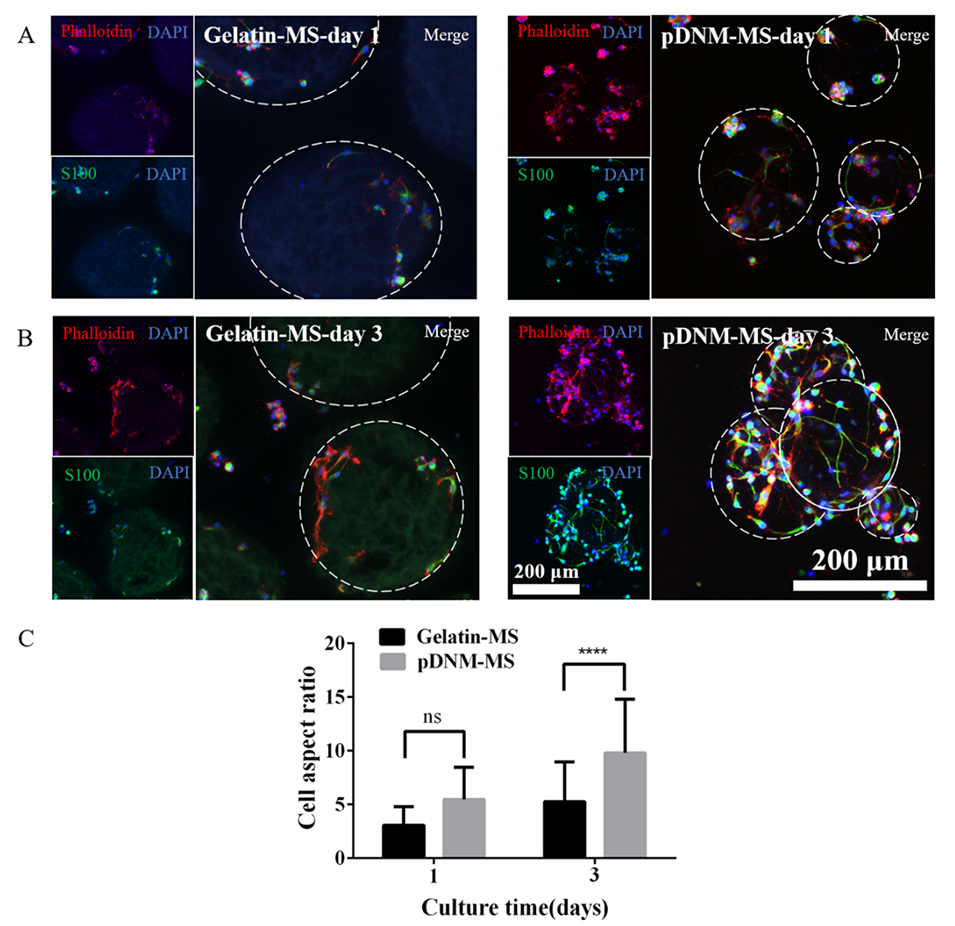
图6.通过荧光共聚焦显微镜对分别在明胶-MSs和pDNM-MSs上培养(A)1天和(B)3天的原代SCs进行免疫荧光染色。SCs用S100(绿色)标记。细胞骨架用鬼笔环肽(红色)标记,细胞核用DAPI(蓝色)标记。(C)明胶-MSs和pDNM-MSs上的SC纵横比。ns,p>0.05,****p<0.0001,n>30。
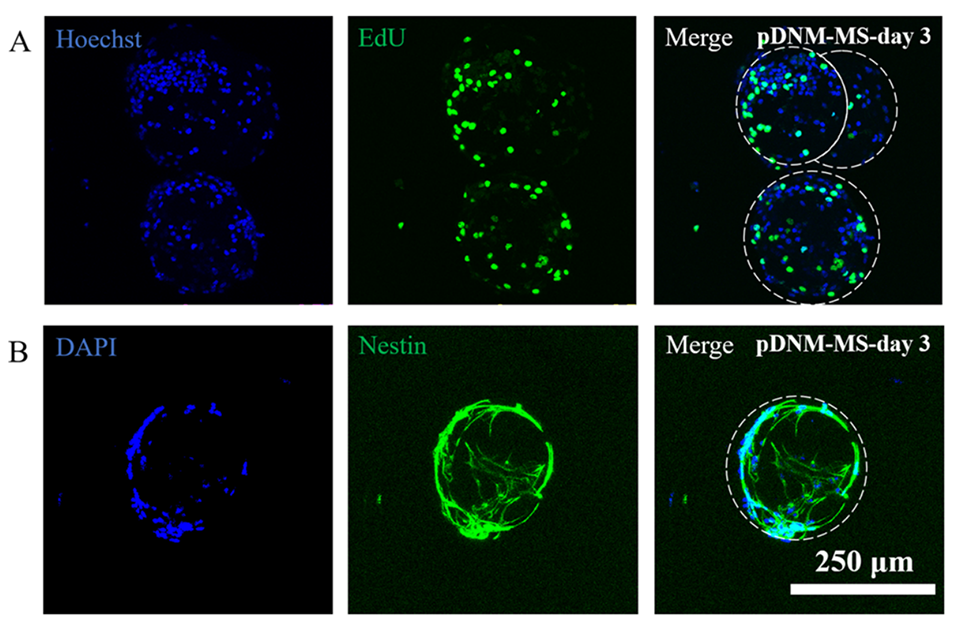
图7.在pDNM-MSs上3D培养的NSPCs的免疫荧光染色。
论文链接:https://doi.org/10.1021/acsbiomaterials.1c01474














