
近期,有研究人员提出了一种基于超声微反应器的乳液-溶剂蒸发技术,用于高效合成单分散PLGA纳米颗粒(PDI < 0.3,粒径115–150 nm),并成功实现了疏水性染料Nile Red的包封与三相释放,展示了其在生物医学领域的广泛应用潜力。相关研究以“Microfluidic synthesis of PLGA nanoparticles enabled by an ultrasonic microreactor”为题目发表于期刊《Reaction Chemistry & Engineering》。
本文要点:
1、本文提出了一种超声波微反应器,用于通过乳液溶剂蒸发技术合成聚乳酸-羟基乙酸共聚物(PLGA)纳米粒子。
2、通过优化超声功率、PLGA浓度和水相与有机相的流速比,成功制备了粒径为115-150 nm、多分散指数(PDI)为0.1-0.2的单分散PLGA纳米颗粒,适用于生物医学应用。
3、此外,研究还实现了对疏水性染料尼罗红(Nile Red)的成功包封,染料负载率(DL)达0.34%,并展示了其三相释放特性。
4、本研究表明,基于超声微反应器的乳化-溶剂挥发技术可作为微流控纳米沉淀法的替代方案,用于合成PLGA纳米颗粒,同时避免了使用毒性较高的二类溶剂及其后续去除步骤。
超声微反应器相比传统方法在PLGA纳米颗粒的合成过程中具有以下优势:
1、提高颗粒均一性:超声微反应器通过空化微流和声波流动混合,能够快速生成单分散的水包油(O/W)乳液,显著降低颗粒的多分散性(PDI < 0.3),从而实现更均一的PLGA纳米颗粒。
2、精确控制颗粒尺寸:通过调节超声功率、频率、水相与有机相流速比和反应温度等参数,超声微反应器可以在115-150 nm范围内精确控制颗粒的平均粒径,满足生物医学应用需求。
3、减少批次间差异:传统批量方法容易出现批次间的颗粒尺寸和分布差异,而微反应器的连续流动操作确保了更高的可重复性和过程稳定性。
4、避免污染问题:传统超声乳化方法可能因超声探头的侵蚀导致颗粒污染,而微反应器采用封闭系统设计,避免了此类污染风险。
5、使用更安全的溶剂:传统纳米沉淀法常用毒性较高的二类溶剂(如乙腈、DMSO),而微反应器采用乳化-溶剂挥发技术,使用毒性较低的三类溶剂(如乙酸乙酯),更符合药物合成的安全性要求。
6、简化后处理步骤:微反应器生成的乳液颗粒更稳定,减少了乳滴重新聚合的可能性,从而降低了后续分离和纯化的复杂性。
综上,超声微反应器通过快速混合、精确控制和封闭操作,显著提高了PLGA纳米颗粒合成的效率、均一性和安全性,克服了传统方法的多项局限性。
在体外研究中,Nile Red从PLGA纳米颗粒中的释放表现出三相释放特性。具体来说:
初始快速释放阶段:在最初的几个小时内,Nile Red迅速释放,这主要是由于染料分布在颗粒表面或靠近颗粒表层的部分。
缓慢释放阶段:在接下来的几天中,释放速率显著降低,主要受PLGA颗粒缓慢降解和染料从颗粒内部扩散的双重控制。
最终加速释放阶段:在实验后期,随着PLGA的进一步降解,释放速率再次增加。
这种三相释放特性表明,PLGA纳米颗粒能够实现对疏水性分子(如Nile Red)的持续释放,在药物递送等领域具有潜在的应用价值。
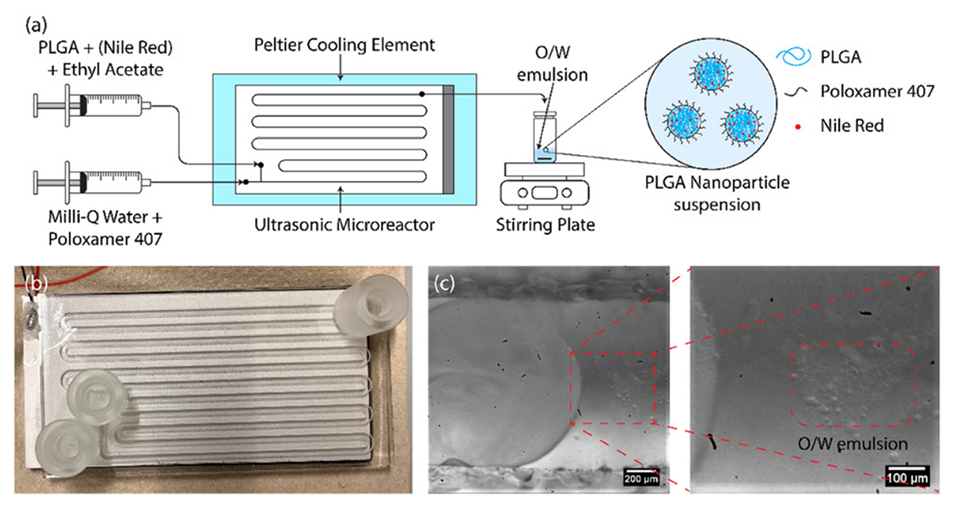
图1.(a)(尼罗红负载)PLGA纳米颗粒的合成步骤示意图,(b)超声微反应器,(c)超声驱动下微通道中生成的O/W乳液。

图2.在(a)5 W、(b)10 W、(c)15 W和(d)20 W的超声功率下合成的空白PLGA纳米颗粒的代表性SEM图像。超声微反应器在48 kHz的频率下运行。PLGA浓度为12 mg mL-1。

图3.在48 kHz和10 W的超声频率和功率下合成的(a)空白PLGA纳米粒子和(b)负载尼罗红的PLGA纳米粒子的代表性SEM图像。
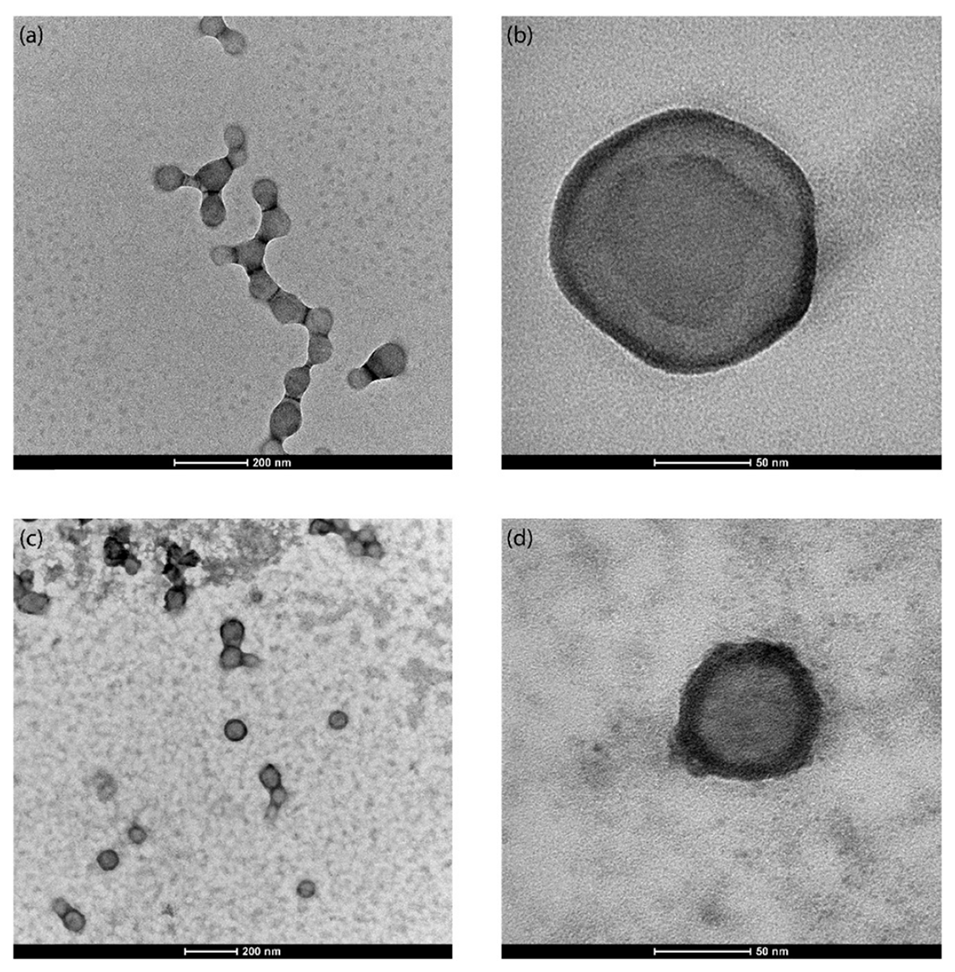
图4.在48 kHz和10 W的超声频率和功率下合成的(a-b)空白PLGA纳米粒子和(c-d)负载尼罗红的PLGA纳米粒子的代表性TEM图像。
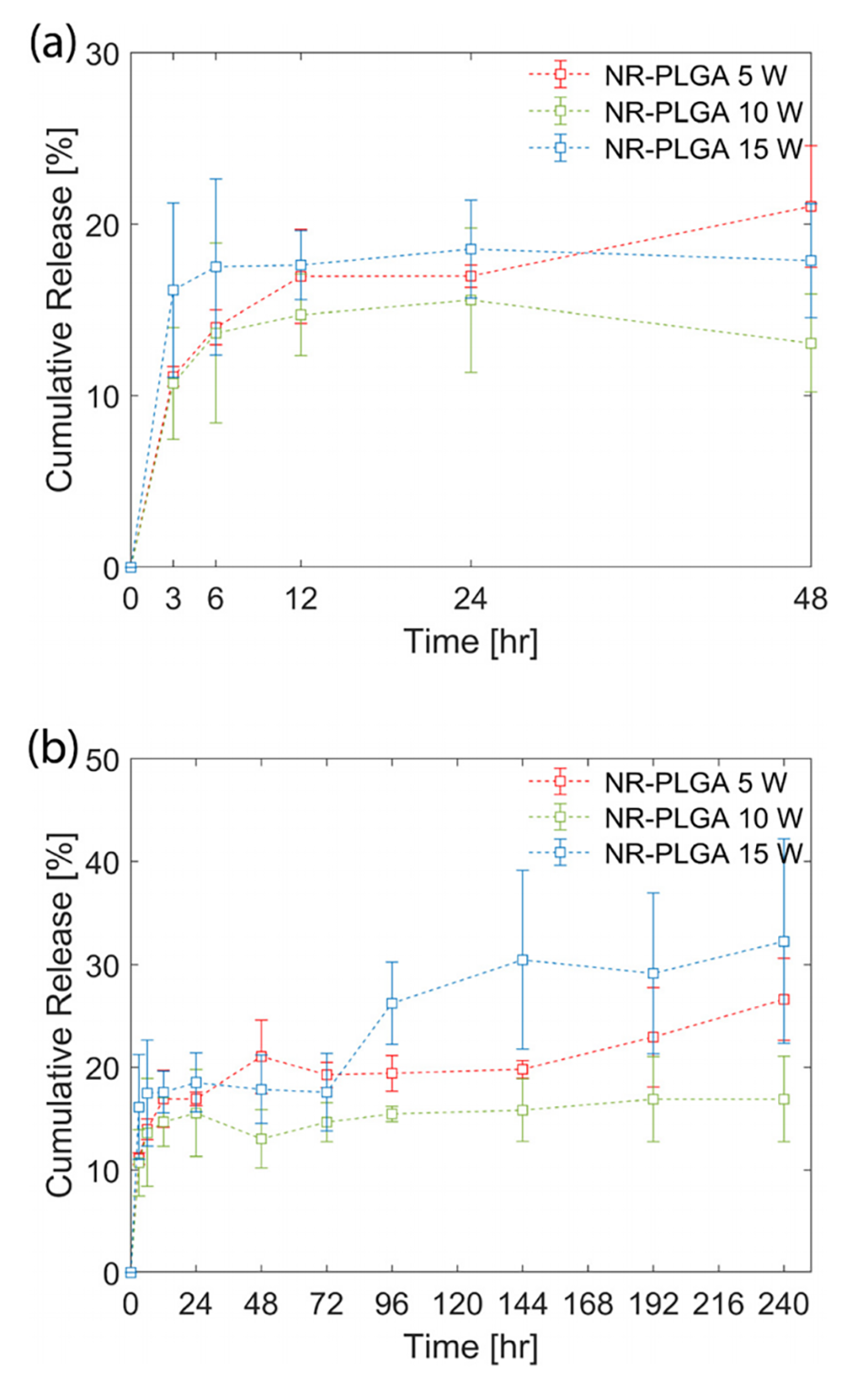
图5.在5 W、10 W和15 W的超声功率下合成的NR-PLGA纳米颗粒的体外释放曲线。(a)前48小时的释放曲线和(b)240小时的释放曲线。
论文链接:https://doi.org/10.1039/D4RE00107A














