
导读:
受生物细胞区室化机制启发,核壳微胶囊通过致密外壳与液态内核的协同设计,实现了活性物质的高效存储与精准释放。本文系统梳理了纳米颗粒赋能核壳微胶囊的关键技术进展,从自组装原理、功能实现到产业化挑战,揭示了其在自修复材料、柔性电子与精准医疗等领域的突破潜力。通过剖析纳米颗粒在微胶囊中的动态组装机制与空间调控策略,为下一代智能微载体的开发提供理论支撑与技术路径。相关研究成果以“Nanoparticle-Empowered Core-Shell Microcapsules: From Architecture Design to Fabrication and Functions”为题发表于国际知名期刊《Small》。
本文要点:
1、本综述探讨了纳米粒子增强的核壳微胶囊的设计、制造及其功能。
2、受生物细胞隔室的启发,合成的核壳胶囊能够储存活性物质并按需释放功能,推动自适应材料、可持续电子、软机器人和精准医学等领域的科学进展。
3、通过将多种纳米粒子引入具有致密外壳和液体核心的微胶囊中,研究表明这些纳米添加剂不仅增强了胶囊的机械强度、光学特性和热导率,还赋予了其动态特性,如触发释放、可变形结构和驱动移动。
4、本文详细分析了纳米粒子在微胶囊中的组装原理及其空间组织,讨论了不同纳米粒子所赋予的特殊功能,并展望了实现这些微载体潜力所需的基础研究和实验。
一张图读懂全文
纳米颗粒动态组装机制的理论建模为何成为技术突破关键?
当前研究多依赖经验性Pickering乳液理论,但实际合成过程中界面张力、粒子润湿性等参数的动态变化导致理论预测偏差。例如在相分离工艺中,溶剂蒸发速率差异会改变纳米颗粒的吸附能(ΔE=πR²γow(1-|cosθ|)²),进而影响最终壳层结构均一性。建立跨尺度热力学-动力学耦合模型,能够更精准地考虑这些动态变化,从而成为精准控制纳米颗粒空间分布的核心。
如何解决多组分协同响应体系的功能冲突难题?
解决多组分协同响应体系的功能冲突难题是实现微胶囊多功能化的关键。研究发现,在双粒子系统(如TiO2/Fe3O4)中,静电相互作用可能导致乳液稳定性下降,进而影响微胶囊的结构和功能表现。为解决这一问题,可以采用以下策略:
对磁性粒子进行SiO2包覆:通过在Fe3O4表面包覆一层SiO2,可以降低界面电荷干扰,从而减少静电相互作用对乳液稳定性的影响。
采用Janus结构纳米颗粒实现空间隔离功能区域:Janus结构纳米颗粒具有不对称的表面性质,可以将不同功能的纳米颗粒分别吸附在不同的功能区域,从而实现空间隔离,避免功能冲突。
引入pH响应型聚合物层作为动态隔离介质:通过在微胶囊壳层中引入pH响应型聚合物层,可以在不同的pH条件下动态调节纳米颗粒的分布和功能表现,进一步优化微胶囊的性能。
结语:
纳米颗粒赋能的核壳微胶囊技术正在重塑智能材料的设计范式。随着动态组装理论的完善与多尺度计算工具的突破,该技术有望在绿色制造、精准医疗等领域实现突破性应用。
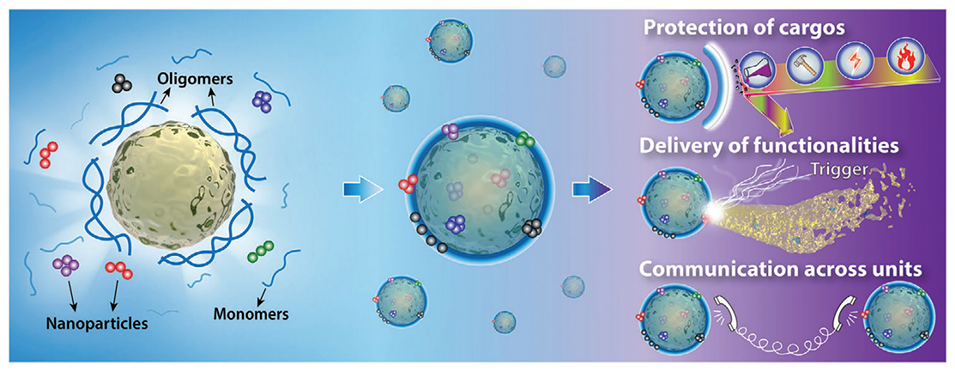
图1.纳米粒子增强核壳胶囊的概念。通过基于乳液的原位自组装,将具有不同功能的纳米粒子掺入微尺度载体中,从而实现生物启发特性,以保护对环境敏感的货物,提供按需功能,并协调跨单元的细胞间通信。
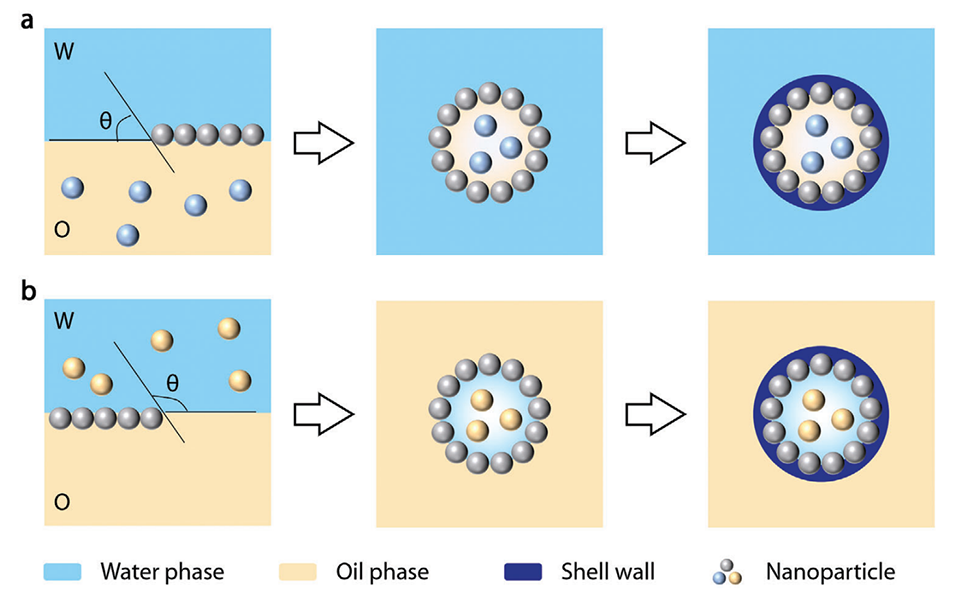
图2.微胶囊系统中纳米粒子组装示意图。

图3.纳米颗粒负载微胶囊的结构示意图和实验描述。
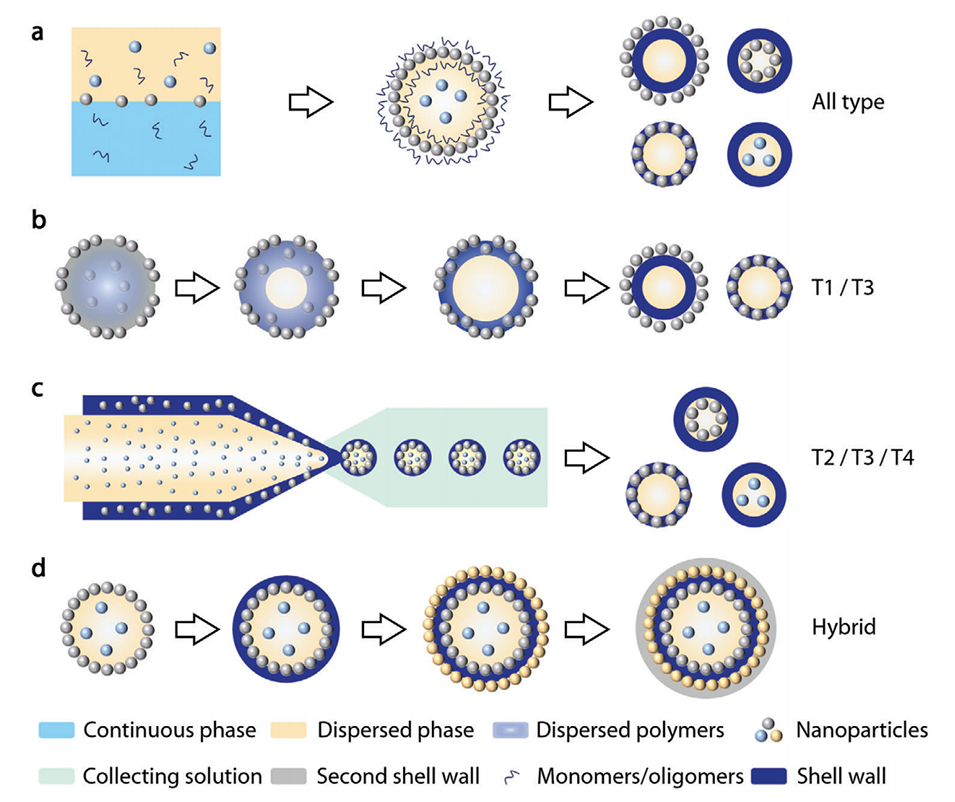
图4.纳米粒子掺入核壳微胶囊的实验方法及其结构调节能力。
图5.通过掺入纳米颗粒实现的胶囊功能图。

图6.Pickering颗粒在封装具有挑战性的成分和控制胶囊尺寸方面的能力。
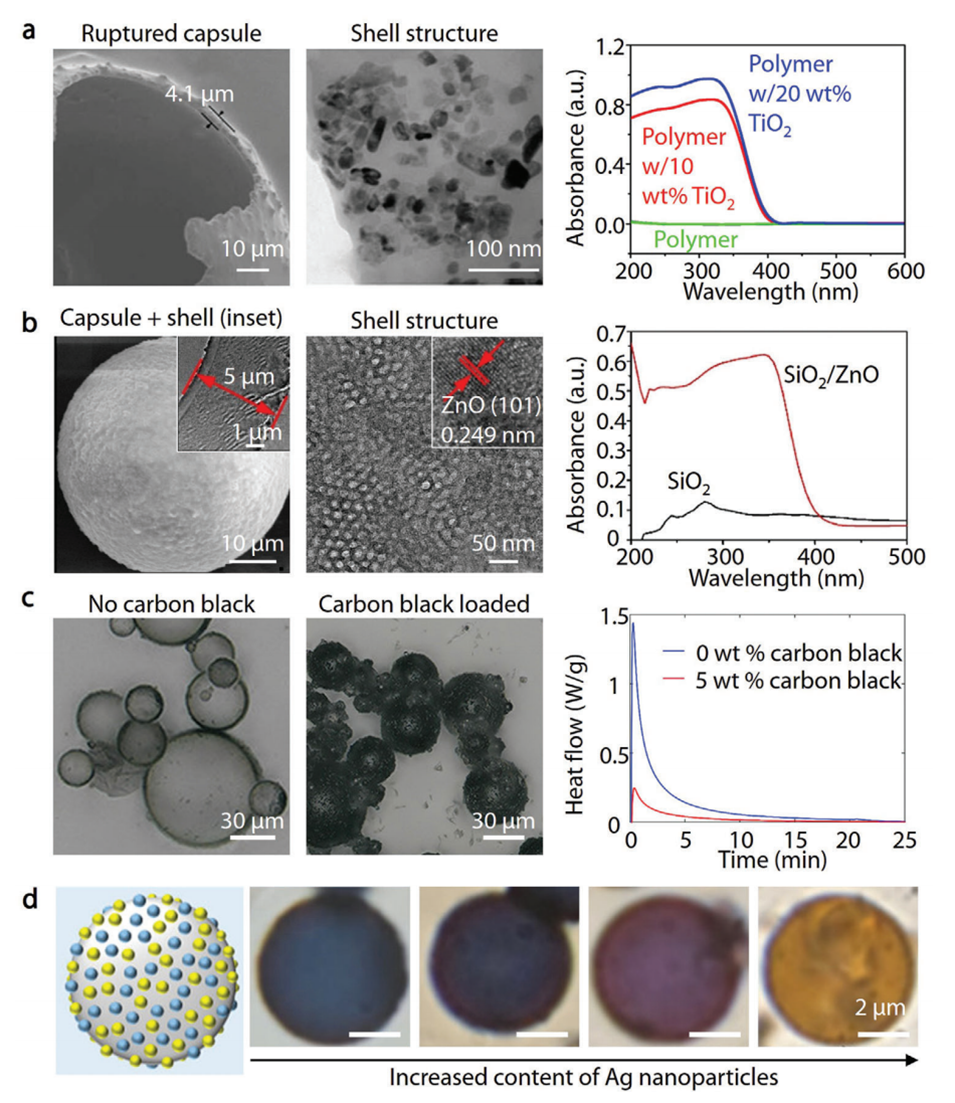
图7.光吸收纳米粒子掺入微胶囊用于光操纵。
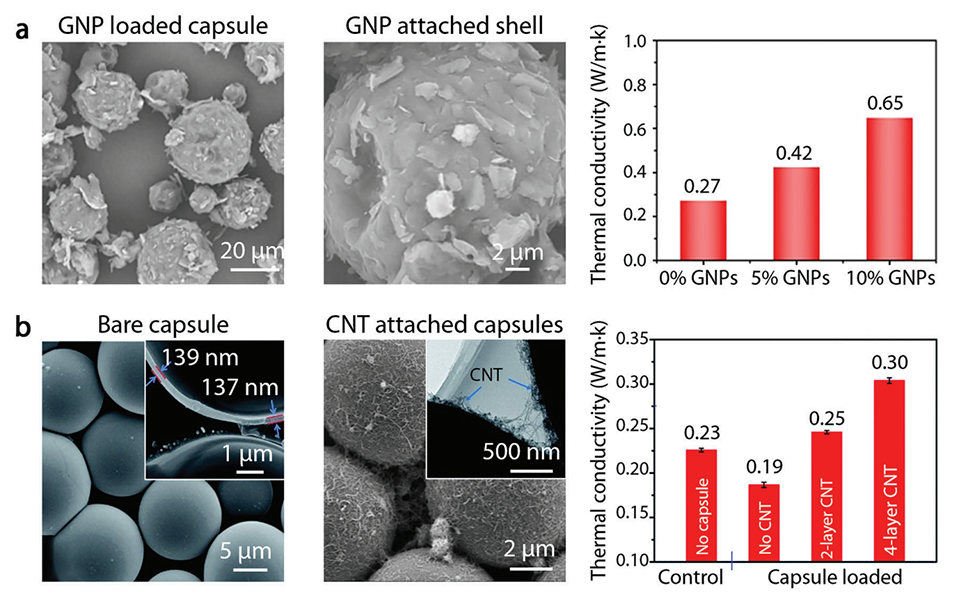
图8.载有导热纳米粒子的微胶囊,用于增强热能传递。
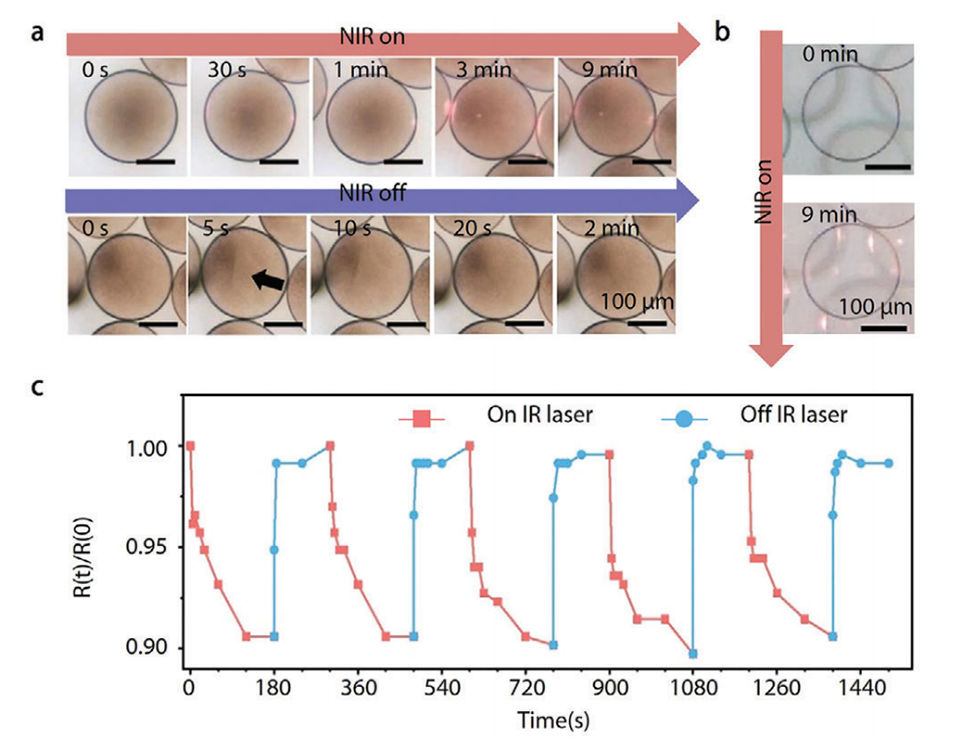
图9.由光热纳米颗粒实现动态收缩的微胶囊。
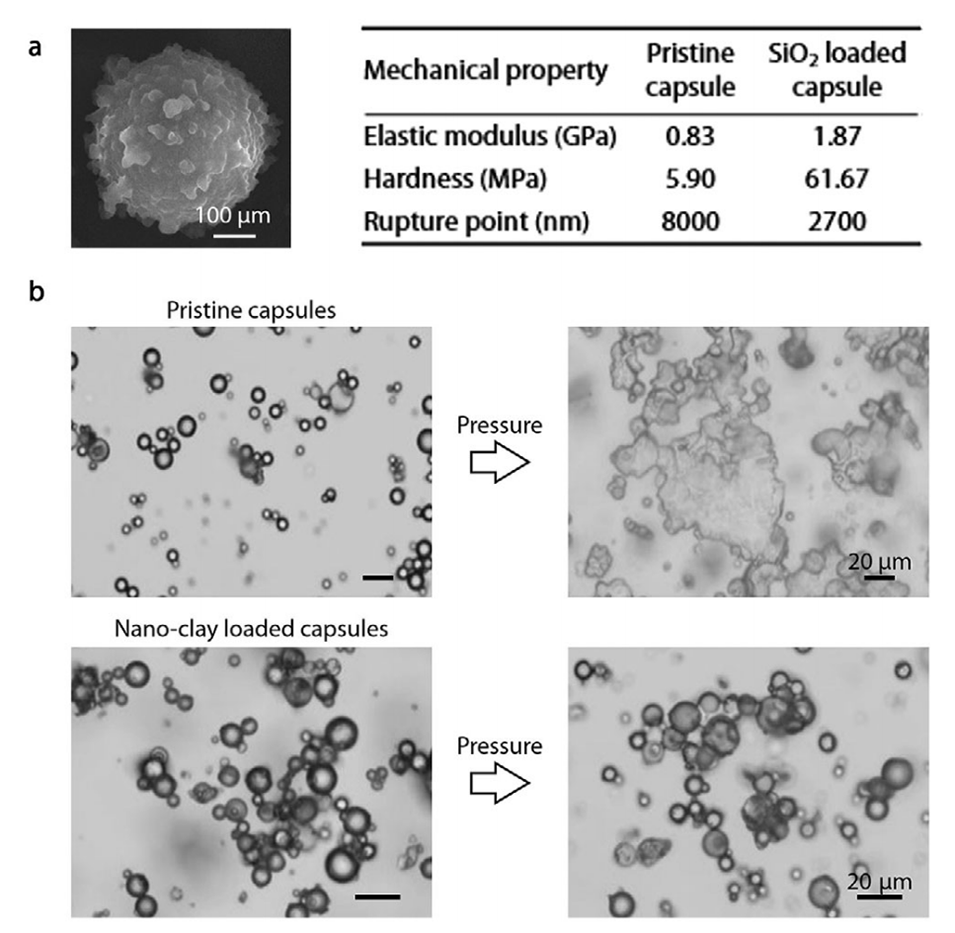
图10.结构纳米粒子结合微胶囊用于机械增强。
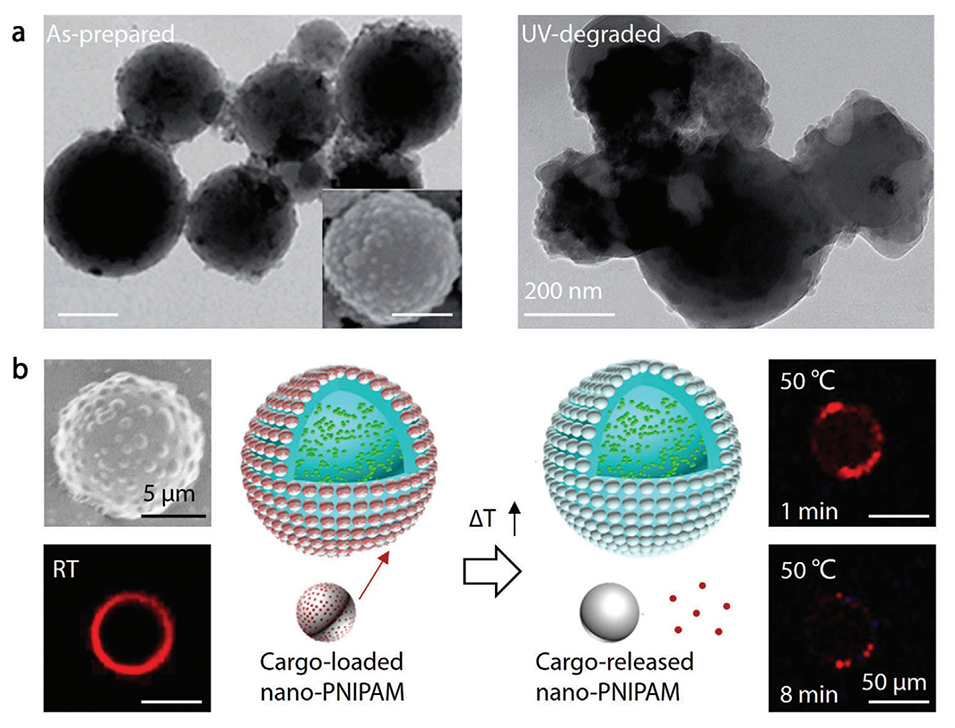
图11.由功能性纳米粒子引发的刺激触发有效载荷释放。
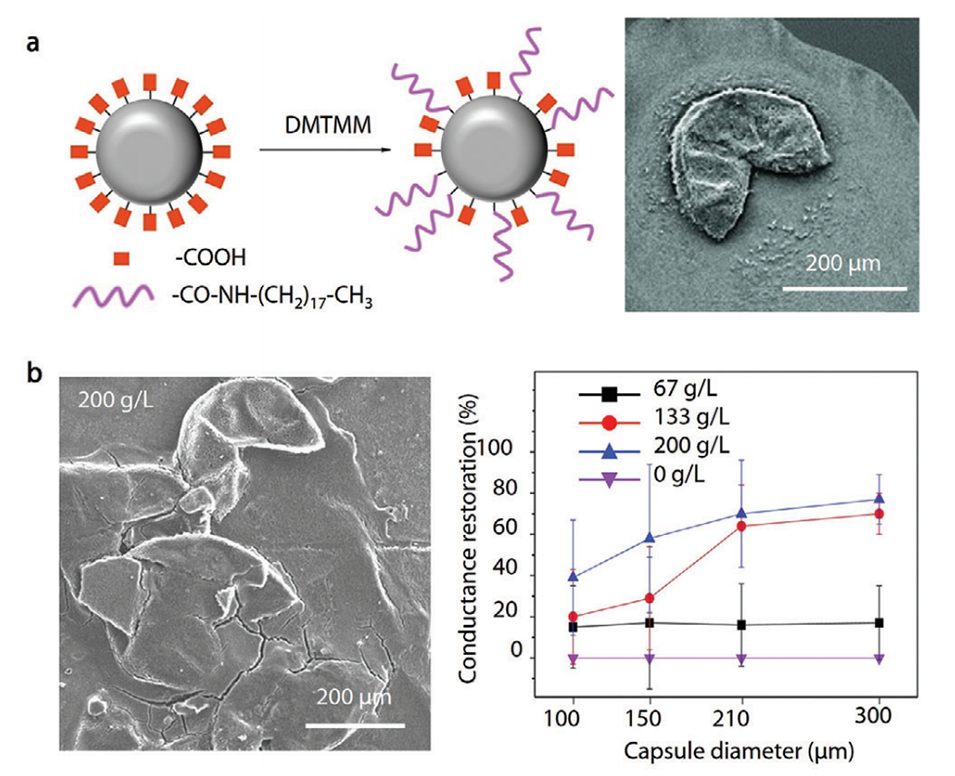
图12.通过按需释放封装的纳米颗粒来恢复电导率。
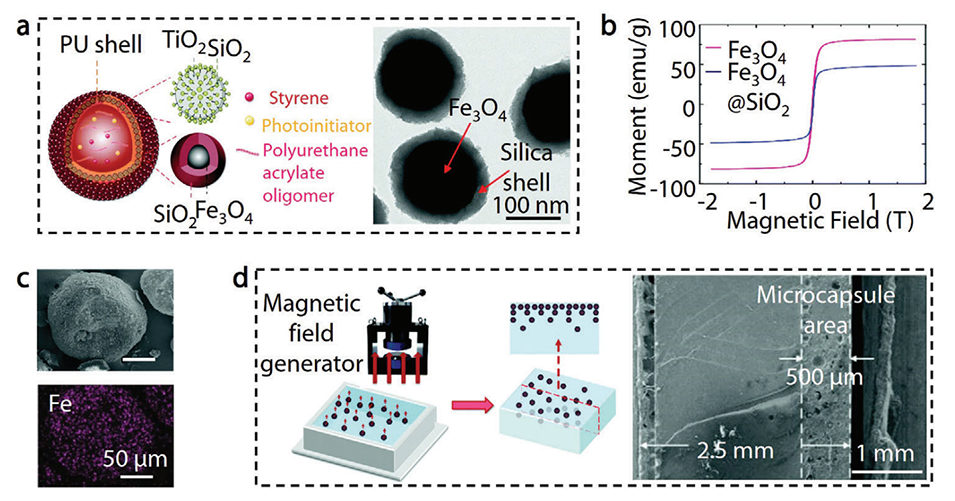
图13.磁性纳米粒子增强微胶囊的定向运动。

图14.解锁纳米粒子增强核壳微胶囊全部潜力的关键研究途径。
论文链接:https://doi.org/10.1002/smll.202311897














