背景:
癌症是威胁人类健康和生命的主要疾病之一,每年全球癌症死亡人数超过970万。尽管化疗是目前广泛应用的癌症治疗方法,成功挽救了数百万生命,但由于抗癌药物(如阿霉素)的高毒性,患者通常会经历严重的副作用。这主要是因为抗癌药物的小分子特性使其在体内快速扩散,加上传统药物递送系统(DDS)存在“爆发性释放”(burst release)现象,导致药物浓度突然升高。因此,开发一种能够实现药物持续及按需释放的新型DDS迫在眉睫,以最大限度减少副作用并维持化疗疗效。

导读:
近期,香港大学机械工程系王敏教授团队与中国科学院深圳先进技术研究院赵启龙副研究员合作,开发了一种新型药物递送系统(DOX@Au@MSs),利用生物可降解核壳微球包裹金纳米颗粒,实现阿霉素(DOX)的持续和光控释放,显著提升了化疗药物的安全性和有效性。相关研究以“Core–Shell Microspheres with Encapsulated Gold Nanoparticle Carriers for Controlled Release of Anti-Cancer Drugs”为题目,发表在期刊《Journal of Functional Biomaterials》上。
本文要点:
1、本研究针对化疗药物(如阿霉素,DOX)的细胞毒性引发的严重副作用问题,开发了一种新型核壳结构药物递送系统(DOX@Au@MSs)。
2、该系统采用聚乳酸-羟基乙酸共聚物(PLGA)构建核壳微球,包裹负载DOX的金纳米颗粒(AuNPs),实现了双重控释机制。
3、通过微球壳层的物理屏障作用,药物在21天内持续缓释;同时利用AuNPs的光热效应,可通过近红外光(NIR)远程触发药物释放。
4、实验表明,该系统不仅能维持72小时的长效肿瘤细胞杀伤效果,还可通过NIR精准调控药物的时空释放,有效避免了传统化疗的血液药物浓度骤升问题。
5、这种结合缓释与光控释放的策略显著提升了化疗安全性,为减少全身毒性副作用提供了新思路。
核壳微球(DOX@Au@MSs)采用同轴电喷雾技术(coaxial electrospraying)制备而成,具体步骤如下:
1.材料准备
内层液体:包含阿霉素(DOX)负载的金纳米颗粒(DOX@Au)。内层液体由DOX@Au纳米颗粒的悬浮液组成,具体配方通过调节DOX与AuNPs的比例实现。
外层液体:将聚乳酸-羟基乙酸共聚物(PLGA50/50)溶解于二氯甲烷(DCM)中,浓度为5%(w/v)。
2.同轴电喷雾参数
流速:内层液体流速为0.763 mL/h,外层液体流速为2.03 mL/h。外层流速较高以确保形成连续稳定的壳层结构。
电压:施加15 kV的高电压,通过电场力将液体拉伸成核壳结构的微球。
喷嘴:使用同轴喷嘴,内层液体通过内径较小的通道,外层液体通过外通道。
3.微球形成与后处理
微球收集:电喷雾过程中形成的液滴在电场中快速固化,形成核壳结构的微球,直径范围为2–5 μm。
冷冻干燥:微球在冷冻干燥机中处理2天,以彻底去除残留溶剂(如DCM)。
4.结构表征与验证
形貌分析:通过扫描电子显微镜(SEM)和透射电子显微镜(TEM)确认微球的核壳结构。
药物包封率:通过紫外-可见分光光度法(UV-Vis)测量未包封的DOX量,计算包封效率(最高达64.3%)。
5.关键工艺优化
参数匹配:电压与流速的协同调控是形成均匀核壳结构的关键。电压过高可能导致微球破裂,而流速失衡会导致核壳偏移或药物泄漏。
PLGA降解控制:PLGA壳层的水解速率(数天至数周)通过调节LA:GA比例和分子量实现,从而控制药物的缓释周期。
核壳微球的光热效应是否会对正常组织产生热损伤?
虽然金纳米颗粒在NIR光照射下会产生热量,但研究中使用的NIR光功率密度(2 W/cm²)和照射时间(5分钟)经过严格控制,仅在微球外壳局部产生热量,不会对周围正常组织产生显著热损伤。此外,通过优化微球的组成和结构,可以进一步降低热损伤的风险。
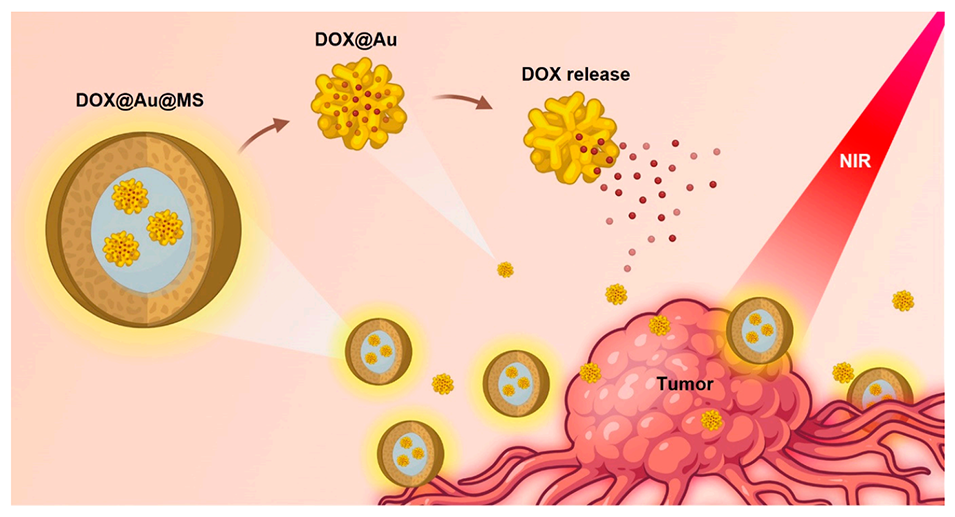
图1.示意图展示了DOX-Au@MSs的设计和形成,用于控制释放癌症药物和持久杀灭癌细胞。在近红外光(NIR)照射下,DOX@Au@MSs会因金纳米颗粒(AuNPs)的光热效应而破裂,随后释放DOX@Au,进而以时空可控的方式释放DOX。
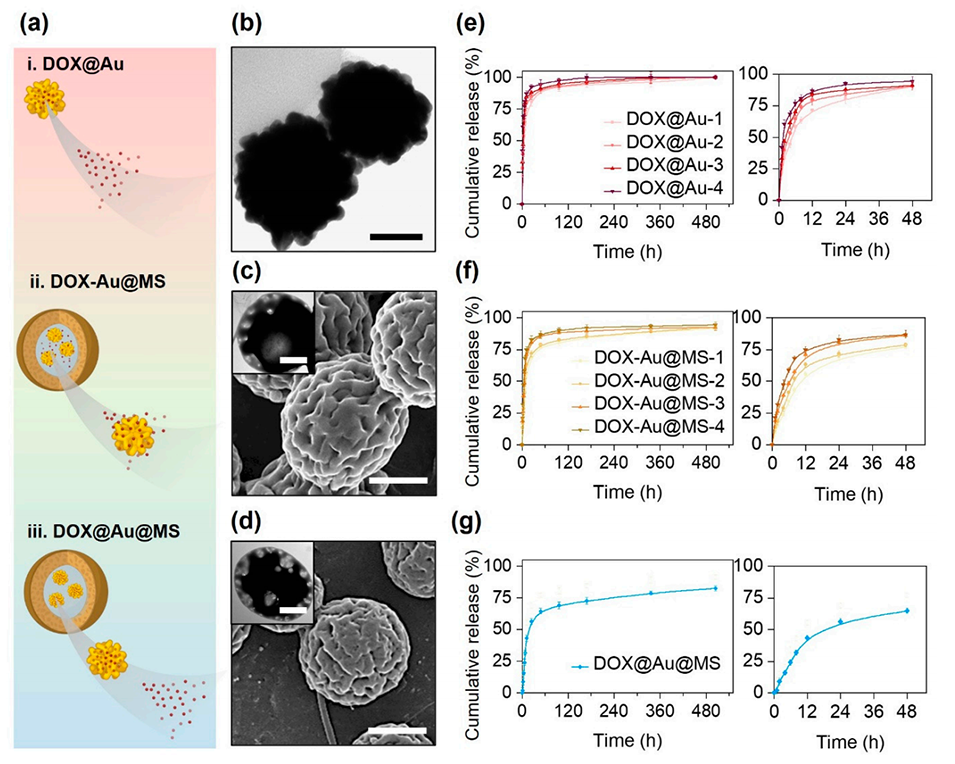
图2.不同类型载体中DOX的释放行为。
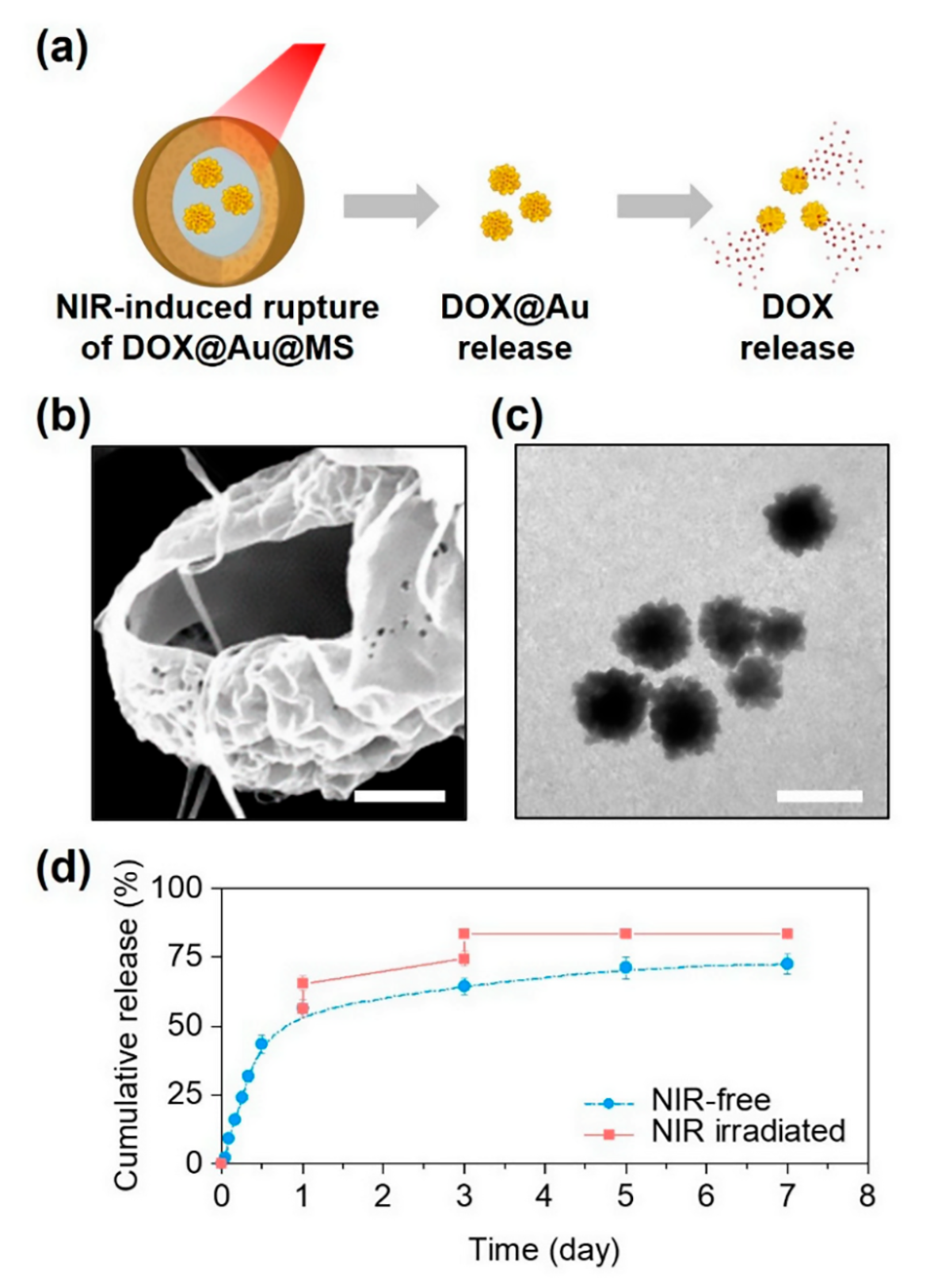
图3.近红外控制微球破裂和DOX释放。
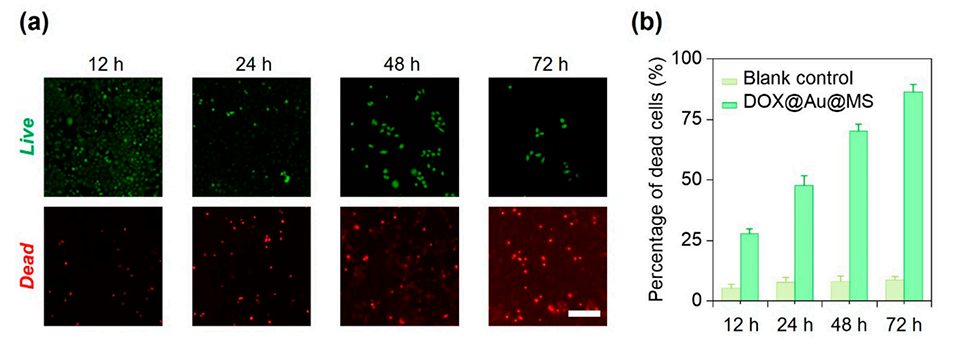
图4.DOX@Au@MSs体外抗癌性能。
论文链接:https://doi.org/10.3390/jfb15100277














