
文献导读:
炎症和软骨退化是骨关节炎(OA)治疗中的关键挑战。在减轻炎症和活性氧的不利影响的同时实现持续的药物疗效仍然是一个重大挑战。近期,南方医科大学第十附属医院(东莞市人民医院)蔡立民教授、Yikuan Du、Xiong Lu等研究人员与西南交通大学谢超鸣教授团队合作,开发了一种新型注射用硫酸软骨素微球(CM@pGM)。该微球封装含葛根素(PA)的没食子酸-镁金属有机框架(GA-Mg MOF),通过改善关节炎症微环境和促进软骨修复,显著抑制炎症及软骨退变,延缓骨关节炎进程,展现出良好的治疗潜力。相关研究以“Injectable Chondroitin Sulfate Microspheres with Gallic Acid-Magnesium MOF for Anti-Inflammatory and Cartilage Degeneration Alleviation in Osteoarthritis Treatment”为题目,发表在期刊《ACS Applied Materials & Interfaces》上。
本文要点:
1、本研究开发了一种基于硫酸软骨素微球的新型药物递送系统,用于缓解骨关节炎(OA)的炎症与软骨退变问题。
2、利用微流控技术制备双功能可注射硫酸软骨素微球(CM@pGM),在紫外光下进行交联,通过物理网络位阻和非共价相互作用将pGM锚定在微球内。
3、在降解过程中,GA和Mg2+离子从pGM中释放出来,改善了关节腔的炎症微环境并减轻了氧化应激。Mg2+和PA的持续释放支持软骨细胞合成代谢并促进软骨修复。
4、体外研究证实,注射微球可将药物释放期延长至2周以上。体内实验表明,CM@pGM显着减少骨赘形成,减轻关节软骨的退行性变化,并延缓OA进展。
5、综上所述,CM@pGM作为改善炎症微环境、缓解氧化应激和促进软骨修复的药物递送平台,在OA治疗方面具有巨大潜力。
该药物释放系统为何选择没食子酸-镁金属有机框架(GA-Mg MOF)作为药物载体,其核心优势体现在哪些方面?
1、抗氧化和抗炎特性:
GA是一种富含还原基团的抗氧化剂,能有效清除关节腔内的活性氧(ROS),减轻氧化应激对软骨细胞的伤害,从而改善关节炎症微环境。同时,镁离子(Mg2+)可通过抑制M1型巨噬细胞极化、下调促炎因子的表达(如IL-1β和TNF-α),进一步减轻炎症。
2、药物负载及缓释能力:
GA-Mg MOF的多孔结构提供了较大的比表面积(37.3m2/g)和平均孔径(17.1nm),从而提升了药物的负载能力。此外,该框架通过物理网络屏障及非共价相互作用,能够实现长效缓释(超过14天),有效延长药物在关节腔内的活性时间。
3、提升活性成分生物利用度:
GA-Mg MOF能显著改善关键成分葛根素(PA)的生物利用度,解决其在体内溶解性差、代谢快的问题。此外,通过缓释作用,Mg2+和PA协同促进软骨细胞外基质(如Col2a1和ACAN)的合成。
4、软骨修复能力:
镁离子通过上调软骨细胞中HIF-1α的表达,使软骨细胞能更好地适应氧化应激和缺氧的关节微环境,从而促进软骨基质的生成和修复。
因此,GA-Mg MOF的抗氧化性能、优异的药物缓释特性和抗炎作用使其成为解决骨关节炎治疗中炎症控制及药物持续释放难题的理想选择。
CM@pGM的合成过程如下:
1.硫酸软骨素(Chs)改性(制备ChsMA)
将1g硫酸软骨素溶解在25mL的PBS缓冲液中,在37℃水浴下加热溶解。
在避光条件下,通过微量注射泵以16.9mL/h的速度加入8.45mL甲基丙烯酸酐,同时搅拌反应。
用10M NaOH将溶液pH调至8,搅拌反应2小时,并在4℃静置24小时。
加入无水乙醇生成白色絮状沉淀,收集后用无水乙醇清洗3次,溶解在PBS中,最后冻干得到ChsMA。
用1H-NMR确认甲基丙烯酰胺基团的引入。
2.GA-Mg(GM)MOF合成及药物负载
将2g MgCl2溶解于100mL双蒸水(ddH2O)中,室温条件下搅拌。
加入7.6g没食子酸(GA),形成大量白色沉淀。
用10M KOH调节溶液pH至8,沉淀逐渐溶解,溶液变为棕色。
将溶液转移至高压反应器,在120℃加热24小时。
离心(10,000rpm,15分钟)收集产物,用ddH2O清洗3次,冻干得到GM。
制备药物负载的GM(pGM):在上述MgCl2溶液中加入50μM/mL葛根素(PA),与GA-Mg共同结晶,形成负载PA的GM(pGM)。
用SEM观察GM形貌,EDS分析GM的元素组成,BET分析比表面积(37.3m2/g)和孔径分布(平均孔径17.1nm)。
3.CM@pGM微球的制备
液滴生成:
水相:将100mg ChsMA(10%)、10mg pGM(1%)与2.5mg光引发剂(LAP, 0.25%)溶解于1mL ddH2O。
油相:用10% Span 80乳化剂混合肉豆蔻酸异丙酯。
使用微流控芯片通过剪切力作用生成液滴,设置油相和水相流速比为15:1。
UV交联与清洗:
收集液滴后,用紫外光照射2分钟对微球交联。
交联后的微球分别用无水乙醇和ddH2O清洗3次,去除未反应物质,最后冷冻干燥。
微球表征:
用光学显微镜观察微球的形态和大小,结果显示微球直径为185.8±9.3μm,符合注射要求。
SEM显示pGM负载微球表面呈现轻微的突起形态,EDS确认镁离子的均匀分布。
4.性能测试
降解与释放曲线:
将CM@pGM置于PBS溶液中,定期检测所释放的Mg2+浓度(ICP-AES)和PA浓度(UV分光光度法)。结果显示Mg2+的释放超过14天。
摩擦系数(COF)降低测试:
使用多功能材料测试仪(UMT-3),与PBS的COF(0.09)相比,CM@GM将其降低至0.04,而CM@pGM进一步降低到0.05,展现滚珠润滑效应。
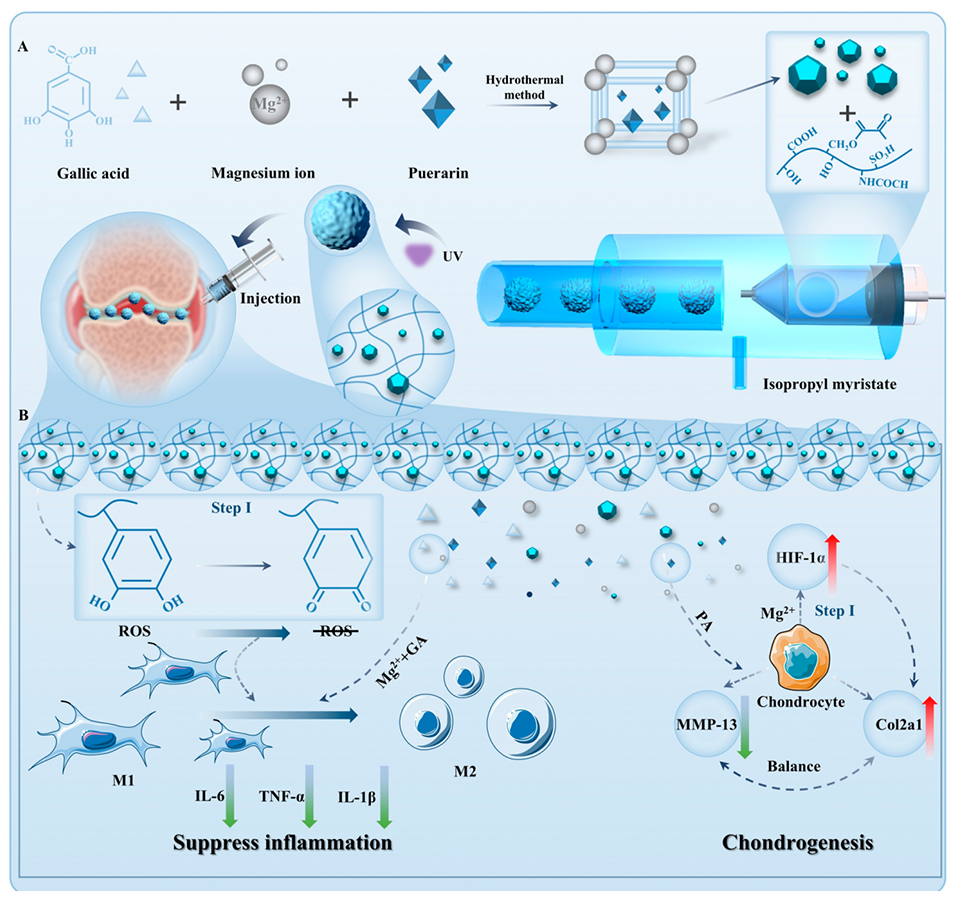
图1.CM@pGM的生产过程示意图及其在骨关节炎(OA)治疗中的应用。(A)CM@pGM的制备过程。(B)CM@pGM在治疗OA大鼠时对关节腔的生物学效应。
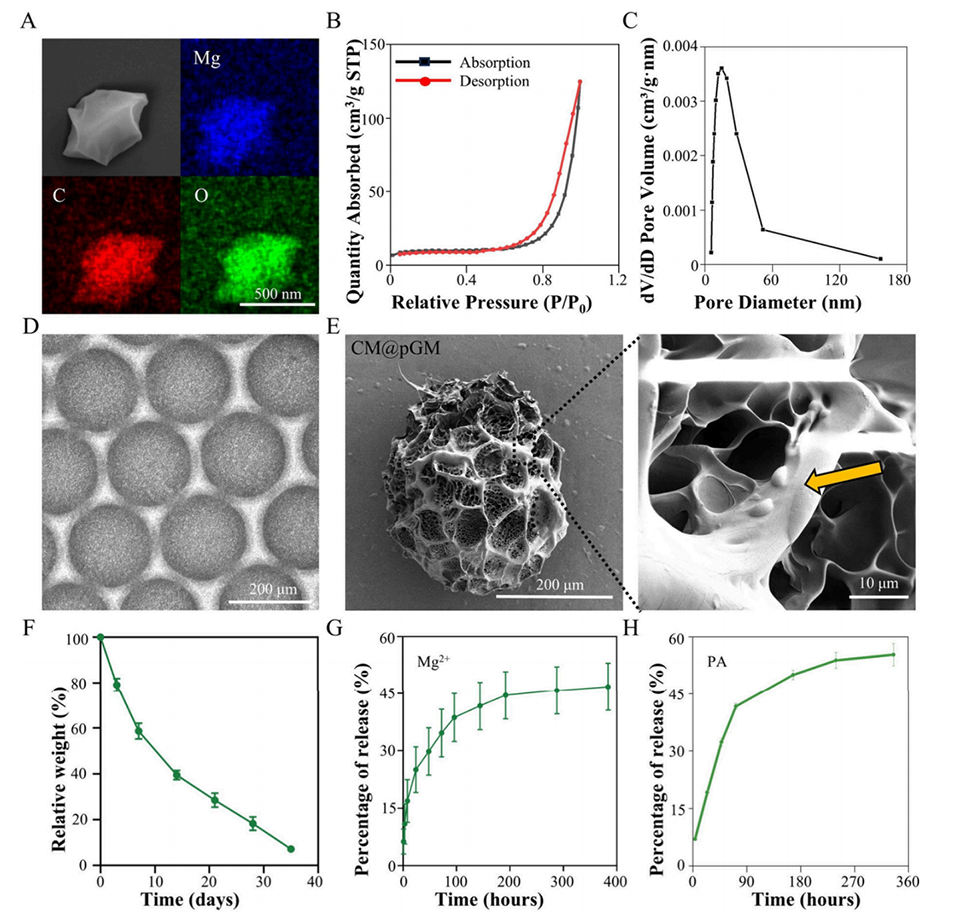
图2.GA-Mg和CM@pGM的特性。(A)GM的扫描电子显微镜(SEM)图像及其元素分析。(B)GM在77K条件下的氮气吸附等温线。(C)GM的孔径分布。(D)CM@pGM的明场显微镜图像。(E)CM@pGM的扫描电子显微镜图像及其元素分析。(F)CM@pGM的降解速率。(G)Mg2+的累积释放曲线。(H)PA的累积释放曲线。样本量n=3。
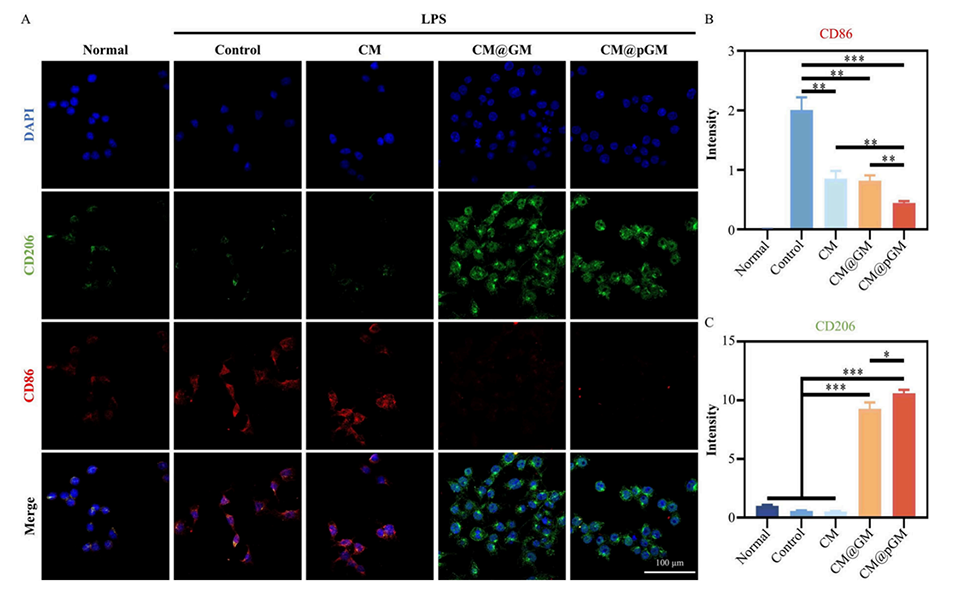
图3.CM@pGM的抗炎特性。(A)经CM@pGM处理后,LPS诱导的巨噬细胞中CD206和CD86表达的共聚焦扫描显微镜(CLSM)图像。(B)CD86的荧光强度定量分析。(C)CD206的荧光强度定量分析。样本量n=3,*p<0.05,**p<0.01,***p<0.001。
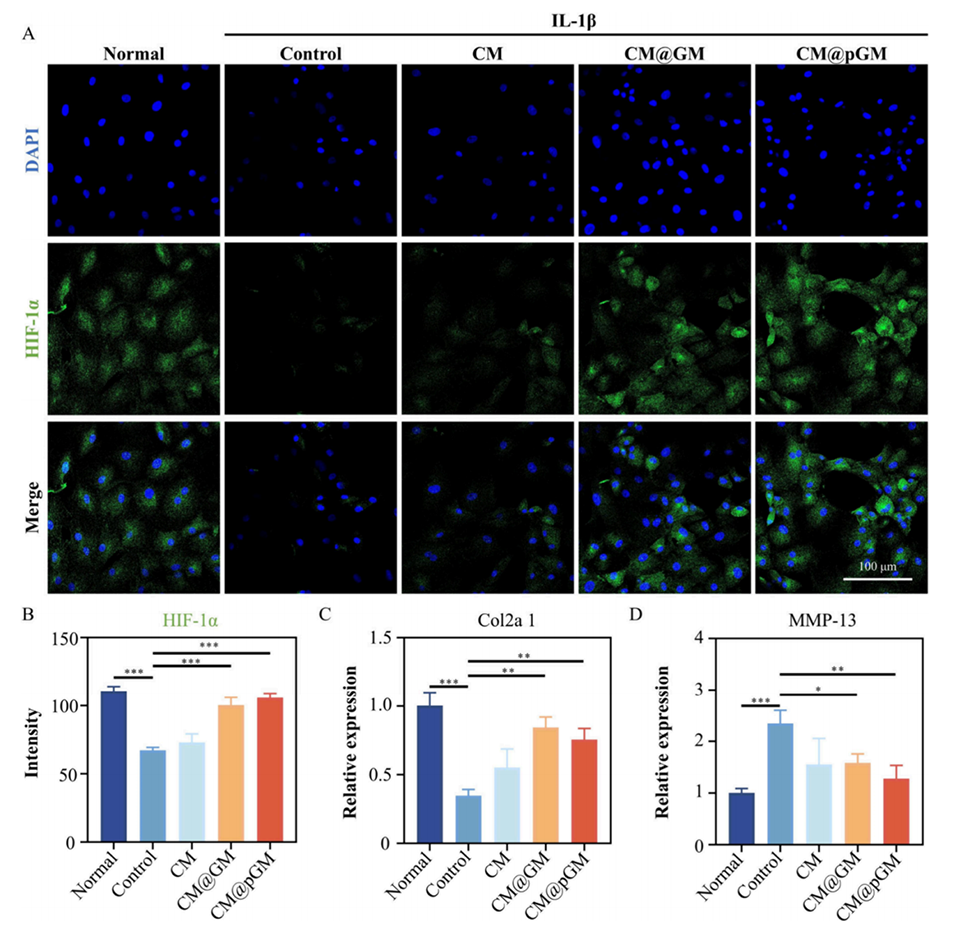
图4.CM@pGM调节软骨代谢平衡。(A)经CM@pGM处理后,IL-1β诱导的软骨细胞中HIF-1α表达的CLSM图像。(B)HIF-1α的荧光强度定量分析。(C)Col2a1水平的RT-PCR检测结果。(D)MMP-13水平的RT-PCR检测结果。样本量n=3,*p<0.05,**p<0.01,***p<0.001。
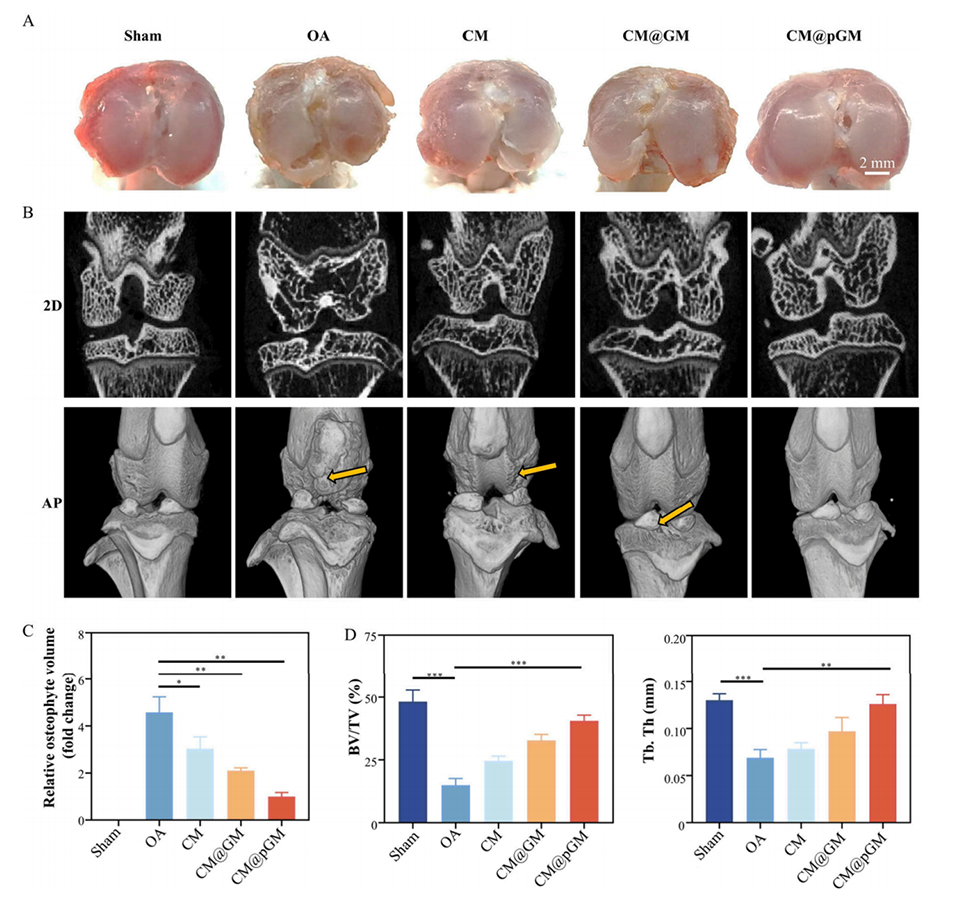
图5.CM@pGM在术后8周对大鼠骨赘负荷及软骨下骨改变的改善。
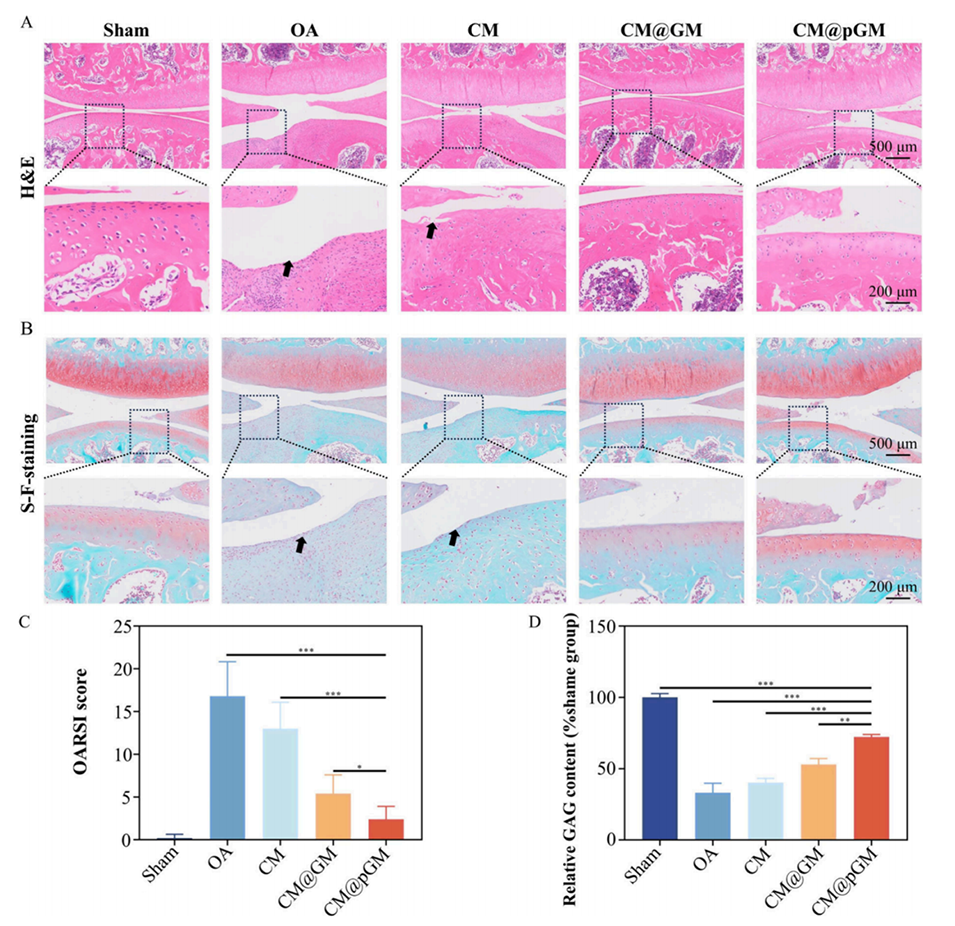
图6.CM@pGM在治疗OA大鼠4周后的组织学评估。
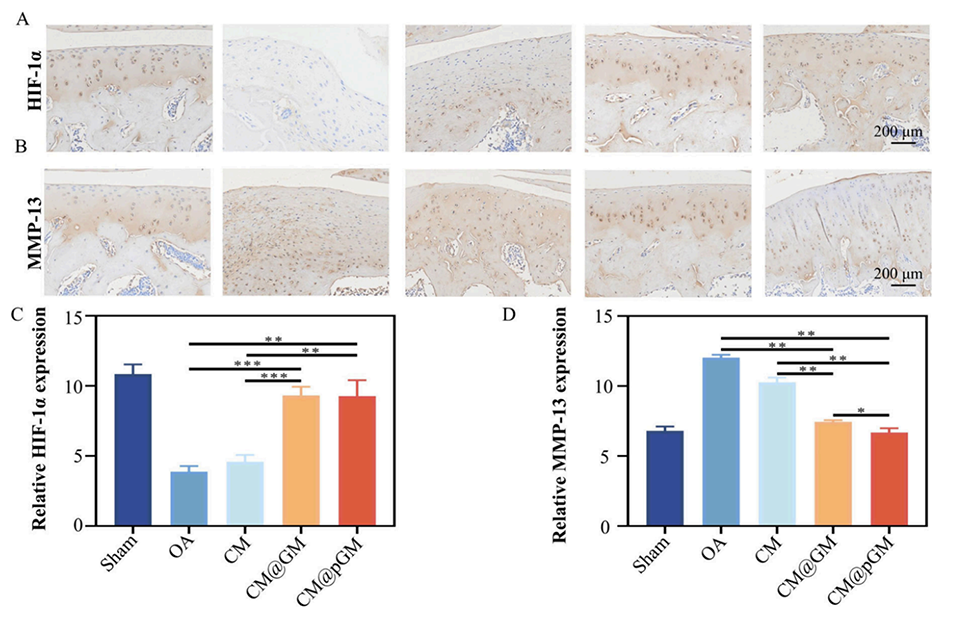
图7.免疫组化染色。(A)HIF-1α蛋白免疫组化染色的代表性软骨图像。(B)MMP-13蛋白免疫组化染色的代表性软骨图像。(C)各组HIF-1α的相对含量。(D)各组MMP-13的相对含量。样本量n=3,*p<0.05,**p<0.01,***p<0.001。
论文链接:https://doi.org/10.1021/acsami.4c22415














