
一、概述
蛋白质药物在现代医学中占据重要地位,但由于蛋白质不能有效地穿过质膜,因此蛋白质治疗药物仅限于细胞表面或血清中的靶标配体。脂质纳米颗粒(LNP)作为一种有效的药物递送载体,已被成功应用于mRNA疫苗(如新冠疫苗)的开发。然而,将蛋白质封装在LNP中并实现高效细胞内递送仍然是一个技术难题。近期,乔治亚大学的Richard B. Meagher等在《Communications Materials》上发表了一项突破性研究,提出了一种利用微流控技术将蛋白质高效封装在LNP中的方法,为蛋白质药物的细胞内递送提供了新的解决方案。
该研究的核心假设是,大多数蛋白质在生理条件下表现为两性离子化多聚阳离子,能够与阴离子脂质结合,从而通过微流控技术实现蛋白质在LNP中的高效封装。研究团队通过一系列实验验证了这一假设,并展示了封装后的蛋白质在细胞内的高效传递和功能保留。
二、实验方法
研究中采用微流控组装技术实现蛋白质的封装。具体而言,研究人员将蛋白质溶解在酸性或中性缓冲液(pH 5.5的乙酸缓冲液或pH 7.0的PBS)中,而脂质溶解于两种不同的有机溶剂混合物中:1#为三氯甲烷(TCM):乙醇(EtOH)1:1(体积比);2#为三氟乙醇(TFE):甲醇(MeOH)4:1(体积比)。封装所使用的脂质混合物以50 mol%的阴离子磷脂DMPG为主,并配以其他辅助脂质,其成分与现代mRNA-LNP疫苗中的脂质类似,但用DMPG替代阳离子脂质SM102。蛋白质与脂质的质量比为1:20,在微流控包装后,立即将LNP通过透析去除有机溶剂并置于中性缓冲液中,从而完成脂质膜的闭合结构,形成稳定的纳米颗粒。
实验测试了分子量从28 kDa到148 kDa、等电点(pI)范围为5.3至8.7的6种不同蛋白质,包括三种荧光蛋白(mCherry、EBFP2、Venus)、牛血清白蛋白(BSA)以及两种单克隆抗体(Trastuzumab和IgG)。封装后,通过多种表征方法验证颗粒的物理化学特性,包括透射电子显微镜(TEM)、动态光散射(DLS)和流式纳米颗粒分析仪(NanoFCM)。此外,通过荧光显微镜和过滤实验,评估蛋白质的封装效率以及未封装蛋白的去除效果。
为验证封装蛋白的细胞内递送性能,实验使用了人肺腺癌细胞(A549)和乳腺癌细胞(SKBR3)。细胞分别与封装蛋白的LNP(EP-LNP)和游离蛋白孵育。荧光显微镜用于观察荧光蛋白在细胞内的分布情况,同时抗体的功能性通过检测HER2受体结合能力得以验证。
三、实验结果
实验结果显示,使用阴离子磷脂DMPG的脂质混合物显著提高了蛋白质的封装效率,封装效率在pH 5.5和7.0条件下普遍达到70%-90%,其中荧光蛋白mCherry在pH 5.5条件下的封装效率最高,可达98.1%。相比之下,当使用阳离子脂质(如SM102)取代DMPG时,封装效率大幅下降,不足1%。同时,实验还表明,所封装的蛋白质在4°C条件下存储数月后,依然能够保持生物活性,例如荧光蛋白的荧光信号强度无显著下降,且封装的Trastuzumab保持了其结合HER2受体的能力。这进一步证实了在有机溶剂TFE:MeOH(4:1)中制备的LNP能够有效避开蛋白的变性问题。
在细胞递送实验中,EP-LNP表现出显著的细胞内递送效率。在A549细胞和SKBR3细胞中,封装蛋白的荧光信号显著强于未封装的游离蛋白,表明LNP能够高效地穿透细胞膜并将蛋白质递送进入胞质。此外,封装的Trastuzumab在HER2高表达的SKBR3细胞中,能够与HER2受体结合且诱导了明显的多泡体表型,显示其在细胞内仍然具有良好的功能性;而在HER2低表达的A549细胞中,无特异性结合,进一步验证了其靶向性。
四、结语
该研究通过微流控技术实现了蛋白质在脂质纳米颗粒中的高效封装,并证明了封装后的蛋白质能够高效进入细胞并保持功能。这一技术突破为蛋白质药物的细胞内递送提供了新的可能性,有望推动蛋白质治疗在癌症、心血管疾病、代谢性疾病等多个领域的应用。未来,研究人员将进一步探索不同阴离子脂质对蛋白质封装效率的影响,并优化LNP的组成和制备条件,以实现更高效的蛋白质药物递送。
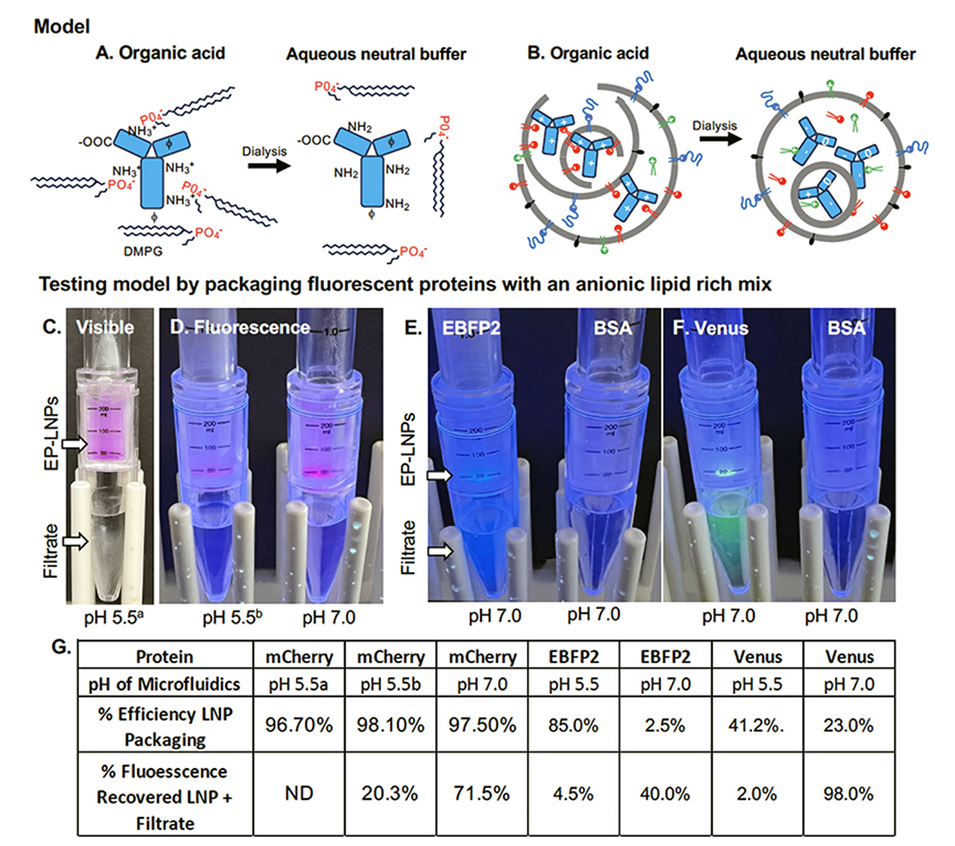
图1.通过微流控方法将蛋白质封装到脂质纳米颗粒中的模型及初步实验结果。
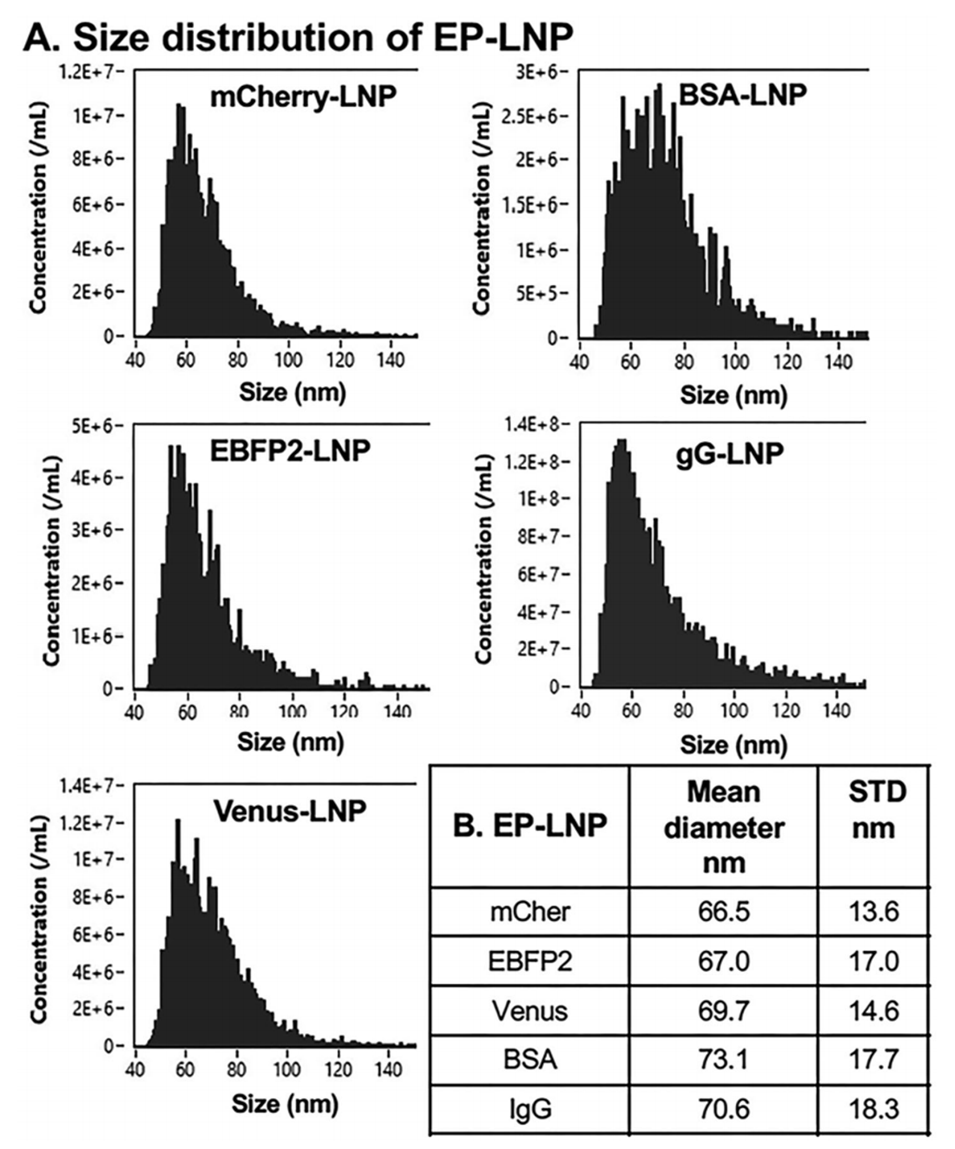
图2.EP-LNPs的尺寸分布。
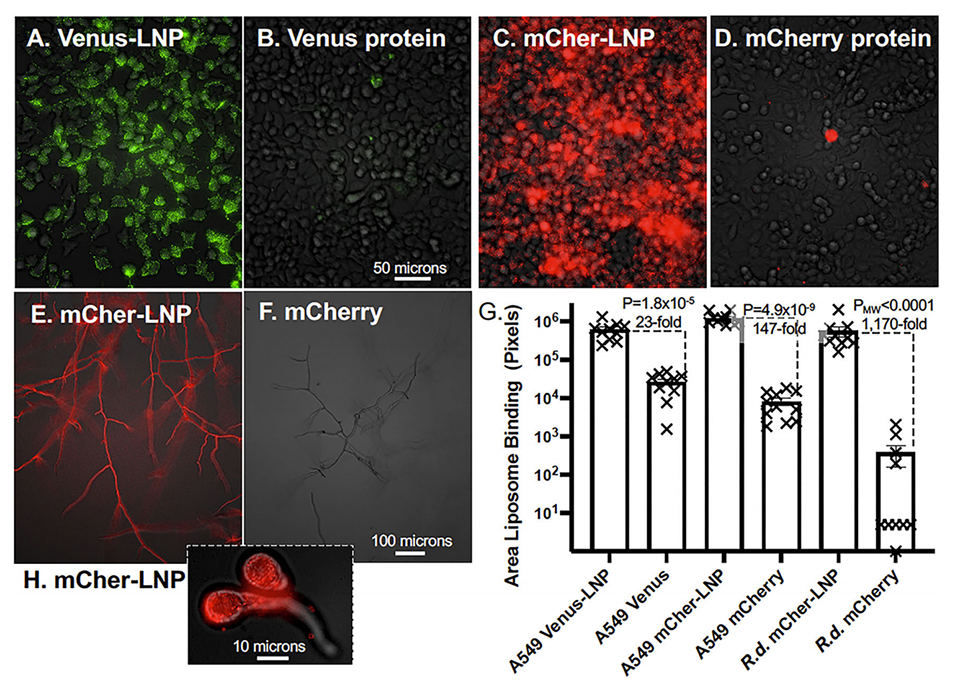
图3.用荧光EP-LNP培养A549肺癌细胞和真菌病原体R.delemar。
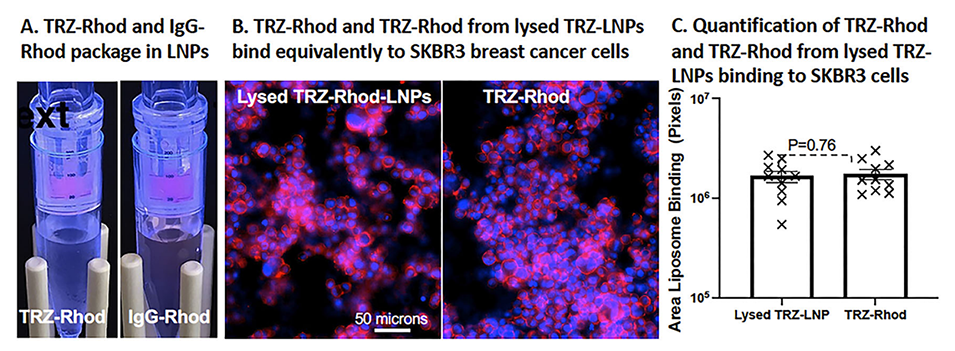
图4.Trastuzumab抗体经TRZ-LNPs封装后仍保持其活性。
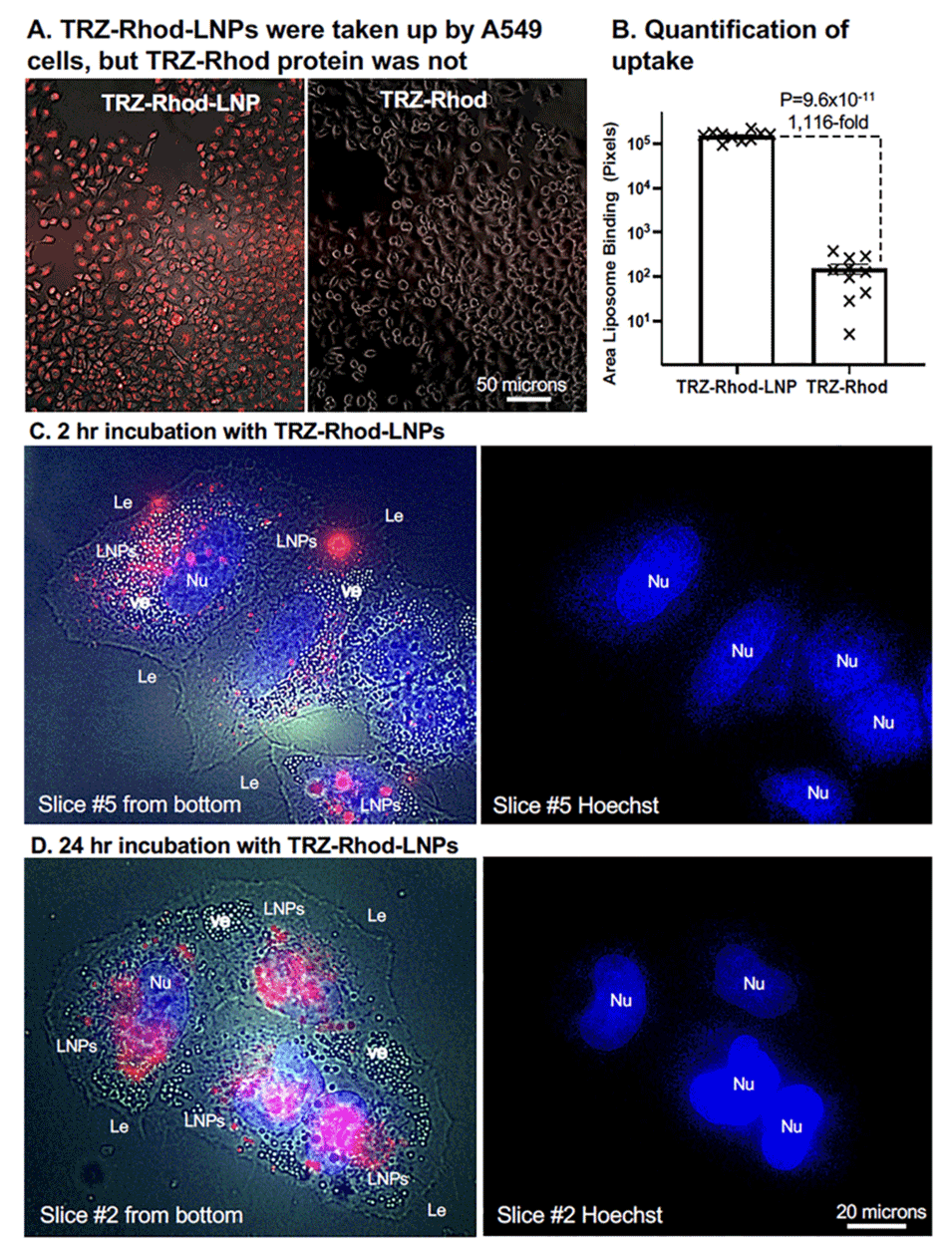
图5.展示了HER2阴性A549细胞与TRZ-Rhod-LNP和游离TRZ-Rhod蛋白共孵育后的荧光显微镜图像。结果显示,TRZ-Rhod-LNP能够被细胞高效摄取并进入细胞质,而游离的TRZ-Rhod蛋白几乎无法进入细胞。
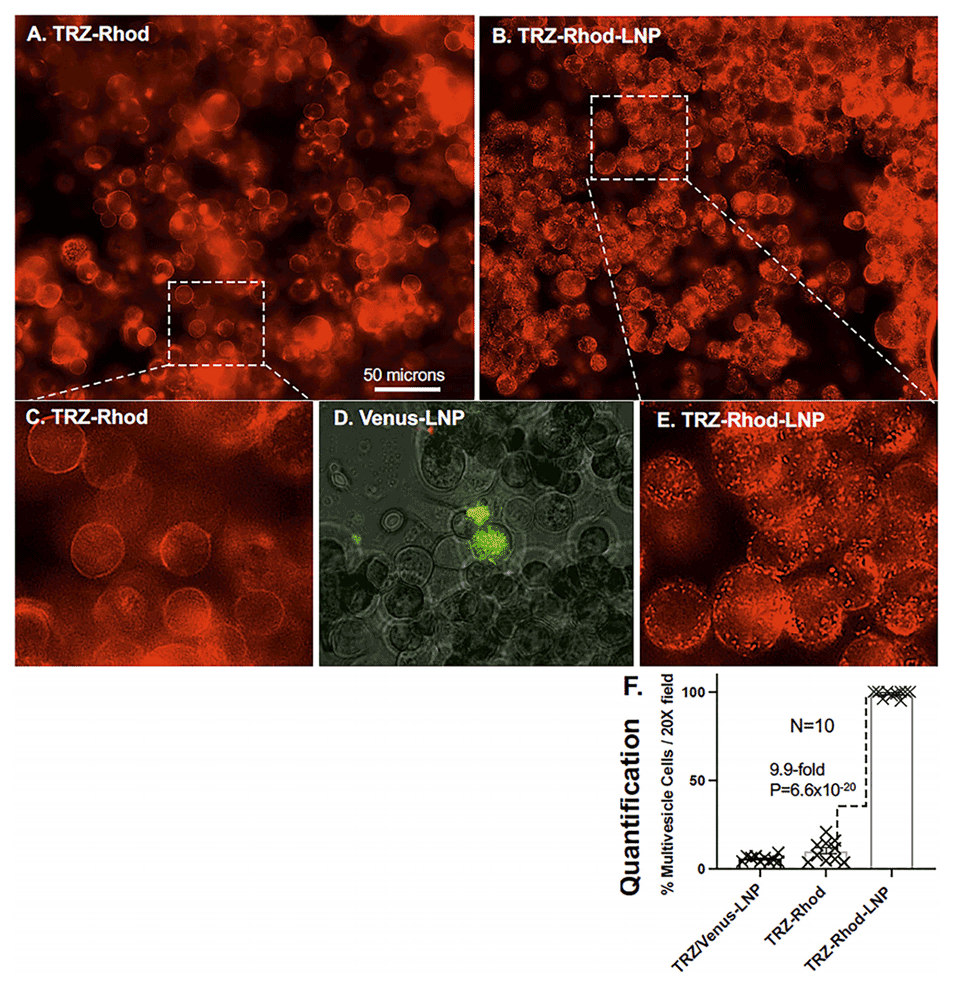
图6.展示了HER2阳性SKBR3细胞在饥饿条件下与TRZ-Rhod和TRZ-Rhod-LNP共孵育后的多囊泡表型。结果显示,TRZ-Rhod-LNP处理的细胞表现出明显的多囊泡表型,而TRZ-Rhod处理的细胞则几乎没有这种表型。
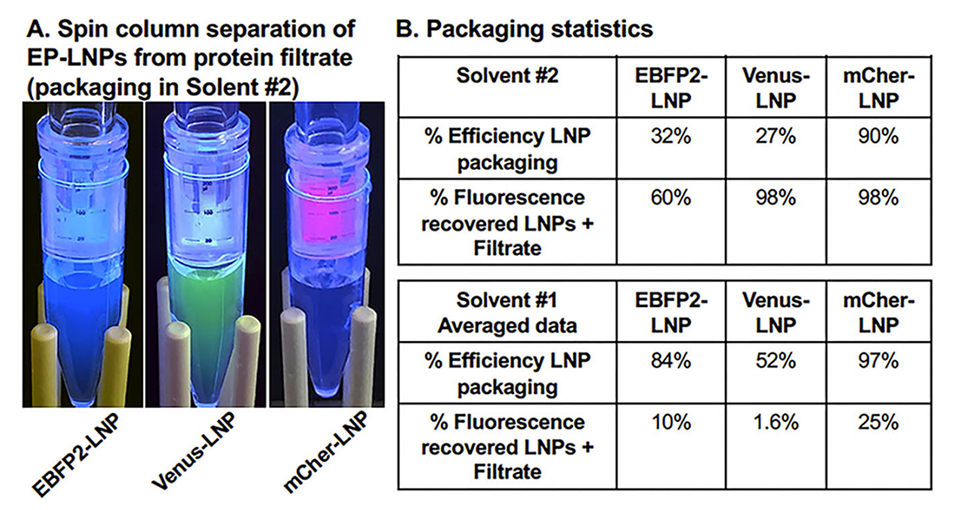
图7.在溶剂#2中制备脂质混合物时,三种荧光蛋白在LNP中的荧光回收率更高。
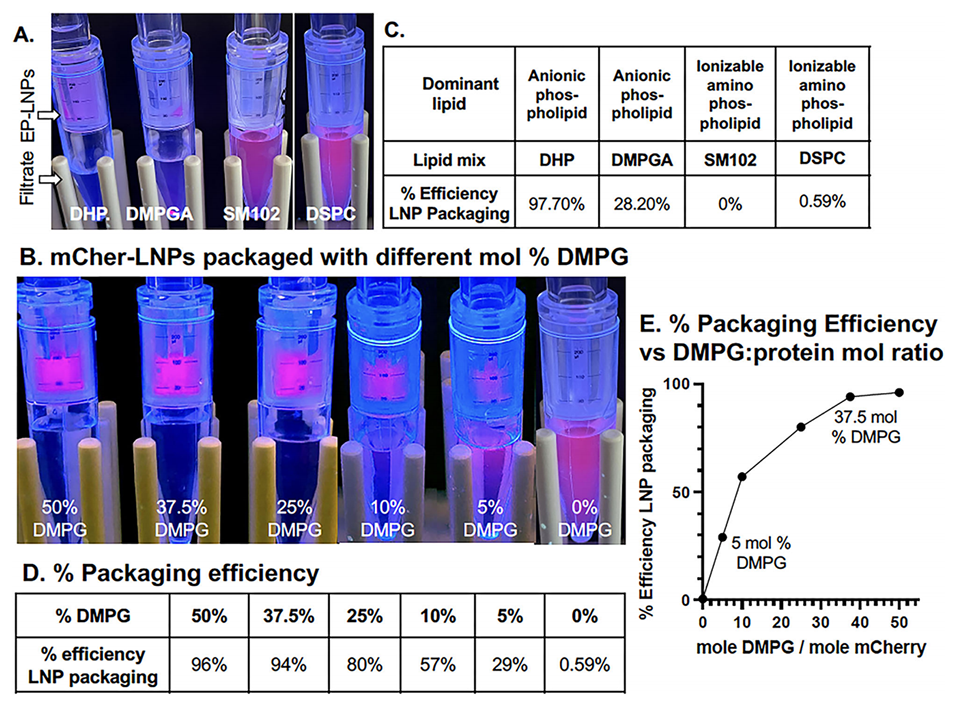
图8.蛋白质包装依赖于阴离子磷脂,而不是可电离的阳离子氨基磷脂。
论文链接:https://doi.org/10.1038/s43246-025-00749-8














