
导读:
脂质体因其多功能性、生物相容性和生物可降解性,成为药物递送领域中研究最为广泛的纳米载体之一。近期,有研究人员利用微流控技术制备了果胶涂层阳离子脂质体,通过优化果胶/脂质体重量比和流速比等关键参数,实现了均匀包覆,显著提升了其稳定性和粒径均一性,为口服药物递送系统提供了高效、稳定的新型载体。相关研究以“Microfluidic fabrication of pectin coated liposomes for drug delivery”为题发表于期刊《Drug Delivery and Translational Research》上。
本文要点:
1、本研究利用微流控技术制备了果胶包覆的阳离子脂质体,以优化口服药物递送系统。
2、通过系统调整工艺参数,确定果胶与脂质体的最佳重量比为0.7,微流体流速比为2:1。
3、结果表明,涂层脂质体的粒径至少是未涂层脂质体的三倍,表面电荷转变为强负电荷,表明果胶已完全覆盖颗粒。
4、进一步的微观表征表明,果胶形成了聚合物网络,脂质体在其中分散或附着。
5、稳定性研究表明,果胶涂层脂质体在储存期间保持稳定,未出现涂层位移。
6、综上,微流体技术是一种有效的果胶涂层脂质体制备方法,具有易于调整工艺参数、可扩展性强和成本低廉的优点。此外,果胶可以为脂质体提供保护特性,尤其是在口服药物递送期间。
果胶包覆脂质体的制备过程如下:
1、脂质体制备:
微流控法:阳离子脂质(DDA和MMG)溶解于乙醇,与5 mM醋酸缓冲液(pH 4.5)在5通道微流控芯片(5-way input chip,封闭2个入口)中混合,流速比(FRR)为15:1(缓冲液:脂质乙醇溶液),最终脂质浓度为2.5:0.5 mg/mL(DDA:MMG),残留乙醇6.25%。
传统法:脂质通过薄膜水化法(乙醇蒸发后水化)结合高剪切混合(26,000 rpm)制备,脂质浓度为3.75:0.75 mg/mL(DDA:MMG)。
2、果胶溶液配制:
将不同结构特性的果胶(高甲氧基果胶LM、低甲氧基酰胺化果胶LMA和高甲氧基果胶HM)溶解于pH 4.5的醋酸钠缓冲液,初始浓度为1%(w/w),稀释后工作浓度为0.1%或0.15%(即1 mg/mL或1.5 mg/mL)。
3、微流控包覆:
设备:采用Dolomite微流控系统,使用5通道输入芯片(初始优化)或人字形混合芯片(增强混合)。
参数:果胶溶液(连续相)与脂质体(分散相)的流速比(FRR)为2:1、3:1、4:1、5:1,总流速(TFR)3–6 mL/min。优化条件为果胶/脂质体重量比0.7(对应FRR 2:1)。
4、后处理与表征:
动态光散射(DLS):测量粒径(Z-average)、PDI和Zeta电位(Zetasizer Nano ZS)。
形态分析:冷冻透射电镜(cryo-TEM)和原子力显微镜(AFM)观察包覆结构。
稳定性测试:4°C储存28天,监测粒径和Zeta电位变化。
果胶包覆脂质体相比传统脂质体的优势包括:
1、增强稳定性:
包覆后粒径增至未包覆脂质体的至少三倍(例如LM-果胶包覆粒径965 nm vs.未包覆220 nm),PDI保持≤0.3。
储存28天后粒径和Zeta电位无显著变化,表明包覆层未脱落。
2、表面电荷调控:
未包覆脂质体为阳离子(Zeta电位未提供具体值),包覆后转为强负电荷(LM/LMA-果胶:-38至-40 mV;HM-果胶:-14至-18 mV),表明完全包覆。
3、保护性作用:
果胶网络保护脂质体免受胃肠道环境(酶解、pH变化)破坏,提升口服给药稳定性。
4、工艺优势:
微流控技术具有高重现性,参数易调整(流速比、浓度),且无需有机溶剂,与传统化学交联法相比更环保、可扩展性强。
5、生物相容性:
果胶为GRAS(公认安全)材料,生物可降解,适合口服递送系统。
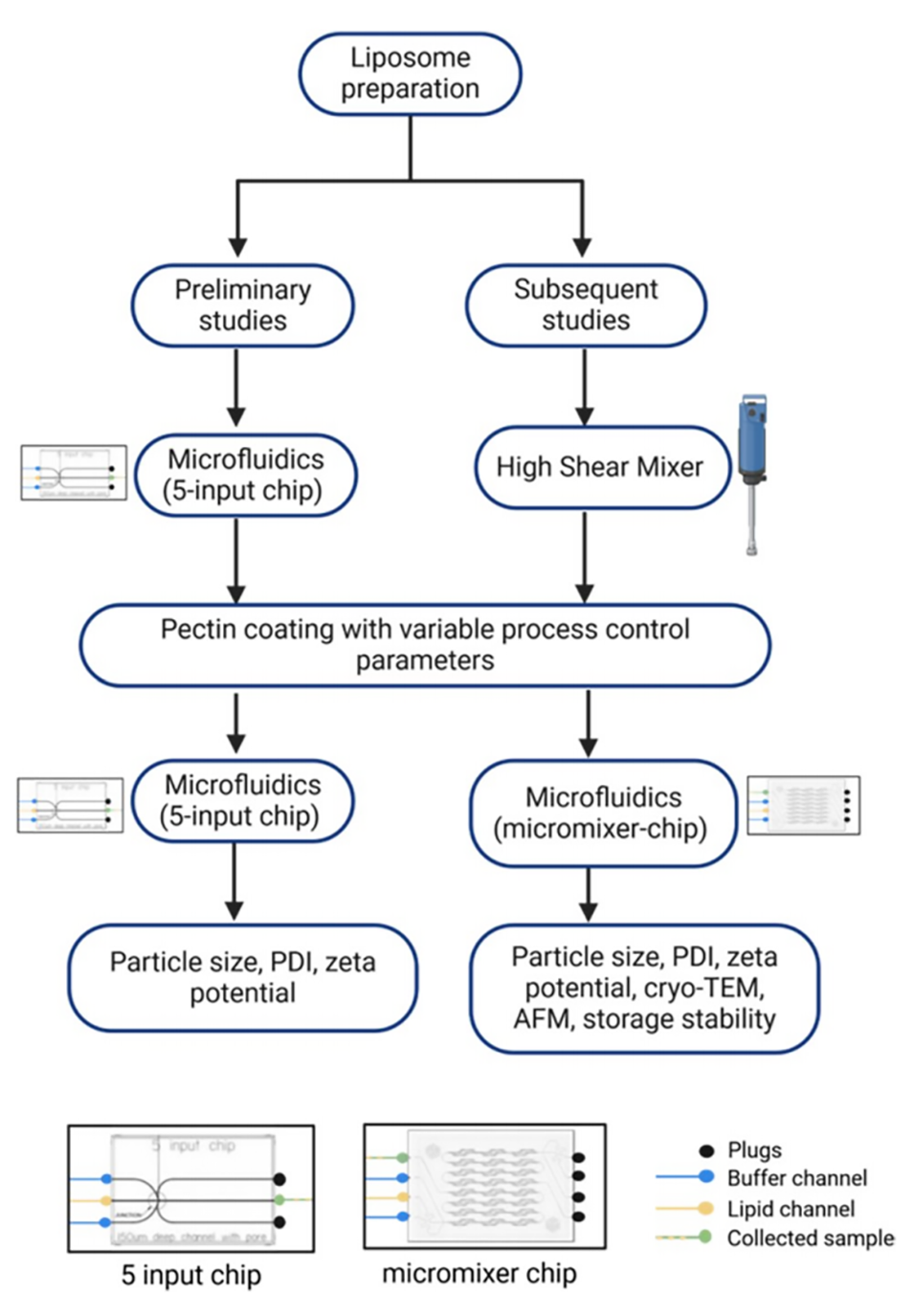
图1.脂质体制备、果胶涂层及表征的工作流程图。
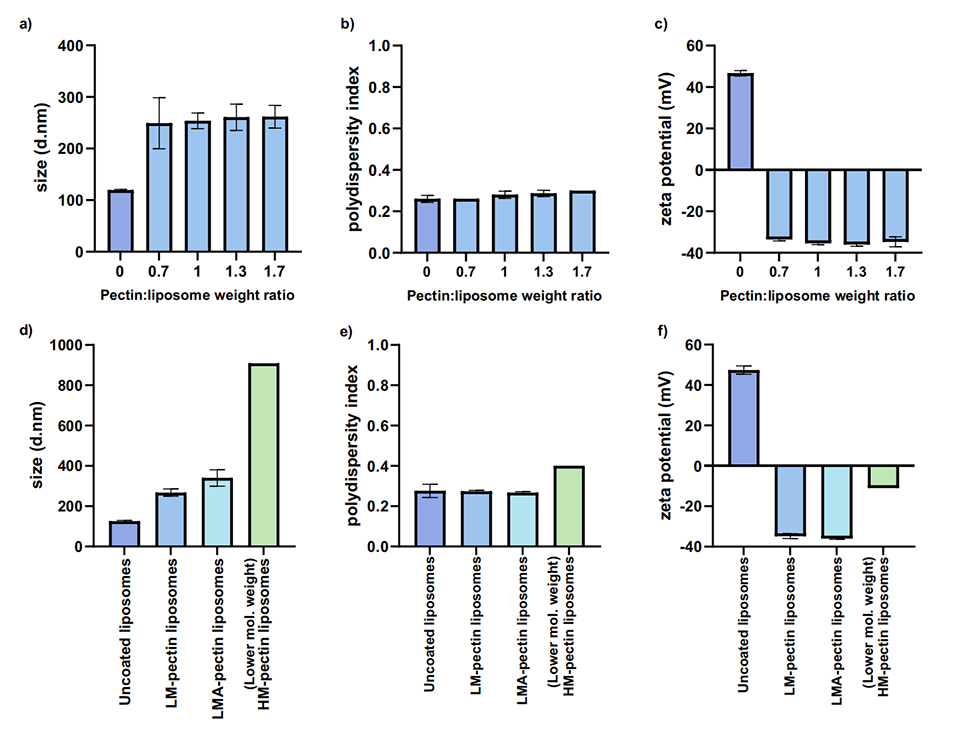
图2.初步研究后果胶包覆脂质体的表征。微流体制备阳离子脂质体,脂质浓度为2.5:0.5 mg/ml DDA:MMG。果胶的起始浓度为1mg/mL,用5个入口的微芯片制备果胶包覆脂质体,其中2个入口被堵塞。a-f)显示粒径、PDI和ζ电位表征。a-c)用LM果胶和不同果胶/脂质体比例制备的颗粒。d-f)用不同的果胶制备的颗粒。
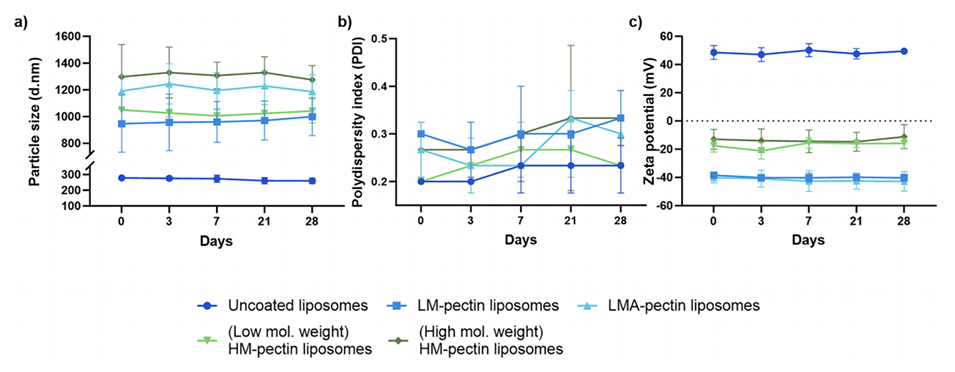
图3.描述了颗粒在储存过程中尺寸、PDI和表面电荷的变化。
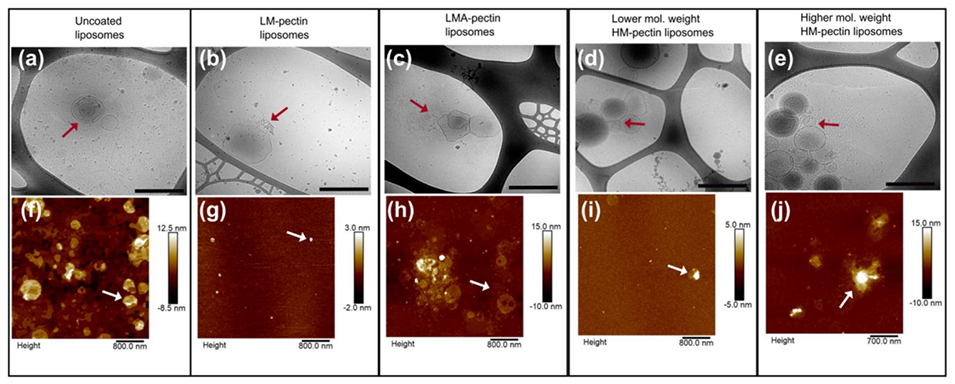
图4.果胶包覆脂质体的形态表征,(a-e)冷冻TEM显微照片,比例尺为200 nm,(f-j)AFM显微照片。箭头突出显示了脂质体或附着在聚合物复合物上的脂质体。
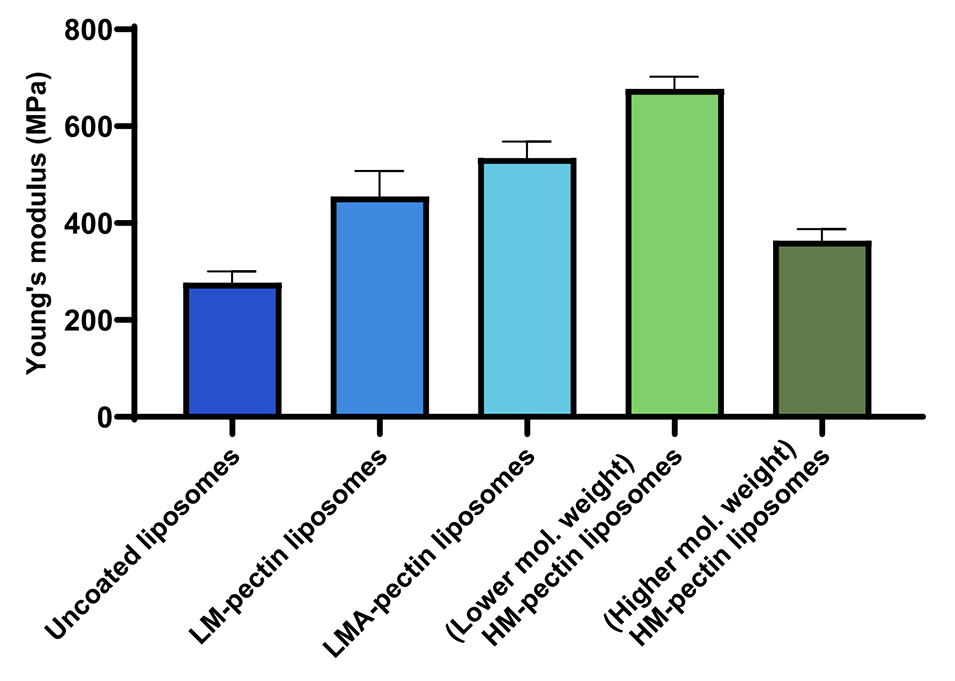
图5.AFM测量果胶包覆脂质体和未包覆脂质体后计算的杨氏模量变化。
论文链接:https://doi.org/10.1007/s13346-025-01812-0














