硒(Se)缺乏是导致软骨细胞氧化还原稳态失衡和骨关节炎(OA)进展的关键因素。然而,传统的硒补充剂面临着治疗窗口狭窄和缺乏靶向性等挑战。

近期,重庆医科大学附属第一医院骨科黄伟教授、厉轲副教授、雷一霆博士等人开发了一种基于纳微复合策略的级联靶向水凝胶微球系统(HA-SeNPs@AHAMA-HMs)。该系统旨在实现对受损软骨的靶向粘附,以靶向递送硒纳米粒子(SeNPs),从而清除ROS,改善线粒体功能,缓解OA。相关研究以“Cascade targeting selenium nanoparticles-loaded hydrogel microspheres for multifaceted antioxidant defense in osteoarthritis”为题目,发表在期刊《Biomaterials》上。
本文要点:
1、本研究设计了透明质酸(HA)修饰的硒纳米粒子(HA-SeNPs),并开发了基于纳微复合策略的级联靶向递送系统(HA-SeNPs@AHAMA-HMs)。
2、通过微流控技术制备醛基功能化的HA基水凝胶微球(AHAMA-HMs)。AHAMA-HMs表面丰富的醛基通过席夫碱反应与受损软骨表面的氨基形成共价键,实现微米级靶向粘附。
3、同时,HA-SeNPs被加载到AHAMA-HMs中,并通过其多孔结构缓慢释放。释放的HA-SeNPs可以特异性地与高表达CD44的OA软骨细胞结合,从而实现纳米级的靶向递送。
4、一旦被细胞吸收,HA-SeNPs就会通过直接清除ROS并通过亚硒酸盐的产生促进硒蛋白合成来发挥作用,形成多方面的抗氧化防御系统。
5、体内外结果表明,该系统显着改善了与线粒体功能相关的氧化磷酸化途径,从而显着减少了关节间隙狭窄和软骨基质降解,并延缓了OA的进展。
6、综上所述,本研究开发的基于纳微复合策略的级联靶向水凝胶微球为精准补硒和OA治疗提供了一种有前景的新策略。
如何设计HA-SeNPs以提高其稳定性和生物利用度?
HA-SeNPs通过透明质酸(HA)的修饰设计以提升其稳定性和生物利用度。首先,HA与硒纳米颗粒(SeNPs)表面的羟基形成Se–O键,从而在SeNPs表面构建HA外壳,这显著提高了纳米颗粒的稳定性,避免其快速聚集。研究显示,与未修饰的SeNPs相比,HA-SeNPs在复杂的生物环境如滑液中表现出更高的稳定性,不易沉淀或聚集。
其次,HA修饰还赋予SeNPs靶向性能力。由于HA是CD44受体的特异性配体,而CD44在骨关节炎(OA)软骨细胞膜上高表达,HA-SeNPs能够与OA软骨细胞特异性结合,实现精准递送。
此外,HA-SeNPs的小粒径设计使其更易穿透关节软骨基质,同时HA外壳减少了纳米颗粒在体内的快速清除,提高了其在关节腔内的滞留时间和治疗效果。因此,HA-SeNPs通过增强稳定性、靶向性和滞留能力,显著提升了其在骨关节炎治疗中的生物利用度。
HA-SeNPs@AHAMA-HMs的制备步骤如下:
合成HA-SeNPs:将150 mg透明质酸(HA)溶解在50 mL去离子水中形成0.3%(w/v)的溶液,随后加入1 mL 100 mM亚硒酸钠溶液并于室温下搅拌10分钟,然后逐滴加入4 mL 100 mM抗坏血酸溶液,继续搅拌24小时,最后通过截留分子量3500 Da的透析袋在室温下透析24小时,得到HA-SeNPs溶液。
合成AHAMA:以改性方法将HA先与高碘酸根(IO4-)反应形成醛基化HA(AHA),随后与甲基丙烯酸酐(MA)在碱性条件下共价结合得到AHAMA固体,并通过冷冻干燥处理用于后续步骤。
合成HA-SeNPs@AHAMA-HMs:采用自设计的微流控装置,将AHAMA水凝胶前体溶液(80 mg AHAMA溶解于10 mL含0.25%(w/v)LAP的PBS中)作为水相,与油相(由45 mL轻质石蜡和5 mL Span 80制成)在均匀的速度驱动下生成AHAMA水凝胶液滴,这些液滴在紫外光下交联形成尺寸均一的多孔微球(AHAMA-HMs),随后冷冻干燥。接着,将冷冻干燥后的AHAMA-HMs浸泡于新合成的HA-SeNPs溶液中,在37°C下以80 rpm搅拌过夜,完成加载后离心分离,得到最终的HA-SeNPs负载微球(HA-SeNPs@AHAMA-HMs)。
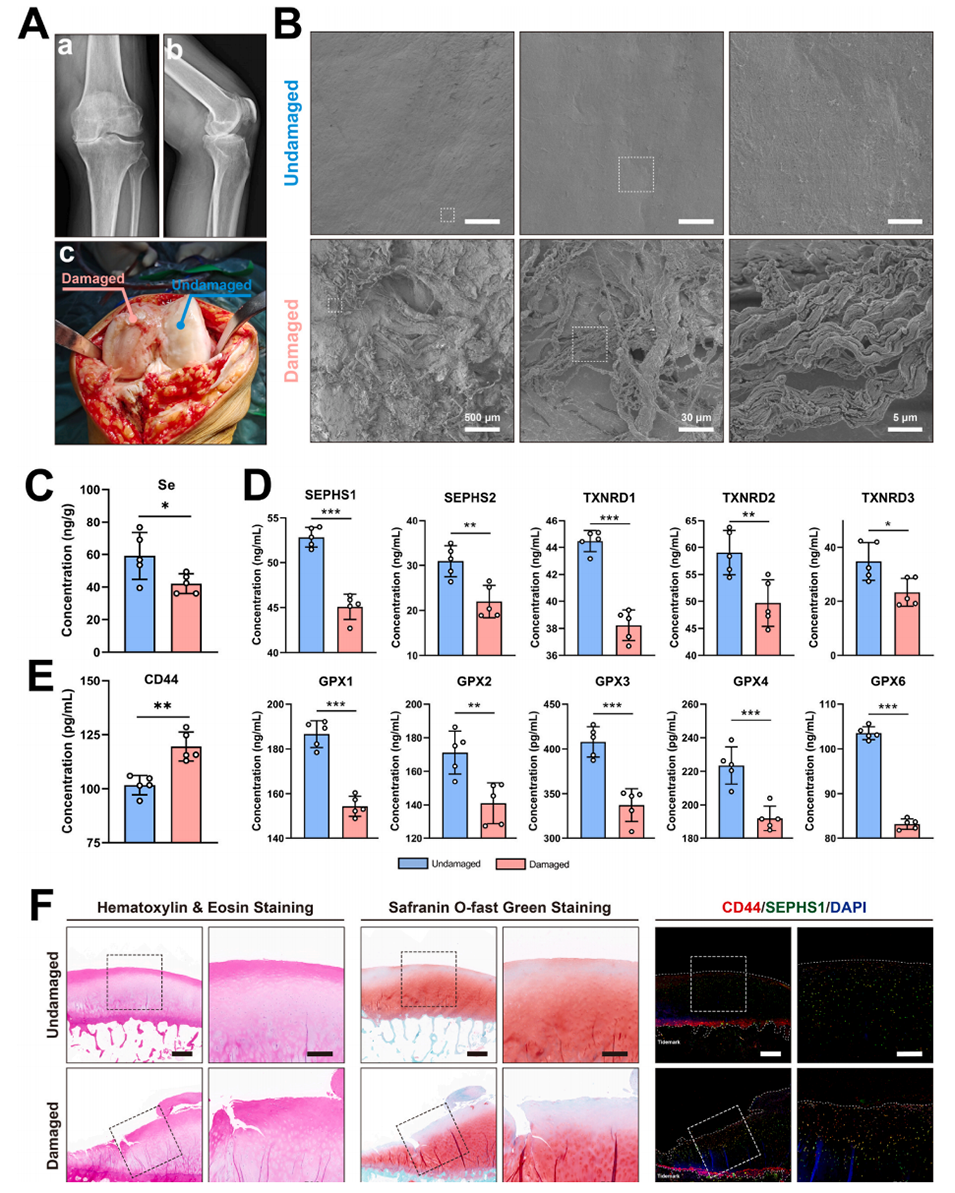
图1.人类骨关节炎软骨实验结果。A)展示了骨关节炎患者的前后位和侧位X光片,以及全膝关节置换术中的受损和未受损软骨的术中照片。B)扫描电子显微镜(SEM)图像显示受损和未受损软骨的表面形态。C)检测受损和未受损软骨中硒(Se)的含量。D)检测受损和未受损软骨中10种与抗氧化相关的硒蛋白水平。E)检测受损和未受损软骨中CD44蛋白的表达。F)对受损和未受损软骨进行组织学分析,包括H&E染色、番红O-固绿染色以及CD44和SEPHS1的双重免疫荧光染色。
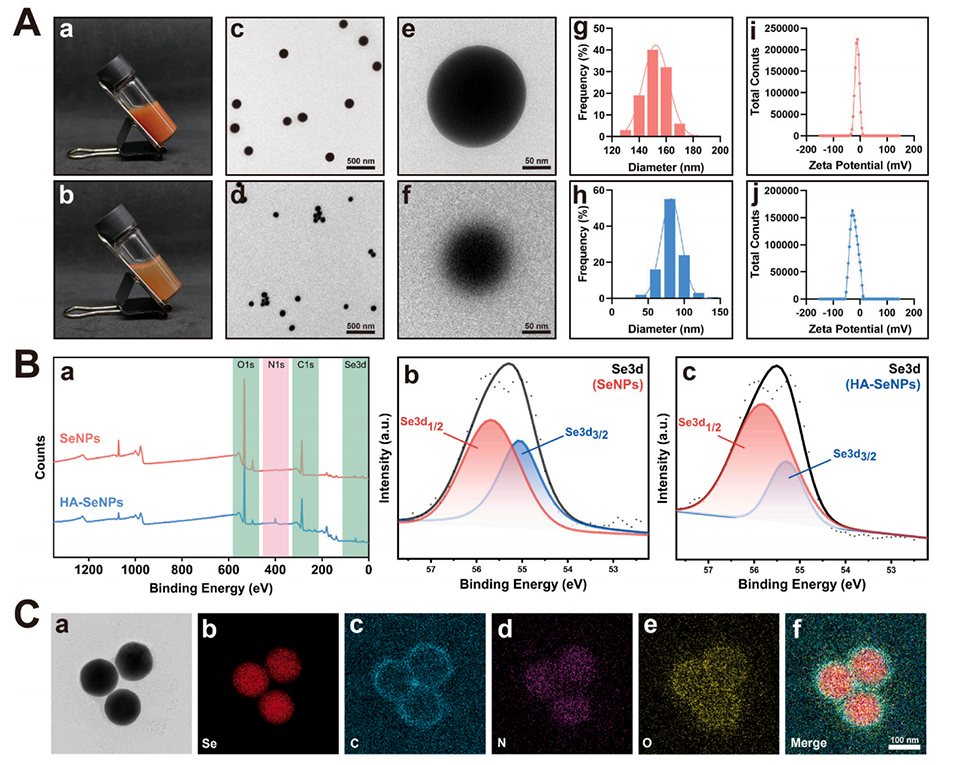
图2.HA-SeNPs的表征。A)展示了SeNPs和HA-SeNPs的外观照片、透射电子显微镜(TEM)图像以及粒径和zeta电位分布。B)通过X射线光电子能谱(XPS)分析SeNPs和HA-SeNPs的表面化学组成。C)利用高分辨率透射电子显微镜(HRTEM)和能量色散X射线光谱(EDS)对HA-SeNPs进行元素分布分析。D)使用活/死细胞染色评估HA-SeNPs的生物相容性。E)通过CCK-8实验评估不同浓度HA-SeNPs对细胞活力和增殖的影响。F)通过激光共聚焦显微镜观察HA-SeNPs在细胞内的摄取情况。G)利用流式细胞仪定量分析细胞对HA-SeNPs的摄取效率。
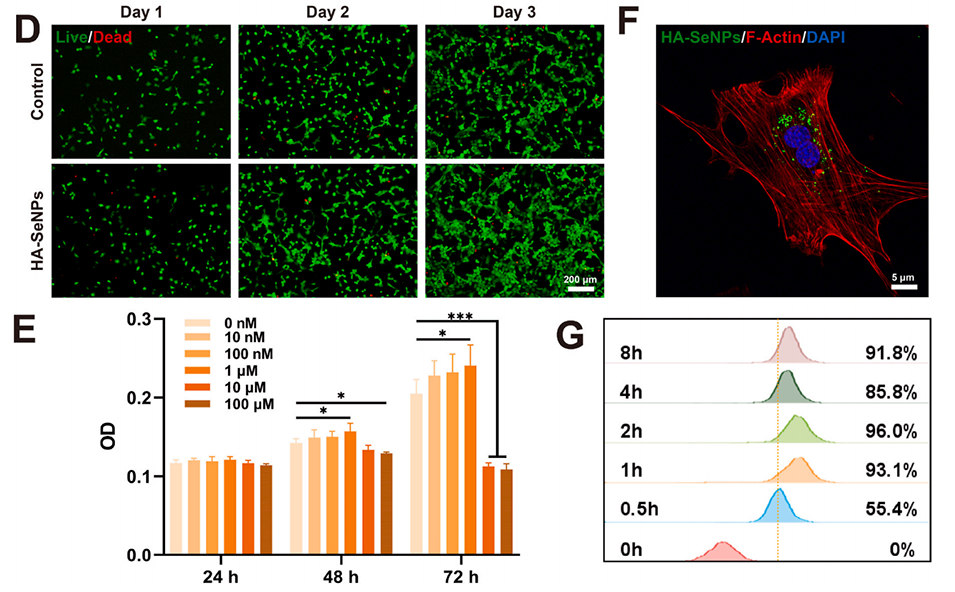
图2.HA-SeNPs的表征。A)展示了SeNPs和HA-SeNPs的外观照片、透射电子显微镜(TEM)图像以及粒径和zeta电位分布。B)通过X射线光电子能谱(XPS)分析SeNPs和HA-SeNPs的表面化学组成。C)利用高分辨率透射电子显微镜(HRTEM)和能量色散X射线光谱(EDS)对HA-SeNPs进行元素分布分析。D)使用活/死细胞染色评估HA-SeNPs的生物相容性。E)通过CCK-8实验评估不同浓度HA-SeNPs对细胞活力和增殖的影响。F)通过激光共聚焦显微镜观察HA-SeNPs在细胞内的摄取情况。G)利用流式细胞仪定量分析细胞对HA-SeNPs的摄取效率。
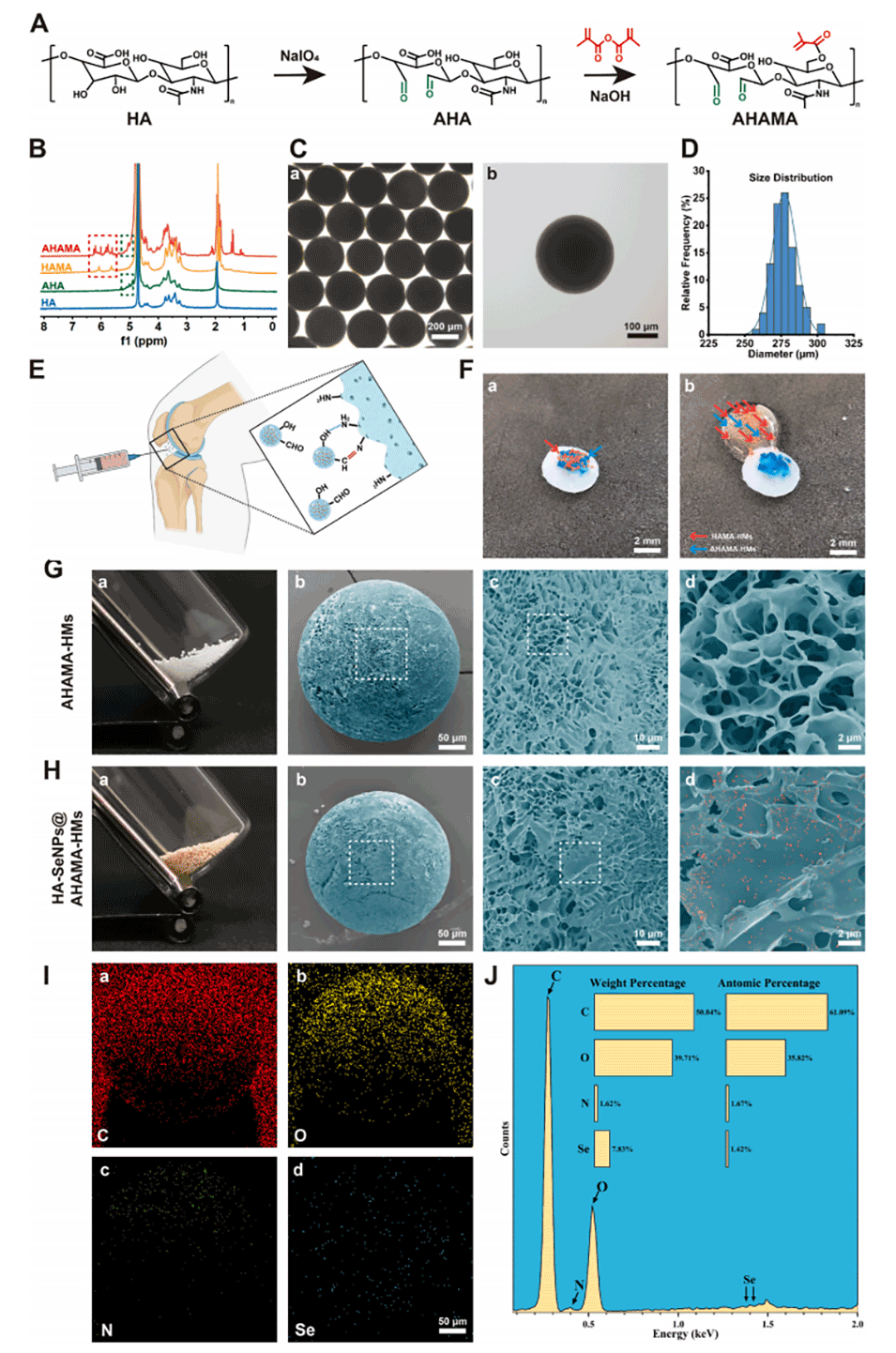
图3.AHAMA、AHAMA-HMs和HA-SeNPs@AHAMA-HMs的表征。A)展示了用HA合成AHA和AHAMA的两步法示意图。B)利用核磁共振(NMR)分析HA、AHA、HAMA和AHAMA的结构。C)通过光学显微镜观察AHAMA-HMs的形态。D)测量AHAMA-HMs的粒径分布。E)展示AHAMA-HMs与受损软骨粘附的机制示意图。F)通过体外实验验证AHAMA-HMs对猪软骨的粘附能力。G)展示AHAMA-HMs的外观照片和扫描电子显微镜(SEM)图像。H)展示HA-SeNPs@AHAMA-HMs的外观照片和SEM图像。I)利用能量色散X射线光谱(EDS)分析HA-SeNPs@AHAMA-HMs中硒元素的分布。J)对EDS元素分布结果进行定量分析。
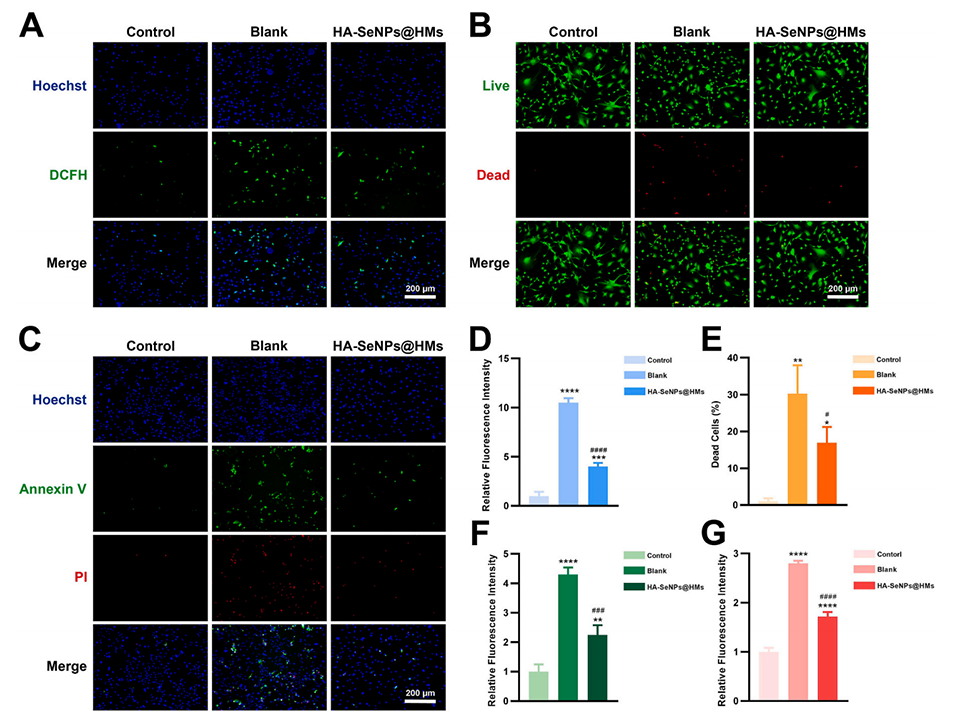
图4.HA-SeNPs@AHAMA-HMs清除ROS并维持细胞稳态。A)利用DCFH-DA法检测细胞内ROS水平。B)通过活/死细胞染色评估细胞死亡情况。C)利用Annexin V/PI染色检测细胞凋亡。D)对DCFH-DA荧光强度进行定量分析,评估ROS水平。E)计算活/死细胞染色中死亡细胞的百分比。F)计算Annexin V/PI染色中早期凋亡细胞的百分比。G)计算Annexin V/PI染色中晚期凋亡细胞的百分比。
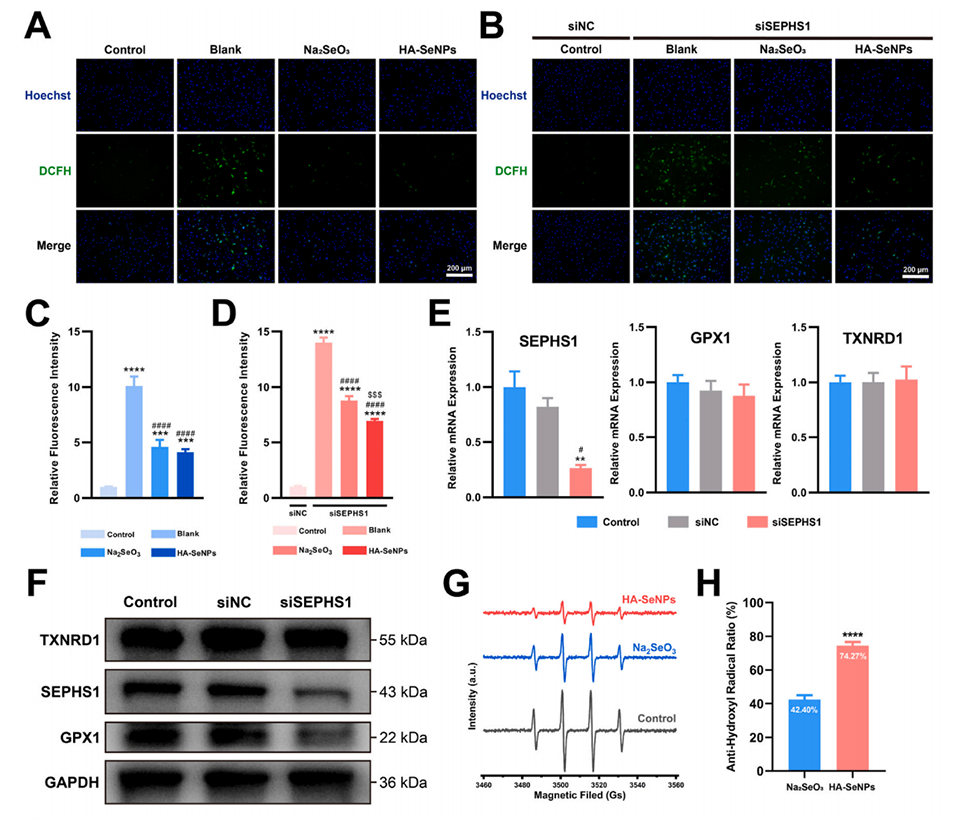
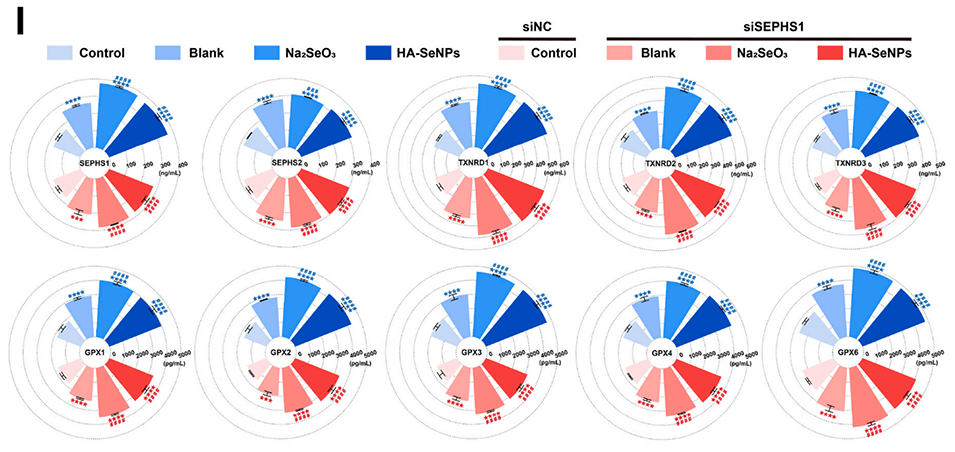
图5.HA-SeNPs的多层面抗氧化防御特性。A-B)利用DCFH-DA法检测siSEPHS1转染前后的细胞内ROS水平。C-D)对DCFH-DA荧光强度进行定量分析。E)利用RT-PCR评估siSEPHS1的敲低效率。F)利用Western blot验证siSEPHS1的敲低效率。G)通过电子顺磁共振(EPR)实验比较Na2SeO3和HA-SeNPs的ROS清除能力。H)对EPR结果进行定量分析。I)检测siSEPHS1转染前后10种与抗氧化相关的硒蛋白水平。
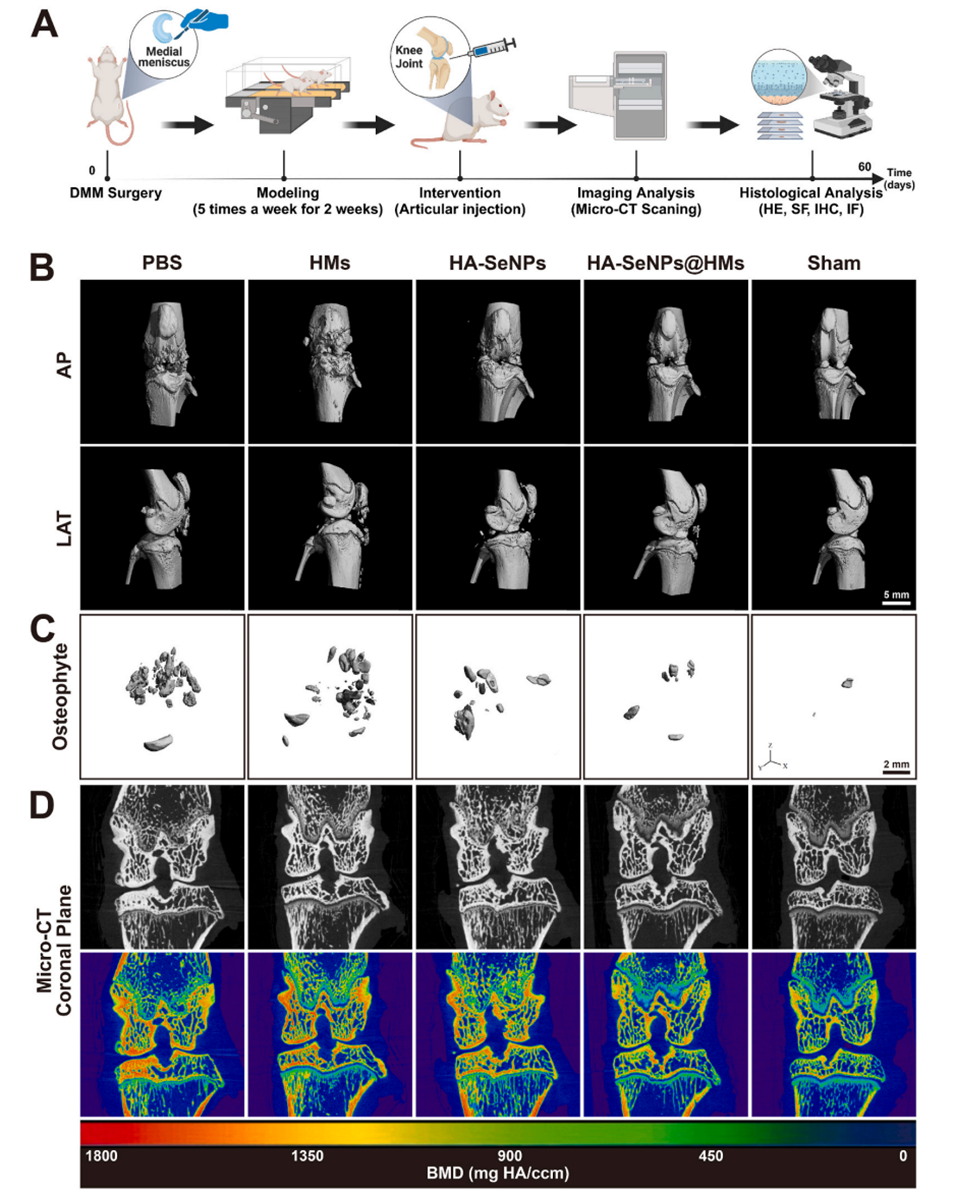
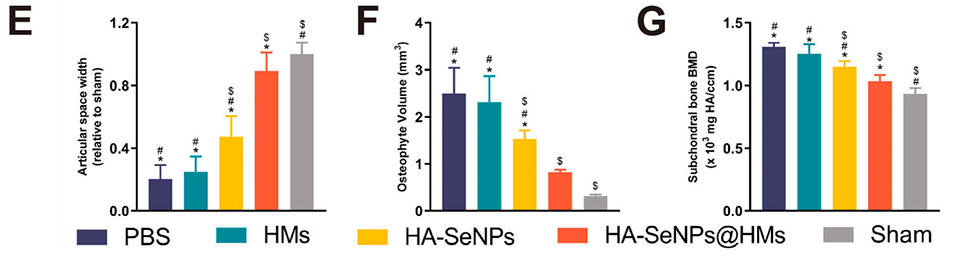
图6.HA-SeNPs@AHAMA-HMs治疗骨关节炎的放射学评估。A)展示了SD大鼠体内实验流程的示意图。B)展示了SD大鼠膝关节的Micro-CT三维重建图像。C)展示了SD大鼠膝关节骨赘的三维重建图像。D)对膝关节骨质疏松进行视觉评估。E)对膝关节间隙宽度进行定量分析。F)对骨赘体积进行定量分析。G)对骨质疏松密度进行定量分析。
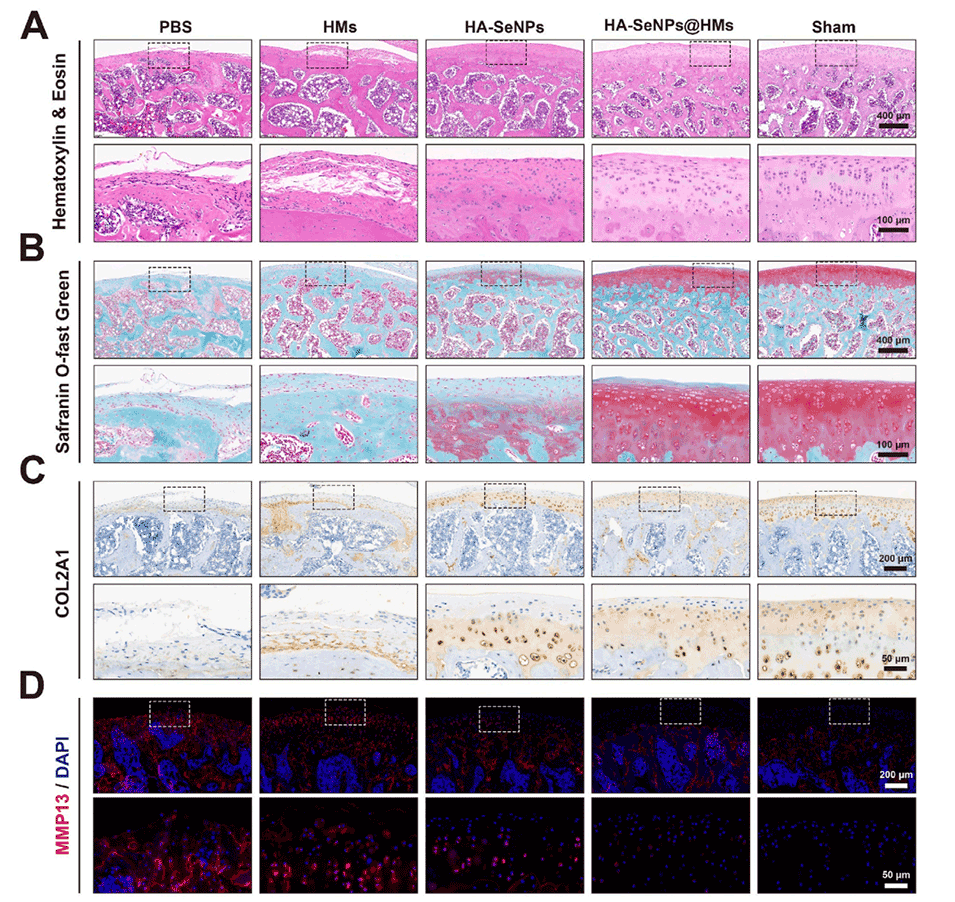
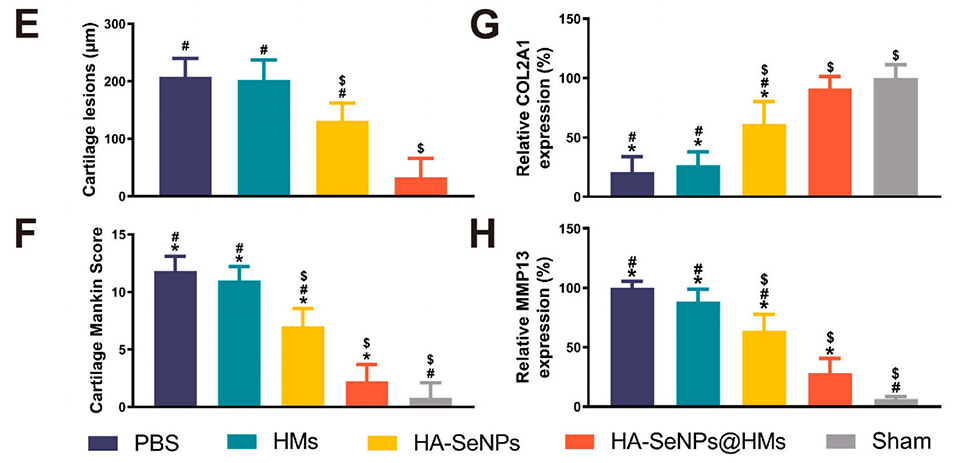
图7.HA-SeNPs@AHAMA-HMs治疗骨关节炎的组织学评估。A)展示了H&E染色结果。B)展示了番红O-固绿染色结果。C)展示了COL2A1蛋白的免疫组化染色结果。D)展示了MMP13蛋白的免疫荧光染色结果。E)对软骨磨损深度进行定量分析。F)对改良Mankin评分进行定量分析。G)对COL2A1免疫组化染色进行定量分析。H)对MMP13免疫荧光染色进行定量分析。
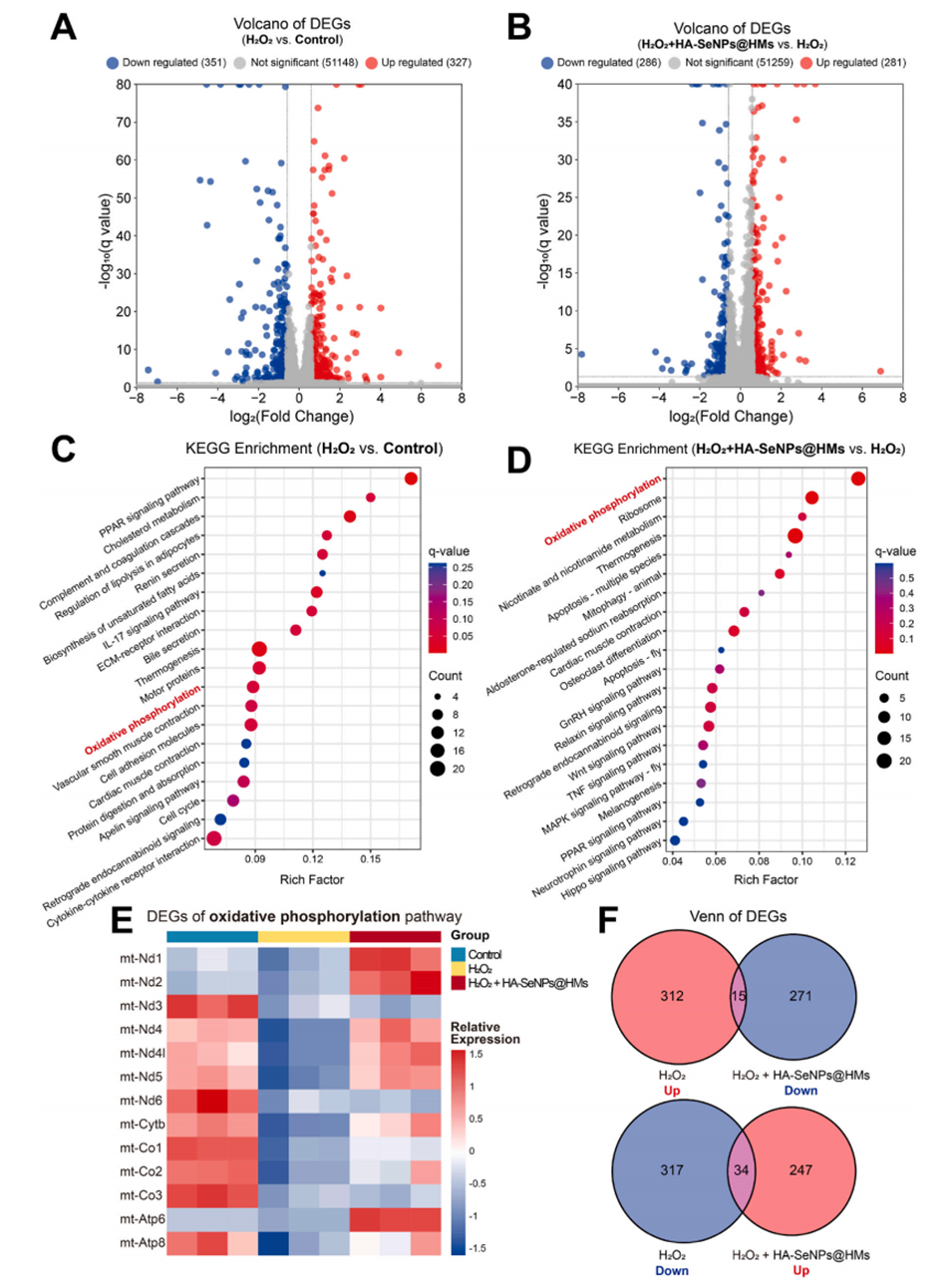
图8.HA-SeNPs@AHAMA-HMs治疗骨关节炎的潜在机制。A)展示了H2O2与对照组比较的差异表达基因(DEGs)火山图。B)展示了H2O2+HA-SeNPs@AHAMA-HMs与H2O2组比较的DEGs火山图。C)展示了H2O2与对照组比较的DEGs的KEGG富集分析结果。D)展示了H2O2+HA-SeNPs@AHAMA-HMs与H2O2组比较的DEGs的KEGG富集分析结果。E)展示了与氧化磷酸化途径相关的DEGs的分析结果。F)展示了H2O2组上调与HA-SeNPs@AHAMA-HMs组下调的DEGs的维恩图,以及H2O2组下调与HA-SeNPs@AHAMA-HMs组上调的DEGs的维恩图。
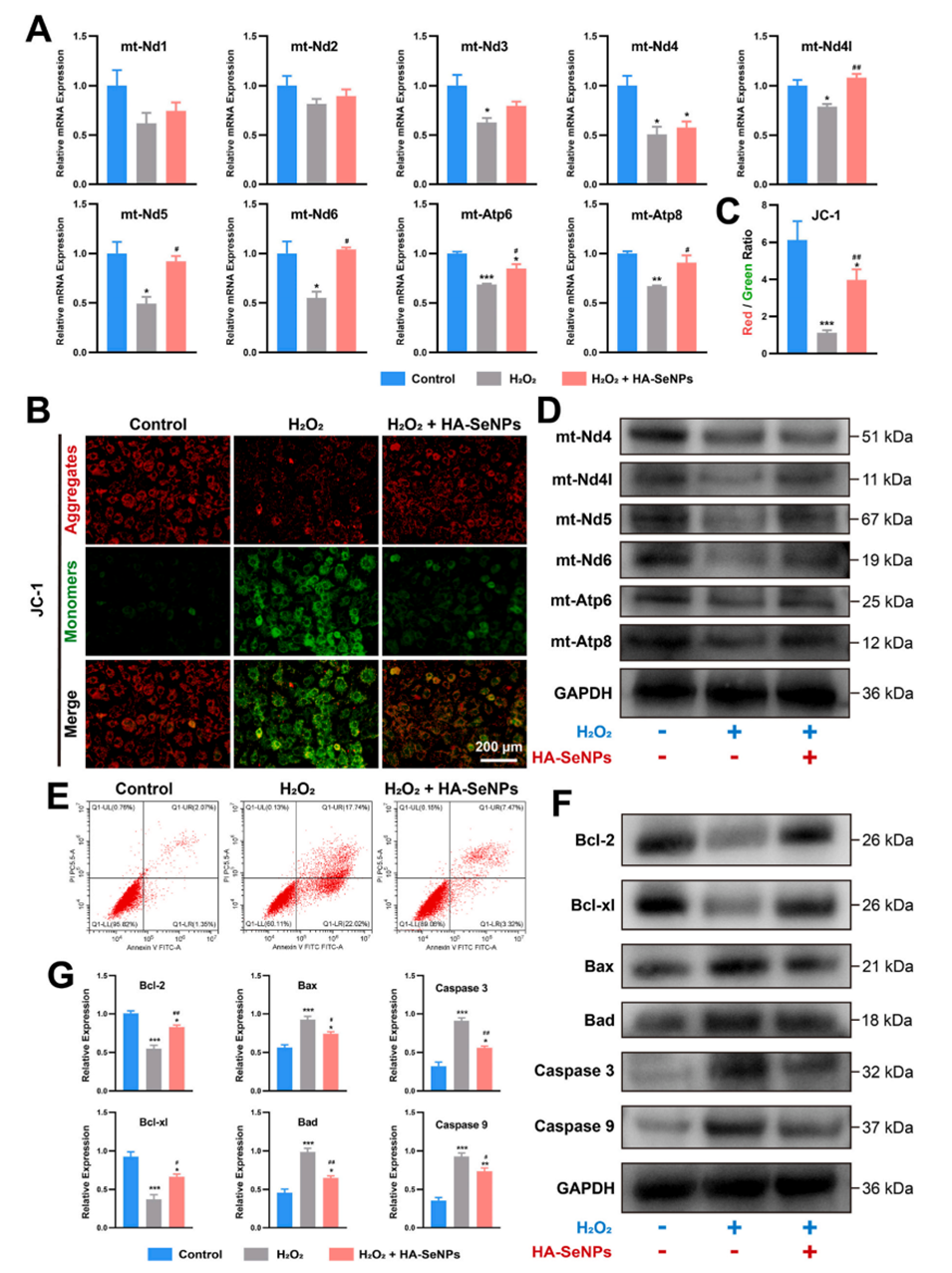
图9.HA-SeNPs@AHAMA-HMs治疗骨关节炎的机制验证。A)检测与线粒体电子传递链复合体I和ATP合酶相关的核心基因的mRNA表达水平。B)利用JC-1染色评估线粒体膜电位。C)通过JC-1染色的红绿荧光强度比值定量评估线粒体膜电位。D)检测与线粒体电子传递链复合体I和ATP合酶相关的核心蛋白的相对表达水平。E)利用流式细胞仪定量分析细胞凋亡水平。F-G)检测凋亡相关蛋白的相对表达水平。
论文链接:https://doi.org/10.1016/j.biomaterials.2025.123195














