
导读:
水凝胶微球作为药物递送和细胞培养的关键载体引起了广泛关注。传统微球由于其封闭的表面结构和生物惰性,在再生医学领域的应用受到限制。为此,南京工业大学迟波教授课题组与江苏中烟工业有限责任公司研究团队合作,利用微流控技术成功制备了多孔PLLA聚合物微球,并将其引入与天然ECM高度兼容的糖肽类水凝胶中,成功开发了具有ROS清除和温度响应行为的γ-PGA/HA@ PLLA微球复合水凝胶活性体系。相关研究以“Thermoresponsive Injectable Microsphere Glycopeptide Hydrogels for Remodeling Dynamic Cell Microenvironments”为题目,发表于期刊《ACS Applied Polymer Materials》。
本文要点:
1、本研究设计并制备了一种具有优异活性氧(ROS)清除性能和高组织相容性的热敏型可注射复合递送系统,旨在提高其在组织内的注射稳定性。
2、通过微流控技术制备高度均匀的聚乳酸(PLA)微球,并在其表面包覆硒代半胱氨酸交联的透明质酸(Se-HA),形成多孔微球,以实现高效的ROS清除。
3、以生物相容性优异的透明质酸(HA)和聚谷氨酸(γ-PGA)为骨架材料,通过动态与静态策略相结合的方式构建可注射的糖肽水凝胶活性材料,以重塑细胞的动态生理微环境。
4、进一步负载功能化的聚乳酸微球及温敏性聚合物泊洛沙姆(F127),制备具有温度响应性能的水凝胶活性材料。
5、这些功能化微球不仅能固定于水凝胶中增强其生理活性,还可通过天然材料与合成材料的协同作用,提升水凝胶/微球复合系统的可注射性与结构稳定性。
PLLA(聚乳酸)微球的制备及表面功能化步骤如下:
1.PLLA微球的制备
使用微流控技术在特定条件下制备具有均一粒径的PLLA微球:
设备构造:通过拉伸和打磨高硼硅毛细玻璃管,制造“管中管”同轴微流控系统,以确保液滴生成的精确性和一致性。
流速控制:PLLA溶液和PVA溶液分别作为连续相和分散相,流速比为5:40 (mL/h),这种比例使得生成的液滴具备均一且稳定的尺寸。
后处理:微球通过离心、去离子水清洗和冷冻干燥步骤收集并保存,最终的PLLA微球直径约为71.4 ± 5.8 μm。
2.PLLA微球的表面功能化
针对PLLA的惰性问题,通过以下多步化学反应实现表面功能化:
碱处理以形成氨基功能团:
首先,将PLLA微球悬浮于0.25 M NaOH和无水乙醇的混合溶液中,反应1小时,破坏PLLA分子链上的酯键,生成带有氨基功能的PLLA微球(PLLA-NH2),并显著增加表面的比表面积和多孔结构。化学交联修饰:
使用EDC(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐)和NHS(N-羟基琥珀酰亚胺)作为交联剂在ME缓冲液中进一步活化,结合ADH(己二酰肼)实现氨基引入,制备PLLA-ADH。
使用HA-Se(硒交联透明质酸)与PLLA-ADH在恒温(30 °C)及搅拌条件下反应,以实现表面包覆。此过程引入了Se−Se动态键,使功能化后的PLLA@HA-Se微球具备活性氧(ROS)响应能力。
结构及性能表征:
元素组成分析:功能化后的PLLA@HA-Se微球通过EDS(能谱仪)表征,其硒元素分布均匀,硒含量达6.84%,表明表面修饰成功。
结构表征:FTIR显示Se-Se键的红外吸收峰(880 cm-1),进一步证实了HA-Se的有效引入。
3.多孔结构与功能性优势
功能化PLLA微球的多孔表面提供了高比表面积,增强了与ROS的接触和清除效率,同时其Se-Se键的动态破裂行为为治疗过程提供了优良的生物响应性能。这种经过功能化的PLLA微球还为复合水凝胶提供了更强的结构和生物相容性支持。
该研究开发的热响应型可注射微球复合水凝胶在组织修复中具有以下优势:
1.高效的ROS清除能力:通过硒代半胱氨酸修饰的微球,能够响应性地清除组织损伤部位过量的活性氧(ROS),从而减轻氧化应激,改善细胞微环境,促进组织修复。
2.温度响应性与可注射性:水凝胶具有温度响应特性,能够在体温下形成稳定的凝胶结构,同时保持良好的可注射性。这种特性使其可以通过微创注射的方式精准地应用于损伤部位,减少手术创伤。
3.优异的机械性能和结构稳定性:水凝胶通过动态酰腙键和静态交联网络的结合,展现出高强度的机械性能和稳定的结构,能够为受损组织提供良好的物理支撑,同时保持与天然细胞外基质的兼容性。
4.促进细胞粘附和生长:微球表面经过修饰后具有更高的生物活性和细胞亲和性,能够促进细胞的粘附、增殖和分化,为组织再生提供有利的微环境。
5.可调控的降解性:水凝胶的降解速率可以通过调节成分进行调控,使其与组织修复的速度相匹配,避免过早降解或长期残留对组织修复造成不利影响。
6.多功能性:该复合水凝胶不仅能够清除ROS,还可以通过负载药物、生长因子等活性成分,实现多重治疗功能,进一步促进组织的修复和再生。
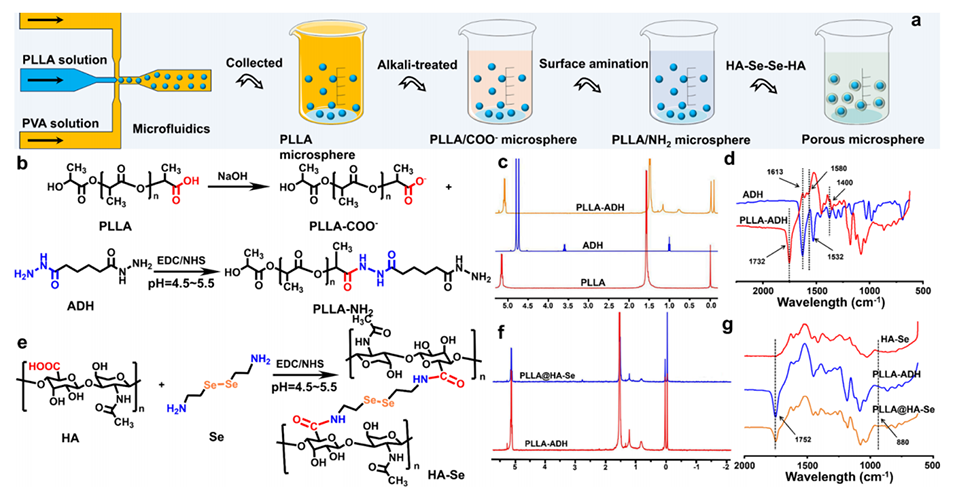
图1.PLLA微球的制备、表面功能化及结构表征。a: 展示了制备和表面功能化PLLA微球的示意图,这些微球对活性氧(ROS)有响应性。b: PLLA-NH2的合成路线。c: PLLA、ADH和PLLA-ADH的1H NMR谱图,显示了PLLA-ADH聚合物的成功制备。d: ADH和PLLA-ADH的FTIR谱图,进一步证实了PLLA-ADH的结构。e: HA-Se的合成路线。f: PLLA@HA-Se和PLLA-ADH的1H NMR谱图,证明了HA-Se成功包裹在PLLA微球表面。g: HA-Se、PLLA-ADH和PLLA-ADH@HA-Se的FTIR谱图,显示了HA-Se的成功制备和表面修饰。
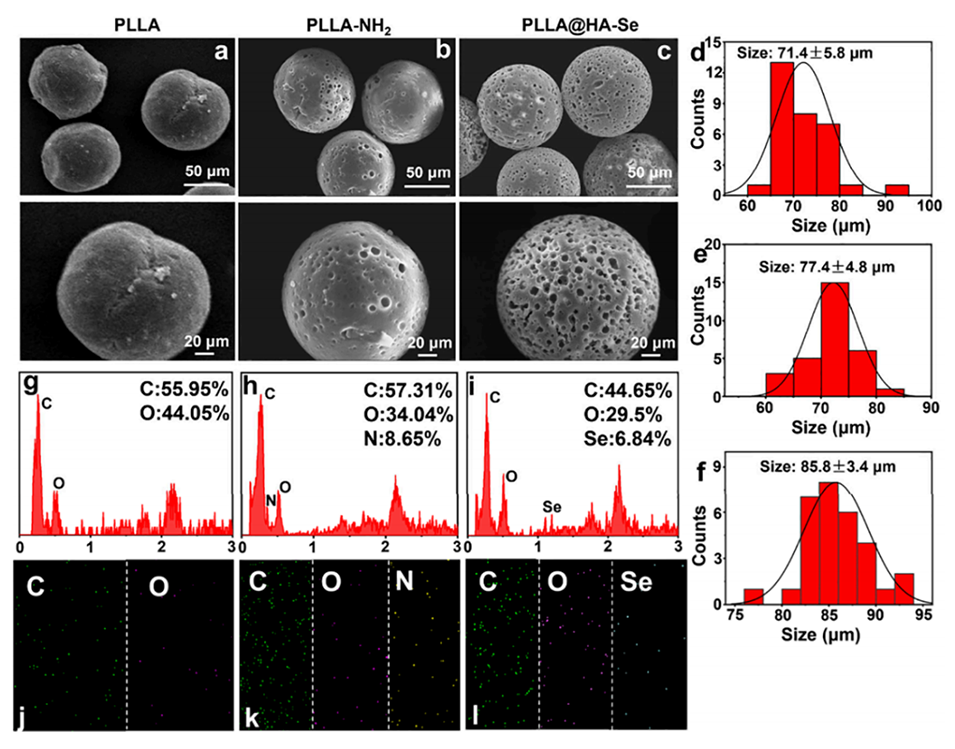
图2.PLLA、PLLA-NH2和PLLA@HA-Se微球的微观形貌表征。a-c: 分别展示了PLLA、PLLA-NH2和PLLA@HA-Se微球的SEM图像,显示了微球的三维球形结构和表面形貌的变化。d-f: 分别展示了PLLA、PLLA-NH2和PLLA@HA-Se微球的粒径分布。g-l: EDS元素分析图,显示了微球表面元素分布的变化,证明了HA-Se的成功修饰。
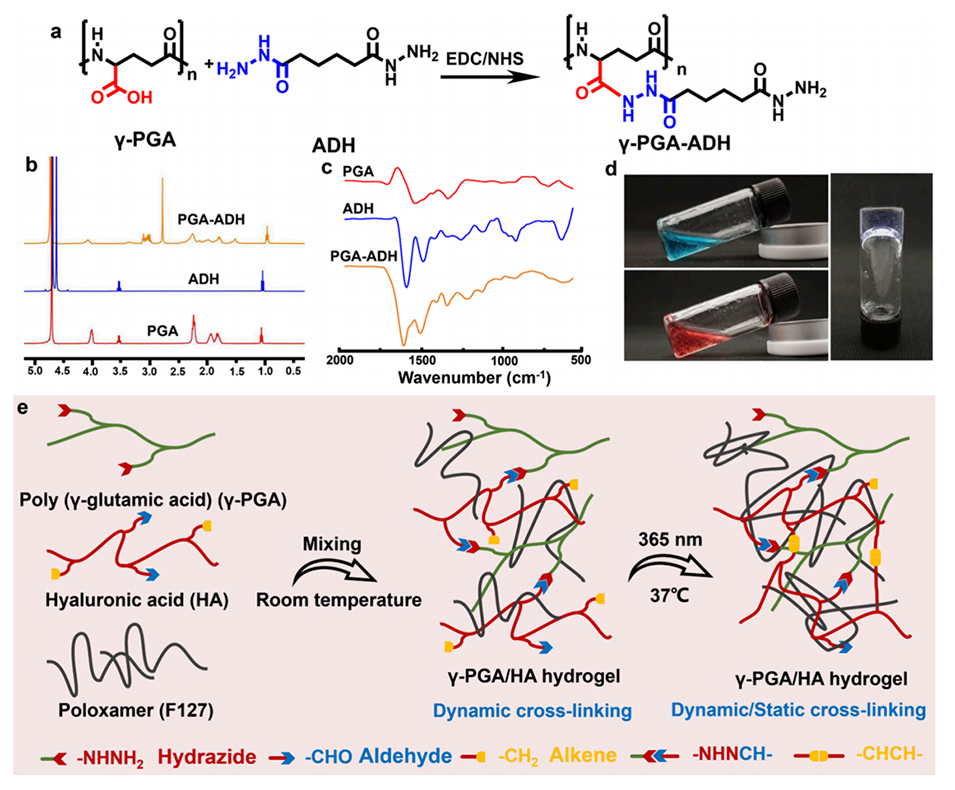
图3.γ-PGA/HA热敏糖肽水凝胶的制备与表征。a: γ-PGA-ADH的合成路线。b: γ-PGA-ADH的1H NMR谱图,显示了ADH成功接枝到γ-PGA上。c: γ-PGA-ADH的FTIR谱图,进一步证实了其结构。d: 展示了γ-PGA/HA水凝胶的制备过程。e: 展示了γ-PGA/HA水凝胶的多重交联机制。
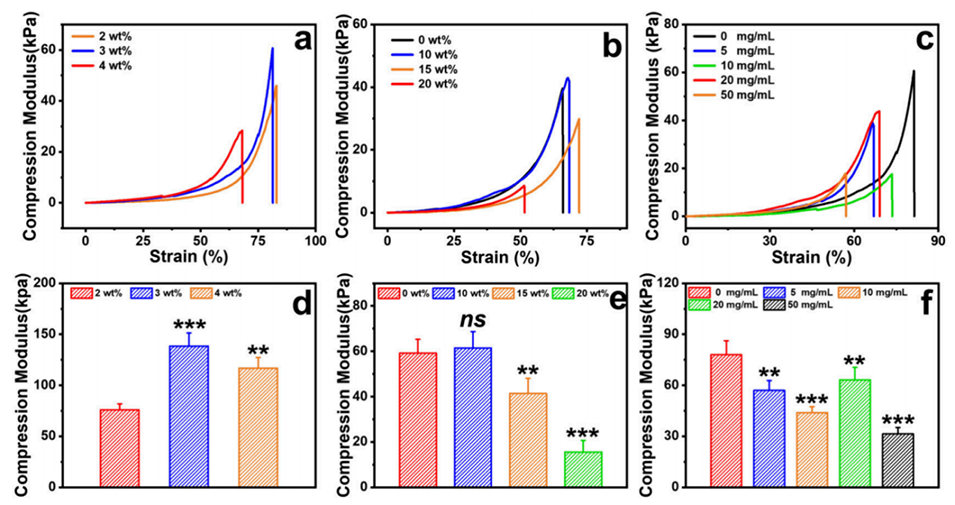
图4.γ-PGA/HA热敏糖肽水凝胶的力学性能表征。a-c: 分别展示了γ-PGA/HA水凝胶、γ-PGA/HA/F127水凝胶和γ-PGA/HA/F127@PLLA微球复合水凝胶的应力-应变曲线。d-f: 分别展示了上述三种水凝胶的压缩模量,显示了不同成分对机械强度的影响。
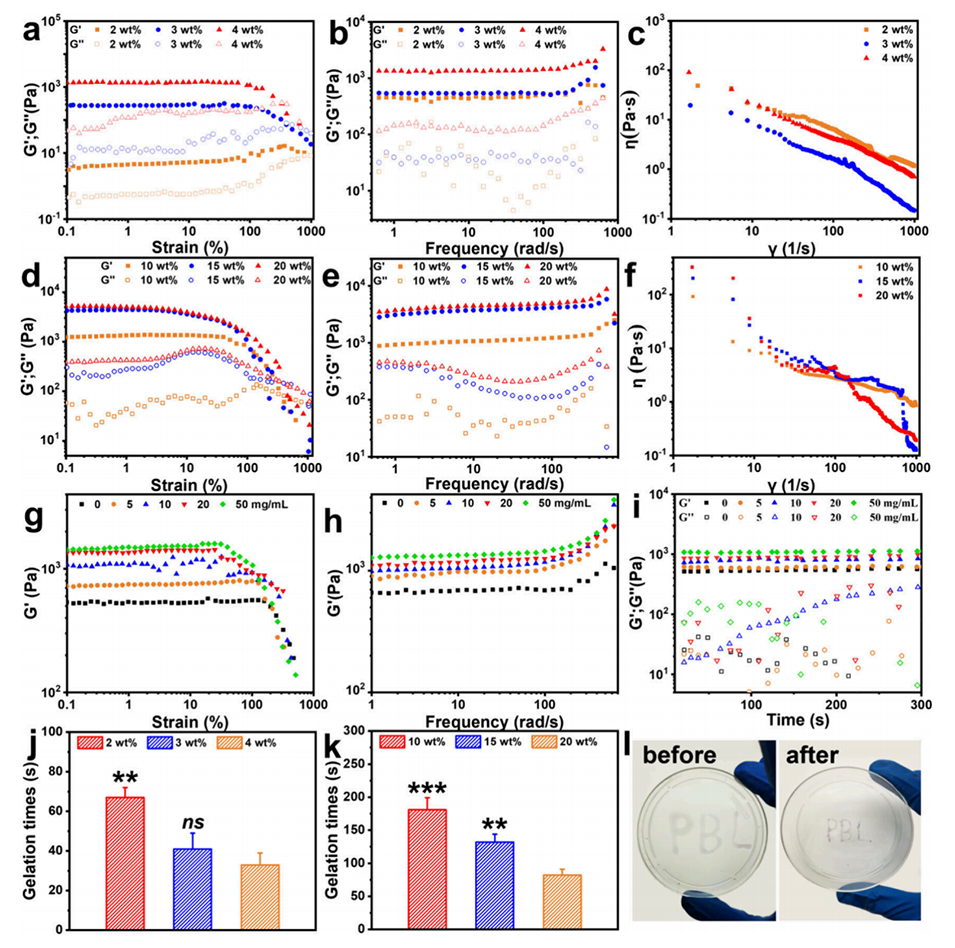
图5.γ-PGA/HA热敏糖肽水凝胶的流变特性和凝胶时间表征。a-c: 分别展示了γ-PGA/HA水凝胶的应力扫描、频率扫描和剪切稀化行为。d-f: 分别展示了γ-PGA/HA/F127水凝胶的应力扫描、频率扫描和剪切稀化行为。g-i: 展示了γ-PGA/HA@PLLA微球复合水凝胶的流变行为,包括应力扫描、频率扫描和时间扫描。j-k: 分别展示了γ-PGA/HA水凝胶和γ-PGA/HA/F127水凝胶的凝胶时间。l: 展示了γ-PGA/HA水凝胶的可注射性测试。
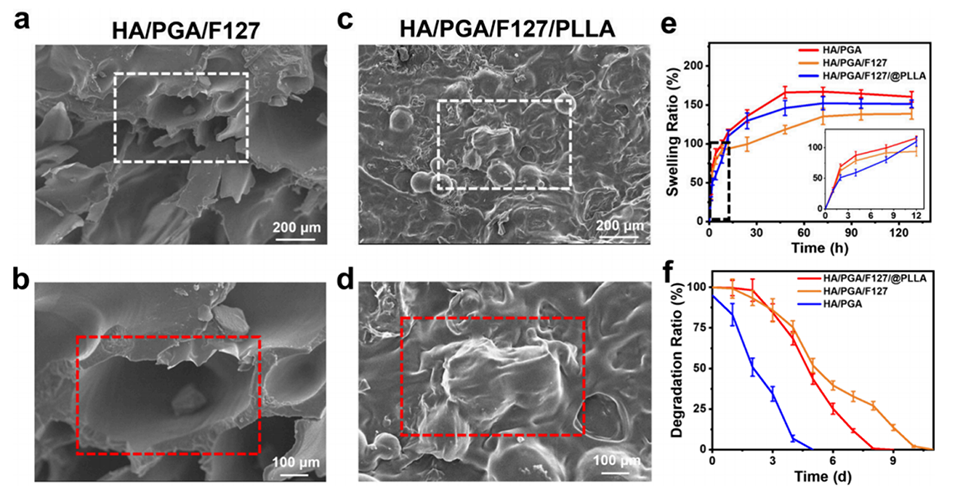
图6.γ-PGA/HA水凝胶的微观形貌与稳定性表征。a-d: SEM图像展示了γ-PGA/HA/F127水凝胶和γ-PGA/HA/F127@PLLA微球复合水凝胶的微观形貌。e: 展示了水凝胶的膨胀能力测试结果。f: 展示了水凝胶的降解行为测试结果。
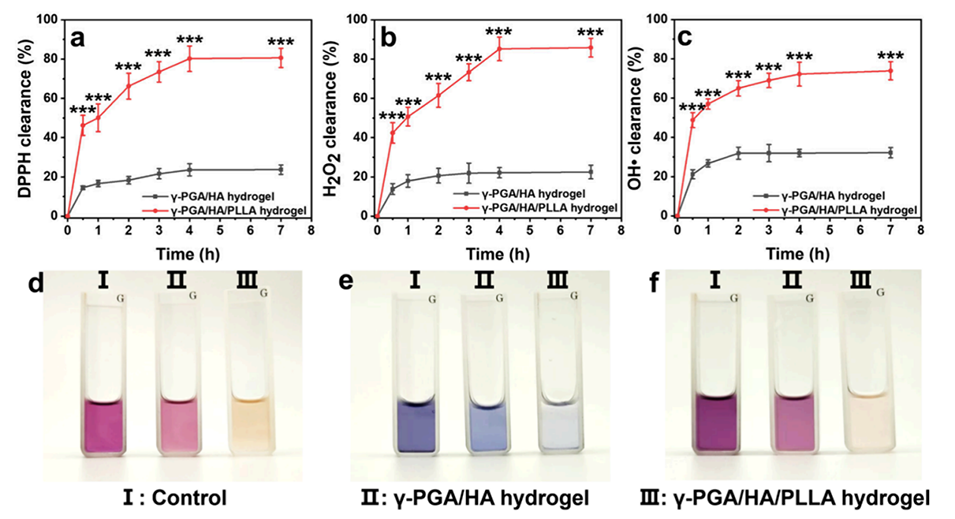
图7.热敏糖肽γ-PGA/HA水凝胶的抗氧化性能评估。a-c: 分别展示了DPPH、H2O2和羟基自由基的清除率,证明了水凝胶/微球复合系统对自由基的清除能力。d-f: 分别展示了DPPH、H2O2和羟基自由基清除的实验图像,进一步证实了水凝胶的抗氧化性能。
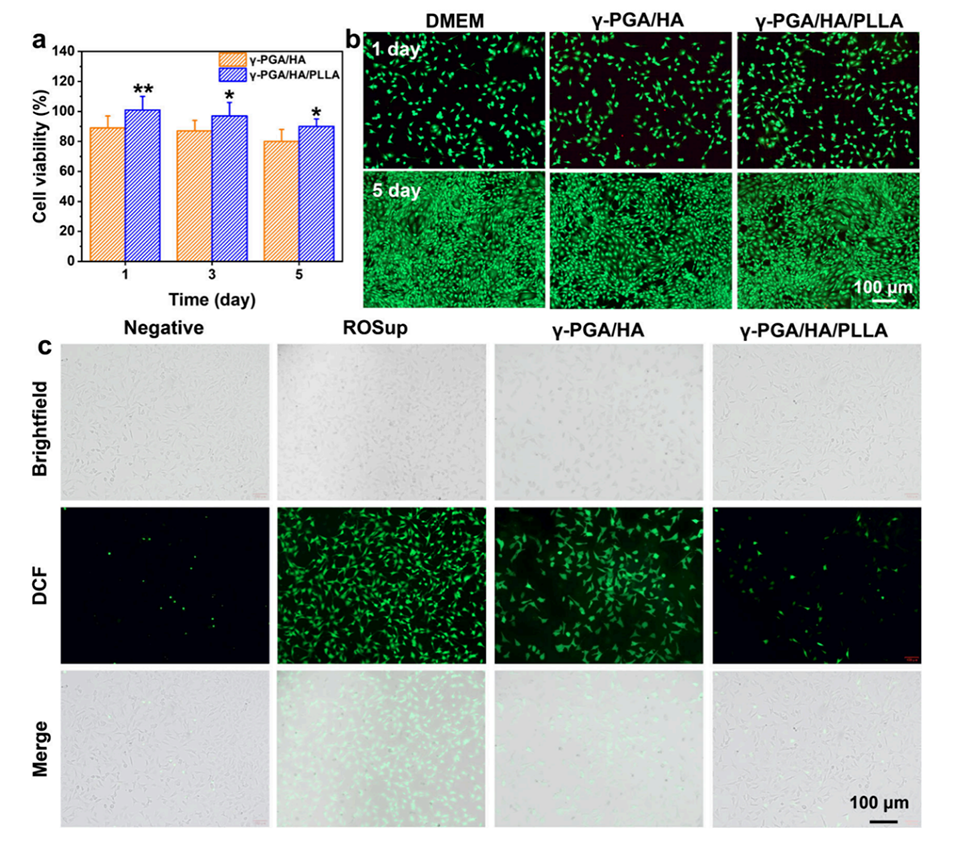
图8.γ-PGA/HA水凝胶的生物相容性与细胞内ROS清除能力评估。a: 展示了水凝胶的细胞存活率测试结果,表明水凝胶具有良好的生物相容性。b: 展示了水凝胶的活/死细胞染色实验结果,进一步证明了水凝胶对细胞生长的支持作用。c: 展示了水凝胶清除细胞内ROS的能力,证明了其对细胞的保护作用。
论文链接:https://doi.org/10.1021/acsapm.4c02740














