
导读:
伤口愈合是一个复杂而有序的生理过程,涵盖止血、炎症、细胞增殖和组织重塑四个阶段。然而,利用生物大分子设计出能精准匹配每个阶段需求的定制化功能性生物材料,虽极具价值,却鲜有讨论。近期,青岛大学药学院马庆明教授团队采用全水相微流控技术制备具有时间序列功能的海藻酸钙/烷基化壳聚糖核壳微粒,用于促进各阶段的伤口愈合,展现了显著的止血、抗菌和组织修复效果,为伤口治疗和相关生物医学应用提供了一种通用且高效的解决方案。相关研究以“All-aqueous microfluidic fabrication of calcium alginate/alkylated chitosan core-shell microparticles with time-sequential functions for promoting whole-stage wound healing”为题目,发布在期刊《International Journal of Biological Macromolecules》上。
本文要点:
1、本研究采用全水相微流控技术制备了具有时间序列功能的海藻酸钙/烷基化壳聚糖核壳微粒(D-CSMP),用于促进全阶段伤口愈合。
2、微粒核层由海藻酸钙(Ca-ALG)、纤维素纳米晶体(CNC)和表皮生长因子(EGF)组成,壳体由烷基化壳聚糖(ACS)、海藻酸盐及环丙沙星(CIP)构成。
3、通过响应面法(RSM)结合中心复合旋转设计(CCRD)优化制备工艺,实现了CIP和EGF的高效封装及其在伤口愈合各阶段的控制释放。
4、D-CSMP展现了显著的时间序列功能,初期促进止血及抗菌,后期支持细胞增殖与组织修复。
5、在皮肤损伤模型中,D-CSMP显著加速了慢性伤口愈合过程,为伤口治疗和相关生物医学应用提供了一种高效的解决方案。
海藻酸钙/烷基化壳聚糖核壳微粒(D-CSMP)的制备采用了两步全水相微流控方法,其过程如下:
第一步:制备CNC@Ca-ALG微粒
分散相准备:将纤维素纳米晶体(CNC)溶解于海藻酸钠溶液中,装入注射器并连接恒流泵。
收集相准备:使用CaCl2溶液作为收集相。
电喷射过程:通过恒流泵推动注射器,当毛细管尖端连续均匀滴液后,开启高压电源,将液滴电喷射到收集相中。
清洗与收集:生成的CNC@Ca-ALG微粒用去离子水清洗并收集备用。
第二步:制备CSMP(核壳微粒)
分散相准备:将CNC@Ca-ALG微粒与含有烷基化壳聚糖(ACS)和葡聚糖(DEX)的乙酸溶液混合,作为分散相。
收集相准备:使用含有海藻酸盐(ALG)和聚乙二醇(PEG)的NaOH溶液作为收集相。
液-液相分离:利用DEX-PEG双水相体系(ATPS)实现液滴的球形形貌。DEX赋予分散相特性,PEG赋予收集相特性,两者相互作用形成稳定的界面。
电喷射涂层:将分散相喷射到收集相中,通过电喷射和液-液相分离实现微粒的核壳结构成型。
清洗与冻干:制备的微粒用去离子水冲洗并使用冷冻干燥器进一步干燥,以获得具有规则球形结构的核壳微粒。
总之,上述过程利用微流控技术和全水相体系实现了D-CSMP的精确制备,确保微粒具有良好的尺寸均匀性和高效的药物包封性能,同时避免了有机溶剂的使用,提高了生物相容性和安全性。
核壳微粒(D-CSMP)在伤口愈合过程中具有以下关键功能:
1、止血功能:微粒壳层由烷基化壳聚糖(ACS)组成,具有良好的止血性能,能够在伤口初期快速吸收血液并促进凝血,有效缩短出血时间。
2、抗菌功能:外壳中包载的环丙沙星(CIP)可在伤口愈合的炎症阶段(前3天)快速释放,提供广谱抗菌保护,降低伤口感染的风险。
3、促进细胞增殖和组织修复:内核中的表皮生长因子(EGF)从第4天开始持续释放,作用于细胞增殖和组织重塑阶段,促进伤口愈合和皮肤再生。
4、时间序列治疗:通过核壳结构的设计,D-CSMP实现了药物的分阶段释放,精准匹配伤口愈合各阶段的需求,从而提高整体治疗效果。
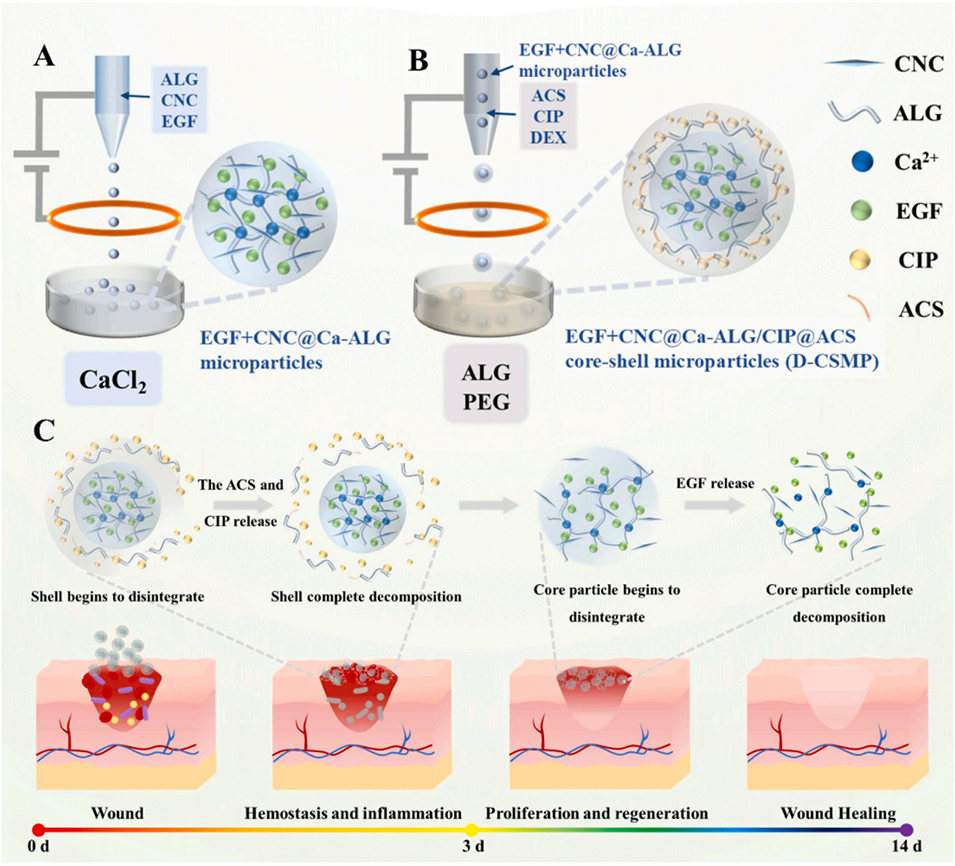
图1 (A, B) 展示了通过两步全水相微流控方法制备D-CSMP的示意图。首先通过离子交联法制备海藻酸钙(Ca-ALG)微粒,包载表皮生长因子(EGF)和纤维素纳米晶体(CNC),形成内核;随后在内核表面包裹一层含有环丙沙星(CIP)的烷基化壳聚糖(ACS)外壳,形成核壳结构的D-CSMP。(C) 展示了D-CSMP在伤口愈合过程中提供时间序列功能的示意图:壳层中的CIP在初期提供抗菌保护,其后核层持续释放EGF以促进细胞增殖和组织重塑。
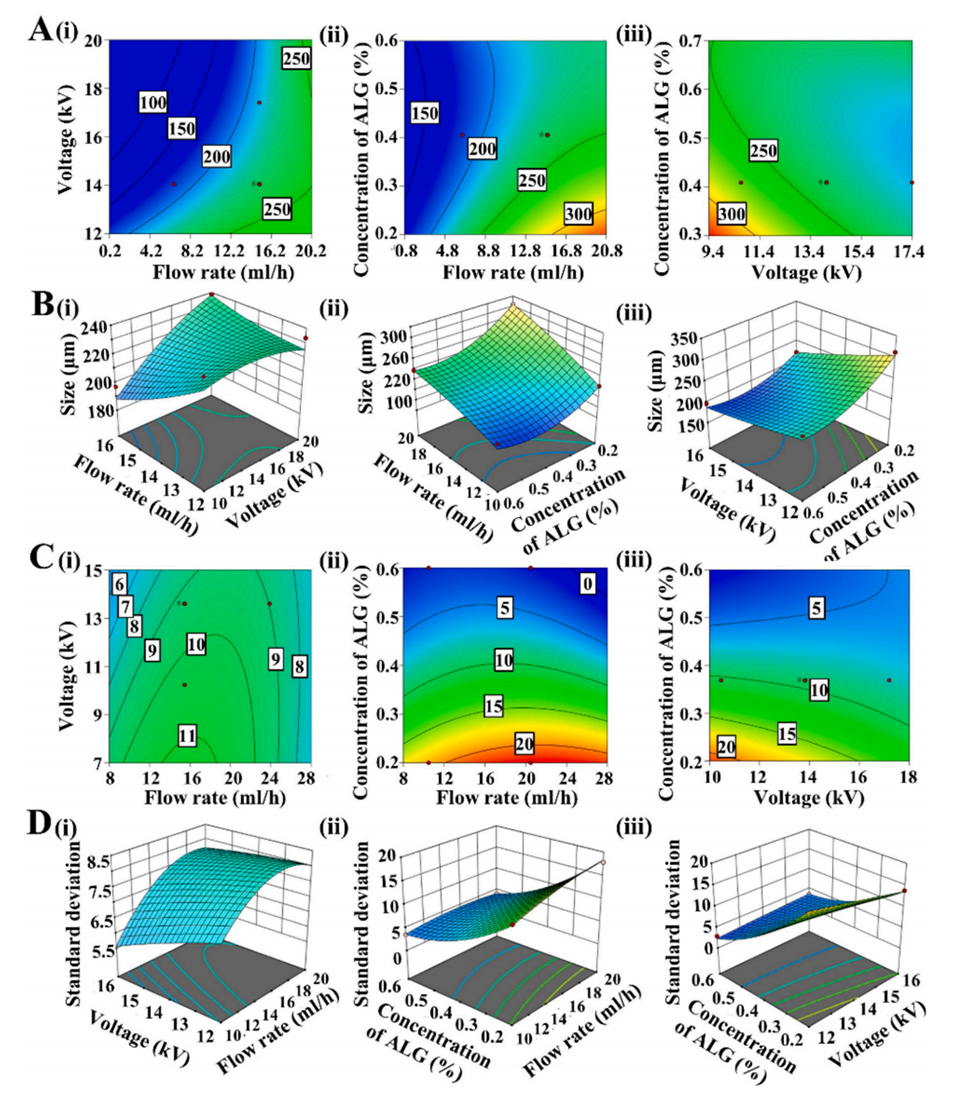
图2展示了通过响应面法(RSM)优化CNC@Ca-ALG微粒制备条件的结果。(A, B)以微粒直径为响应值的等高线图和三维响应面图,显示电压和分散相流速增加会使微粒直径变大,而高流速结合低海藻酸盐浓度也会导致微粒变大。(C, D) 以标准偏差为响应值的等高线图和三维响应面图,显示在适中的电压和流速条件下,标准偏差最小,微粒尺寸分布最均匀。
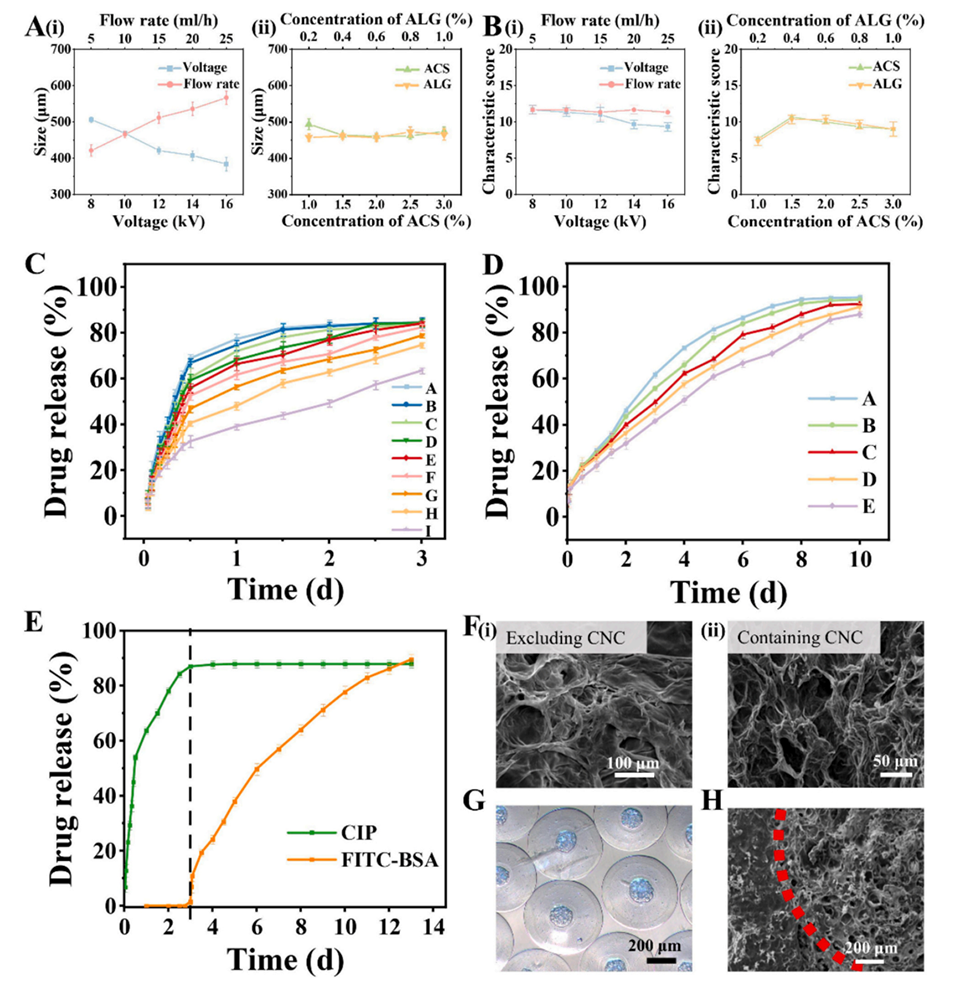
图3 (A, B) 单因素实验结果,显示电压和流速显著影响核壳微粒(CSMP)的直径,而ACS和ALG的浓度主要影响其均匀性。(C) 不同壳厚度的CSMP中CIP的体外释放曲线,表明当壳厚度为153.70 ± 2.21 μm时,CIP可在3天内完全释放。(D) 不同CNC浓度下EGF的体外释放曲线,显示2.0%的CNC浓度可实现10天的持续释放。(E) D-CSMP的体外释放曲线,表明CIP在3天内完全释放,EGF从第4天开始释放,持续至第13天。(F) SEM图像,显示含CNC的CNC@Ca-ALG微粒内部结构更疏松。(G) D-CSMP的光学显微镜图像,显示其具有清晰的核壳结构。(H) D-CSMP的截面SEM图像,清晰显示了核壳结构的分层。
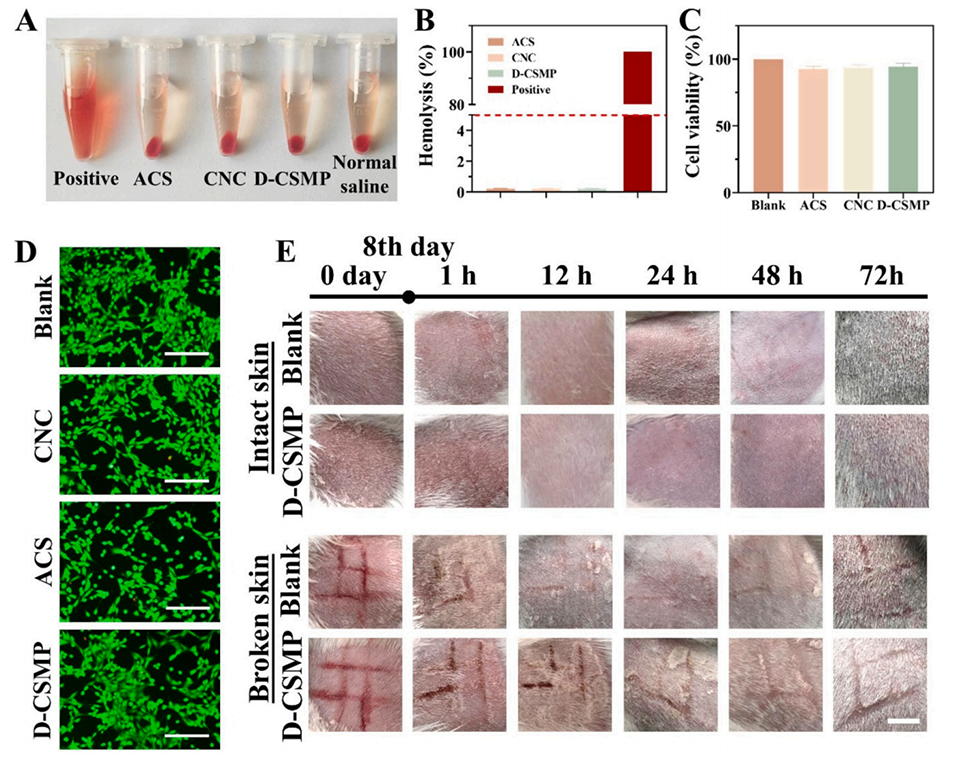
图4展示了D-CSMP及其组成材料的生物相容性测试结果。(A) 溶血实验结果,显示D-CSMP及其成分不会引起溶血,具有良好的血液相容性。(B) 溶血率统计,所有样本的溶血率均低于5%。(C) 细胞增殖实验结果,显示D-CSMP及其成分对L929细胞的增殖无明显抑制作用。(D) 活/死细胞染色图像,显示D-CSMP处理后的细胞存活率高,细胞状态良好。(E) 皮肤刺激实验结果,表明D-CSMP对皮肤无明显刺激性。
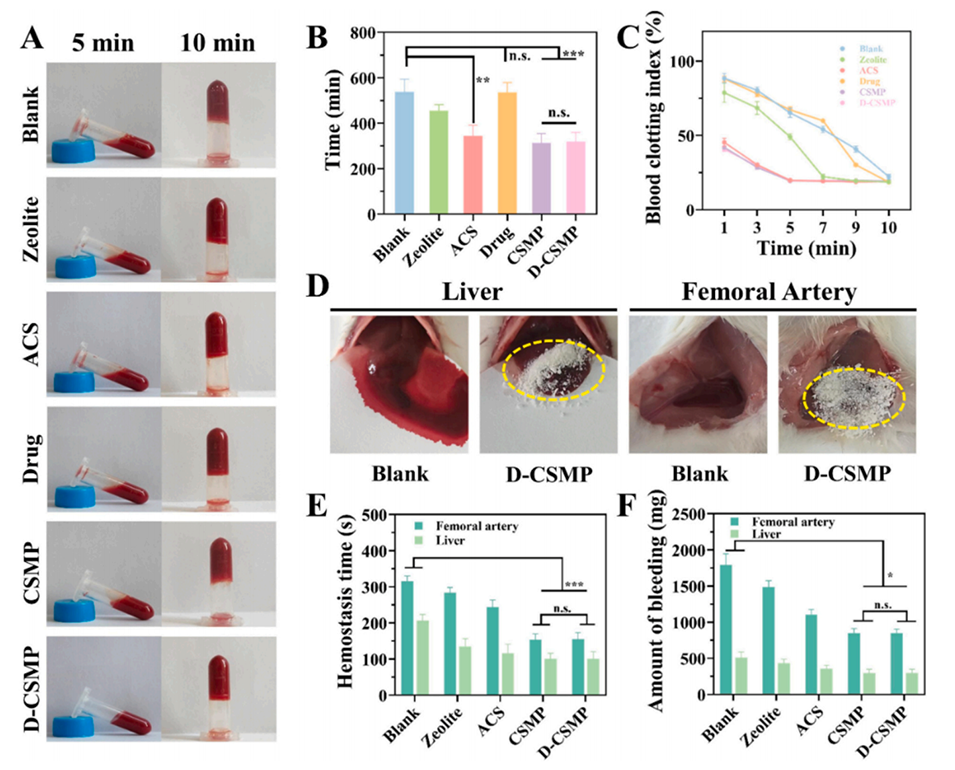
图5展示了D-CSMP的体外和体内止血性能。(A) 不同样品的体外凝血状态图。(B) 不同样品的体外凝血时间统计,D-CSMP的凝血时间显著缩短。(C) 不同样品的血液凝固指数(BCI),D-CSMP表现出良好的凝血能力。(D) D-CSMP在肝脏和股动脉出血模型中的止血效果图。(E, F) 体内止血实验结果,D-CSMP显著缩短了止血时间并减少了出血量。
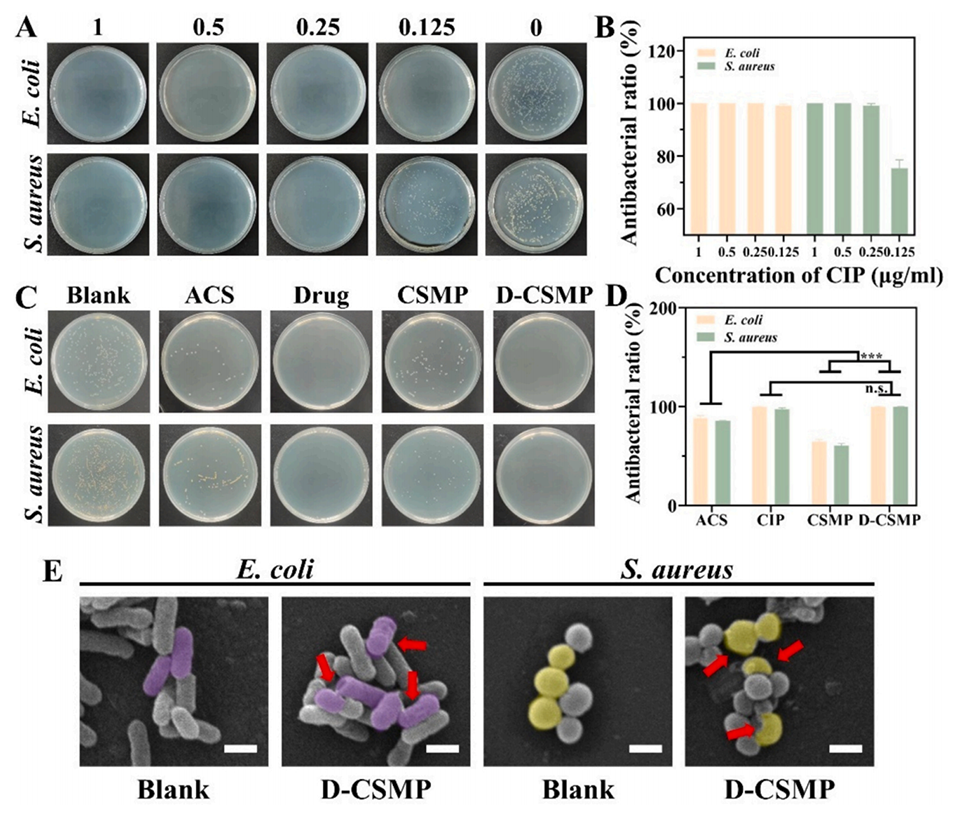
图6展示了D-CSMP的抗菌性能测试结果。(A) CIP的最小抑菌浓度(MIC)实验结果。(B) D-CSMP对大肠杆菌和金黄色葡萄球菌的MIC测定。(C) 不同样品的抗菌效果测试。(D) 抗菌率统计,D-CSMP表现出优异的抗菌性能。(E) 细菌与D-CSMP共培养前后的SEM图像,显示细菌形态发生了明显变化,表明D-CSMP具有良好的抗菌效果。
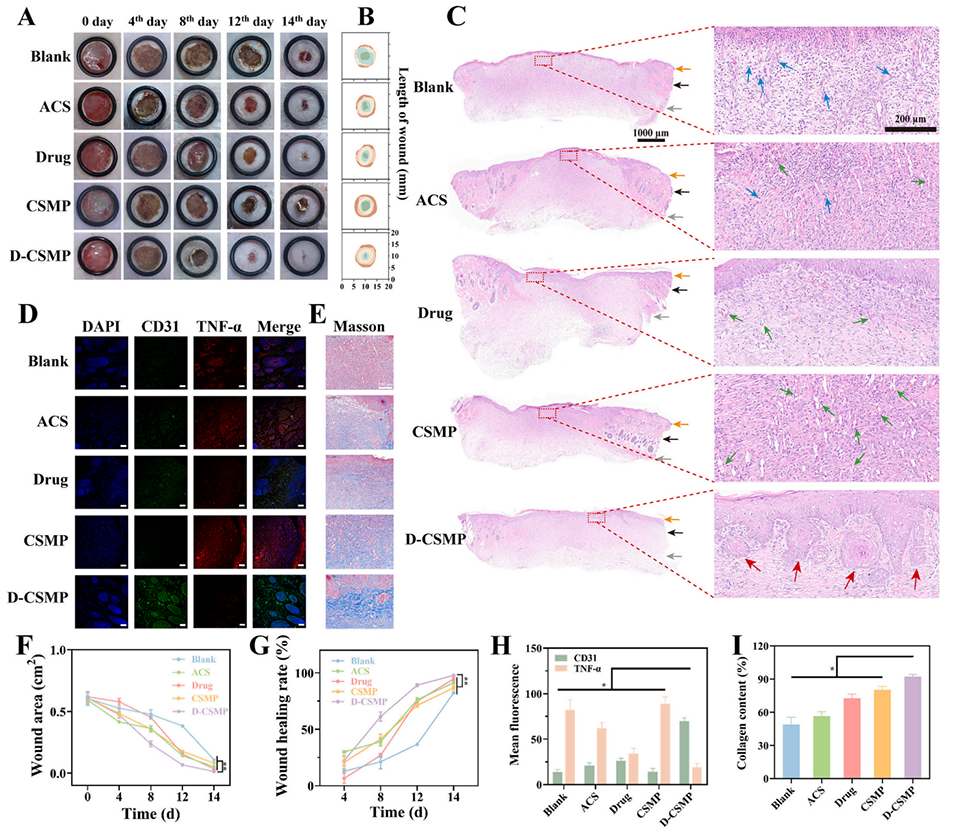
图7展示了D-CSMP在皮肤伤口愈合中的效果。(A) 不同样品处理的伤口愈合过程图。(B) 伤口愈合示意图。(C) 伤口组织的HE染色图像。(D) 伤口组织的免疫荧光染色图像,显示D-CSMP能显著减少炎症细胞浸润。(E) 伤口组织的Masson染色图像,显示D-CSMP促进胶原沉积。(F) 不同时间点各组伤口面积统计。(G) 不同时间点各组伤口愈合率统计,D-CSMP的愈合率最高。(H) 组织免疫荧光染色图像的荧光强度定量分析,显示D-CSMP处理的伤口中TNF-α和CD-31水平变化显著。(I) 胶原含量的定量统计,D-CSMP组胶原含量最高。
论文链接:https://doi.org/10.1016/j.ijbiomac.2024.136685














