
导读:
尽管口服递送治疗剂具有许多优势,但其应用受到消化道苛刻环境(如强酸性和高渗透压)的限制。这些条件削弱了药物活性并阻碍靶向释放。近期,有研究人员开发了一种用于治疗炎症性肠病(IBD)的多室水凝胶微球,其通过三重乳液微流控技术制备,具有同心薄油层结构,能够在胃部苛刻条件下保护药物,并实现肠道靶向释放,有效维持药物的抗炎活性并促进肠道上皮细胞的迁移与增殖。相关研究以“Multicompartmental Hydrogel Microspheres with a Concentric Thin Oil Layer: Protecting and Targeting Therapeutic Agents for Inflammatory Bowel Disease”为题目,发表在期刊《ACS Applied Bio Materials》上。
本文要点:
1、本研究开发了一种具有同心薄油层的多隔室水凝胶微球,以显著提高治疗炎症性肠病(IBD)的口服药物输送效率。
2、这些微球是利用三重乳液液滴产生的,其特征是中间油层将两个预聚物相分开,研究人员能够通过量身定制的聚合策略微调每个隔室的组成。
3、同心油层可保护药物免受胃部强酸影响,不同于传统含水性核的微胶囊,其水凝胶核在胃内高渗透压条件下表现出优越的稳定性。通过调整外壳成分,可实现pH响应性释放。
4、在胃酸条件下,这种微球保留5-氨基水杨酸和KPV(一种抗炎三肽)的抗炎活性,有效促进结肠细胞迁移与增殖,提高了药物治疗的整体效果。
同心薄油层在微球中具有以下关键作用:
1、扩散屏障:
同心薄油层作为扩散屏障,能够有效阻挡胃酸、酶以及其他外界物质的渗透,保护内部药物免受胃部酸性环境的破坏。
2、增强稳定性:
在胃部高渗透压条件下,油层可以维持微球的结构完整,防止因渗透压差导致的水分流失和微球破裂。
3、选择性释放:
油层可以根据肠道环境的变化(如pH值的升高)实现药物的选择性释放。
本研究展示了两种pH响应型释放机制:一种是通过聚丙烯酸(PAA)交联的PEGDA外壳在碱性条件下膨胀,导致油层破裂并释放药物;另一种是通过藻酸盐外壳在碱性条件下解离,从而释放药物。
4、高效包封:
油层能够有效包裹小分子和亲水性药物,防止其在胃部环境中过早释放。
5、机械保护:
在机械搅拌等外力作用下,油层能够维持微球的完整性,防止药物因外力作用而损失。
总体而言,同心薄油层不仅显著提高了微球在胃肠环境中的稳定性和性能,还实现了药物的高效包封和靶向释放,使其成为一种理想的口服药物递送系统。
该多隔室水凝胶微球主要基于三重乳液液滴技术(triple-emulsion droplet technique),具体制备步骤如下:
1.微流控装置的制备
使用内径为560 μm的圆形毛细管,通过微电极成型装置(P-97,Sutter Instrument)将其内径缩小至100 μm。
对毛细管进行双重硅烷化处理:
使用十八烷基三甲氧基硅烷(n-octadecyltrimethoxysilane)处理10分钟,使表面疏水。
使用2-[甲氧基(聚氧乙烯)丙基]三甲氧基硅烷处理30分钟,赋予表面亲水性。
将处理后的毛细管插入内宽为05 mm的方形毛细管中,确保其外径(1 mm)略小于方形毛细管的内宽。
将一根内径缩小至50 μm的锥形毛细管(通过加热和手动塑形)插入注射毛细管中,用于双流体注入。
在收集端,将方形毛细管内的收集毛细管也用十八烷基三甲氧基硅烷处理,使其疏水。
2.三重乳液液滴的生成
内水相(IW):通过较小的锥形毛细管注入水凝胶预聚物溶液(如PEGDA溶液或琼脂糖溶液)。
油相(IO):将油相(如大豆油,含有5%聚甘油蓖麻醇酸酯PGPR)与内水相共同注入注射毛细管中。由于油相对注射毛细管内壁的疏水性,形成周期性的水凝胶预聚物滴。
外水相(M):通过注射毛细管与方形毛细管之间的间隙注入另一层水凝胶预聚物溶液。
外油相(O):在收集毛细管入口处,用外油相(如矿物油,含有5wt% Span80)剪切三相流体,形成均匀的三重乳液液滴。
3.微球的固化
光固化:对于PEGDA基的微球,将三重乳液液滴暴露于紫外光下,进行一步光聚合,形成PEGDA/油/PEGDA微球。
离子交联:对于藻酸盐基微球,将光固化后的微球转移到含有Ca2+的酸性浴中,通过离子交联形成藻酸盐凝胶外壳。
热诱导聚合:对于琼脂糖基微球,将微球转移到冷水中,通过热诱导聚合形成琼脂糖核心。
4.微球的表征
使用光学显微镜和扫描电子显微镜(SEM)观察微球的形态和尺寸分布。
通过荧光显微镜观察微球核心和外壳的荧光标记物(如Alexa Fluor 594和FITC-葡聚糖),验证油层的包裹效果和微球的多隔室结构。
5.微球的后处理
根据需要,微球可以进一步处理以赋予其特定功能,例如:
在外壳中嵌入pH响应性聚合物(如聚丙烯酸PAA)以实现肠道靶向释放。
通过离子交联或化学交联进一步稳定微球结构。
关键点总结
微流控装置:通过精确控制毛细管的内径和表面性质,实现三重乳液液滴的连续生成。
三重乳液液滴的形成:通过内水相、油相、外水相和外油相的协同流动,形成具有同心薄油层的微球。
固化方法:根据微球的组成,选择光固化、离子交联或热诱导聚合等方法进行固化。
功能化:通过调整外壳的组成(如嵌入pH响应性聚合物),实现微球的刺激响应性释放功能。
这种制备方法不仅能够精确控制微球的结构和组成,还能实现高效的药物封装和保护,为口服药物递送提供了一种创新的解决方案。
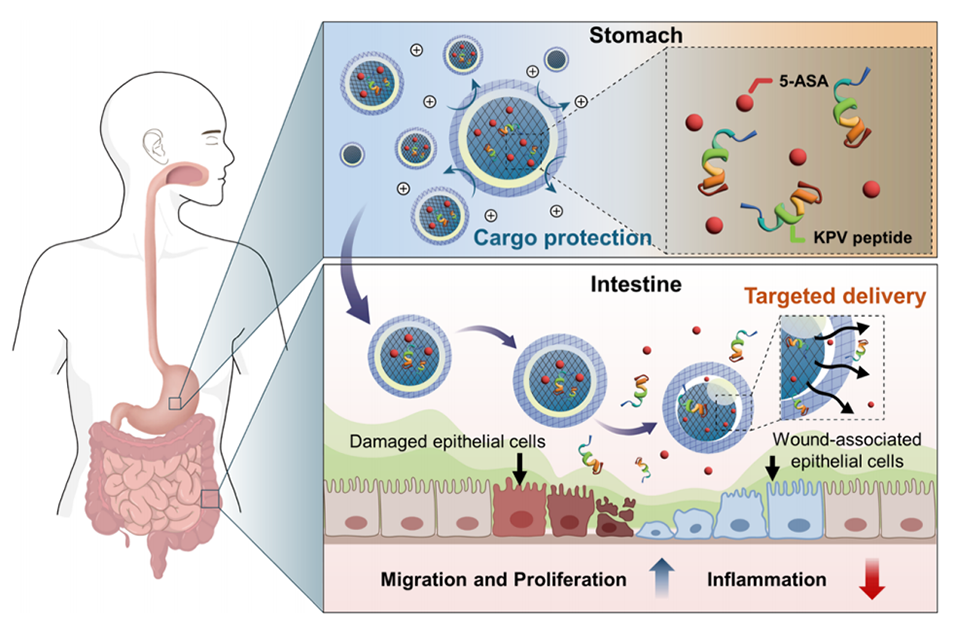
图1:多隔室水凝胶微球的示意图。微球通过同心薄油层保护内部药物免受胃部酸性环境的影响,同时在肠道靶向释放药物,维持药物的抗炎活性,促进结肠上皮细胞的迁移和增殖。
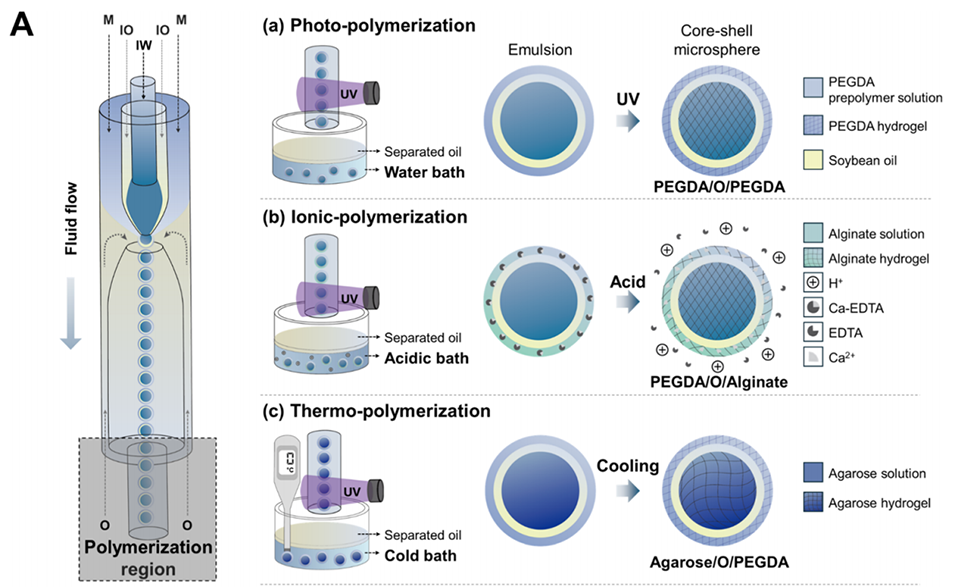
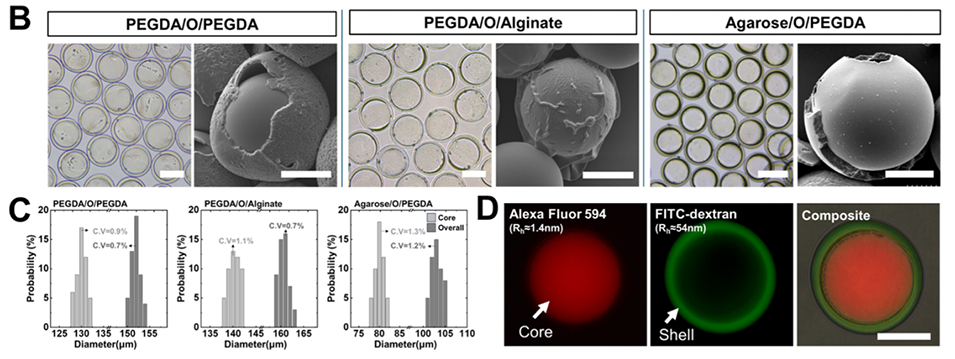
图2:多隔室水凝胶微球的制备过程及表征。(A)通过三重乳液液滴技术制备水凝胶-油-水凝胶(H/O/H)微球的示意图,展示了不同聚合路线制备的微球(如PEGDA/O/PEGDA、PEGDA/O/藻酸盐、琼脂糖/O/PEGDA)。(B)光学和扫描电子显微镜(SEM)图像,展示了不同组成微球的均匀制备。(C)微球的整体尺寸和核心尺寸分布图,证明其尺寸均匀性。(D)荧光和复合显微图像显示每个隔室中含有两种荧光染料的多隔室微球:核心隔室为Alexa Fluor 594(红色,Dh = 1.4 nm),壳隔室为FITC-葡聚糖(绿色,Dh = 54 nm)。所有比例尺代表100个μm。
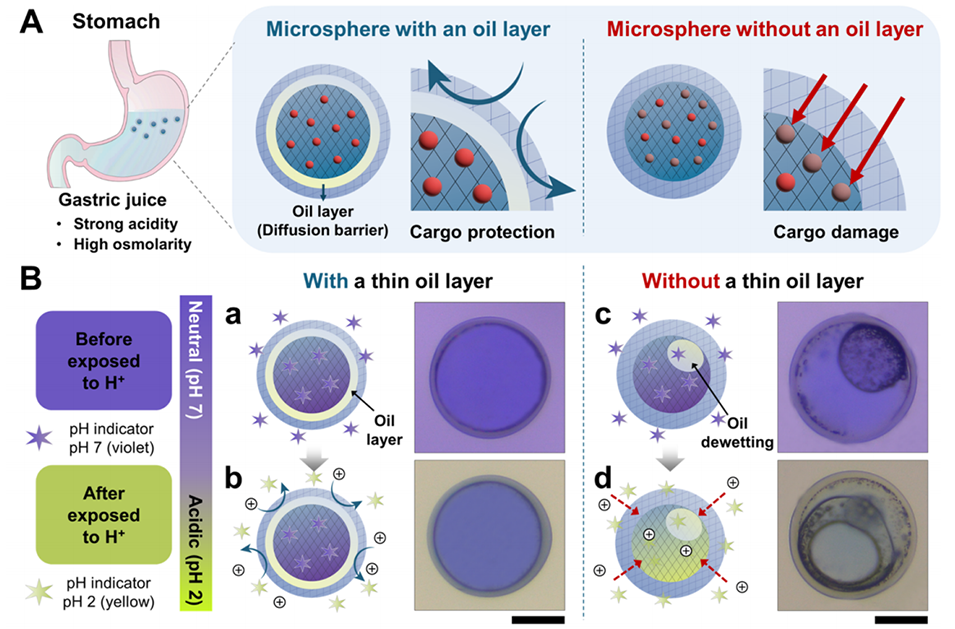
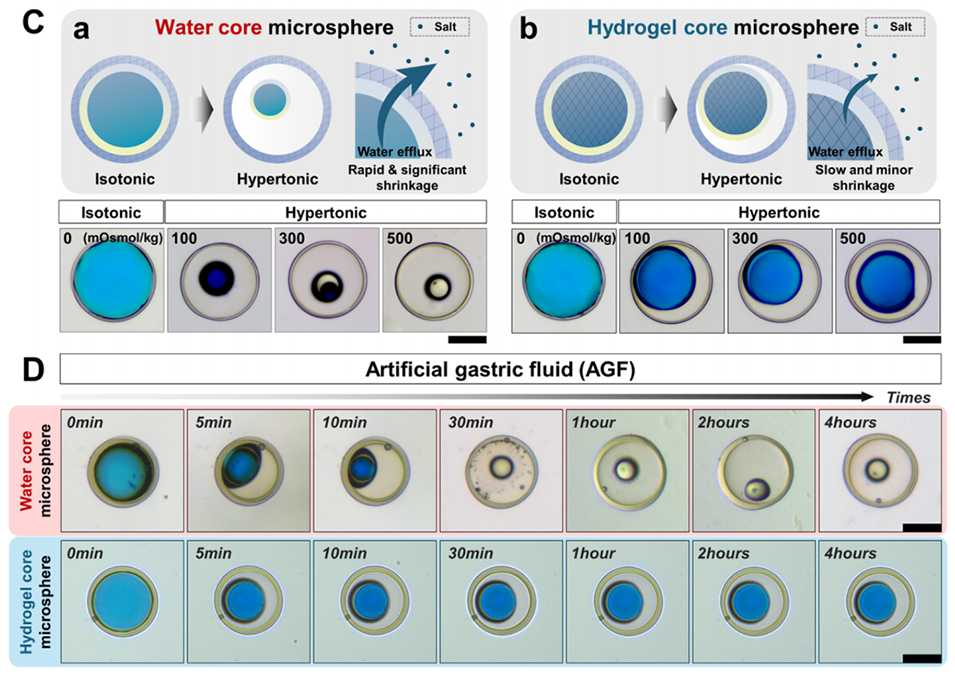
图3:多隔室水凝胶微球在胃部苛刻条件下的稳定性。(A)示意图显示微球在胃部强酸和高渗透压环境下的保护机制。(B)光学显微图像对比显示,油层可以防止酸性环境对核心的侵蚀,而无油层的微球则无法阻止酸性物质进入核心。(C)对比水核和水凝胶核微球在高渗透压条件下的稳定性,水凝胶核微球表现出更高的稳定性。(D)在人工胃液中长期稳定性测试的光学显微图像,证明微球在模拟胃液中的稳定性。
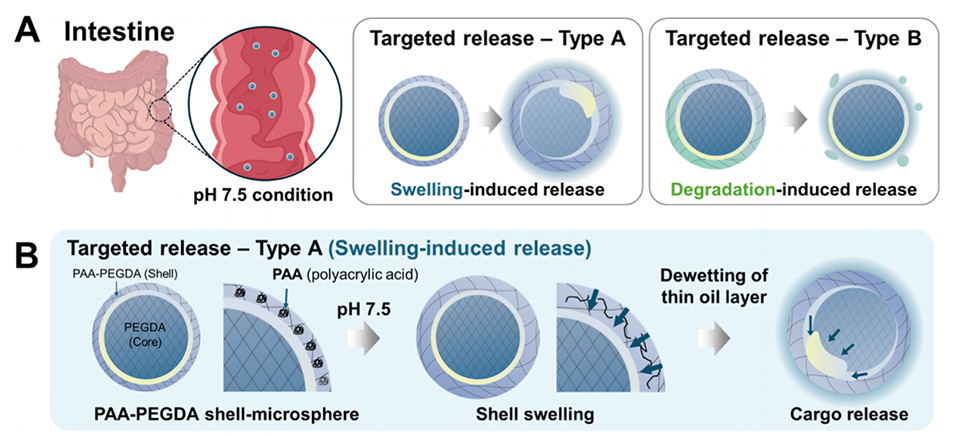
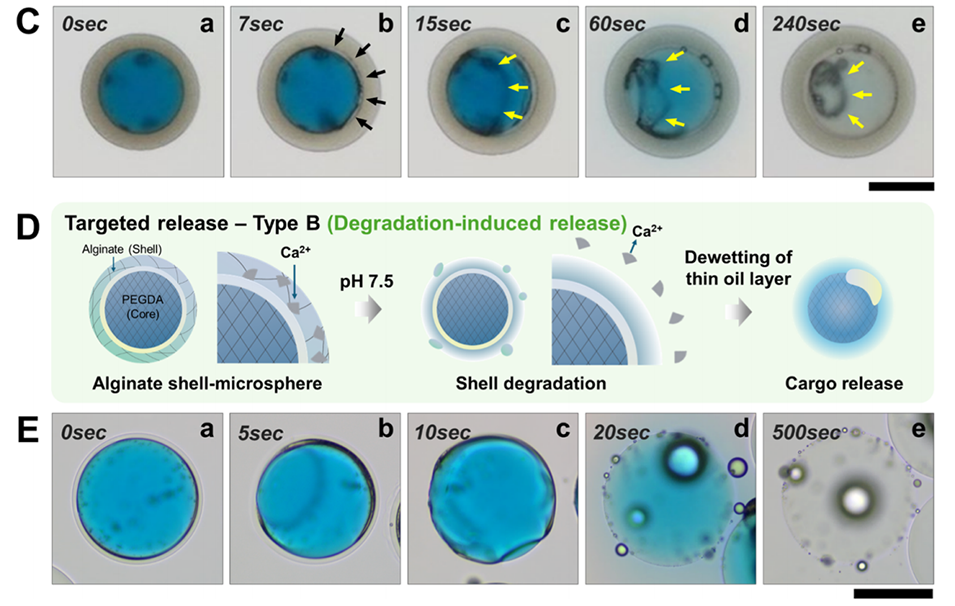
图4:展示多隔室水凝胶微球的刺激响应性释放机制。(A)示意图显示两种pH响应型释放机制:膨胀诱导释放(Type 1)和降解诱导释放(Type 2)。(B-C) PEGDA壳层中嵌入聚丙烯酸(PAA)的微球在碱性条件下通过膨胀诱导释放药物。(D-E)具有藻酸盐壳层和PEGDA核的微球在碱性条件下通过壳层解离实现药物释放。
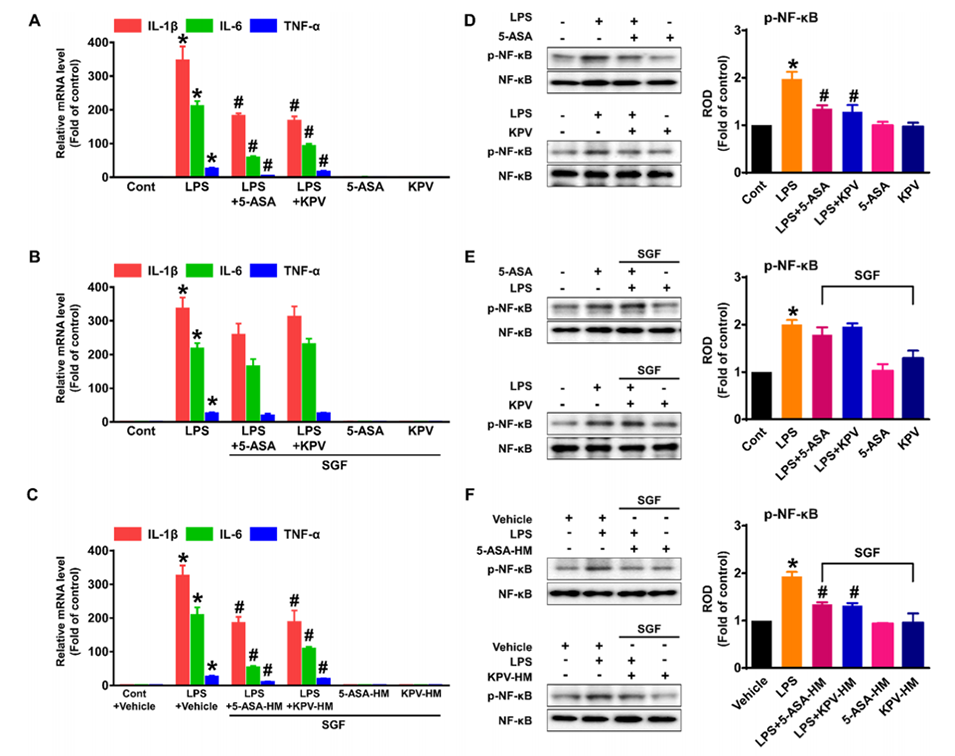
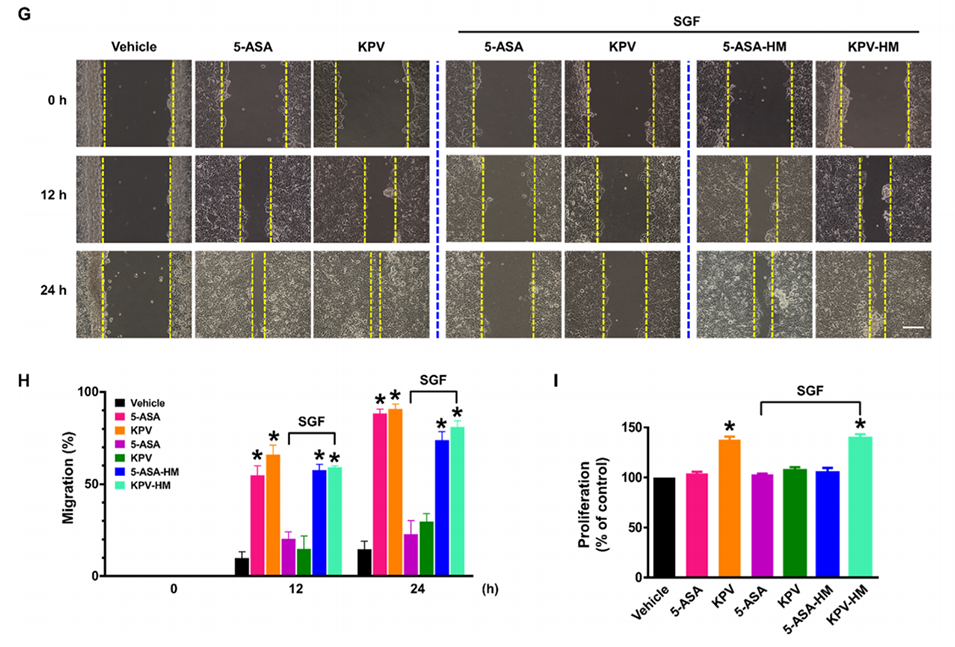
图5:展示多隔室水凝胶微球对药物(5-ASA和KPV)的保护效果及其抗炎活性。(A) RAW 264.7巨噬细胞在LPS刺激下,5-ASA和KPV显著抑制炎症因子(IL-1β、IL-6、TNF-α)的表达。(B)经人工胃液(SGF)处理后,5-ASA和KPV的抗炎效果丧失。(C)将5-ASA和KPV封装在微球中(5-ASA-HM和KPV-HM),即使在SGF处理后,仍能保持抗炎活性。(D-F)通过Western blot验证NF-κB磷酸化水平,证明微球封装的药物在胃酸条件下仍能抑制NF-κB激活。(G-H) Caco-2细胞的划痕实验表明,微球封装的药物在SGF处理后仍能促进细胞迁移。(I) KPV-HM在SGF处理后仍能促进Caco-2细胞增殖,而5-ASA无显著影响。
论文链接:https://doi.org/10.1021/acsabm.4c01763














