
导读:
在预定药物比例下开发具有高载药效率的联合化疗系统以实现协同效应对于癌症治疗至关重要。近期,清华大学化学系徐江飞副研究员等人开发了一种新型聚合物纳米颗粒,用于共递送线粒体靶向肽和铂(IV)前药。该纳米颗粒通过乳液界面聚合制备,能够在肿瘤微环境中响应性地释放药物,并通过线粒体靶向肽抑制癌细胞的能量代谢和DNA修复过程,显著增强铂类药物的抗癌效果,同时降低对正常细胞的毒性。相关研究以“A Polymeric Nanoparticle to Co-Deliver Mitochondria-Targeting Peptides and Pt(IV) Prodrug: Toward High Loading Efficiency and Combination Efficacy”为题目,发表在期刊《Angewandte Chemie International Edition》上。
本文要点:
1、本研究开发了一种新型聚合物双药纳米粒子(PDDN),用于增强癌症治疗中的联合化疗效果。
2、PDDN由源自奥沙利铂的Pt(IV)前药和靶向线粒体的细胞毒性肽组成,通过乳液界面聚合制备,以确保高药物负载效率和协同治疗效果。
3、聚合物双药纳米颗粒的解聚和铂前药的活化分别由肿瘤细胞外酸性环境和肿瘤细胞内的高谷胱甘肽水平有效触发。
4、研究表明,线粒体靶向肽可抑制ATP依赖性过程,包括药物外排和DNA损伤修复,从而增加铂类药物在癌细胞内的积累。
5、PDDN在细胞系来源和患者来源的异种移植肺癌模型中展现出显著的抗肿瘤效果,有望用于联合化疗,实现增强的抗癌活性和降低的副作用。
这种聚合物纳米颗粒是如何实现高载药效率的?
1、单体设计:通过设计一种含有两个酸酐基团的Pt(IV)前药(如OxPt-CDM)以及一种具有六个侧链氨基的靶向线粒体的细胞毒性肽(如FKLAK),使其能够在聚合过程中直接作为单体参与反应。
2、乳液界面聚合:PDDN采用乳液界面聚合技术,将油溶性单体OxPt-CDM和水溶性单体FKLAK在乳液界面进行聚合反应,快速自组装成纳米粒子。这种方法确保了在聚合过程中药物载体的封装效率和聚合物的生物相容性。
3、高度药物负载与分散性:生成的两亲性交联聚合物能够自组装成纳米粒子,并具有良好的水分散性,几乎可以达到100%的药物负载效率。这意味着所有组成成分都可以发挥其治疗效力,提高了药物的整体有效性。
4、可控释放机制:在肿瘤酸性环境下,PDDN能够被水解,从而按预设的药物比例释放FKLAK和OxPt-CDM。这样不仅确保了药物的释放效率,还通过酸性条件促进前药的激活。
综上所述,PDDN通过优化药物设计、采用高效的聚合技术,实现了高载药效率,为癌症治疗提供了更有效的载药系统。
使用Pt(IV)前药在癌症治疗中的优势主要包括以下几点:
1、选择性活化:Pt(IV)前药可以在癌细胞内部通过消耗高水平的谷胱甘肽(GSH)被选择性地还原为具有高毒性的Pt(II)形式,这种特性有助于增强对癌细胞的杀伤效果,同时减少对正常细胞的毒性。
2、降低副作用:由于Pt(IV)前药在体内表现出化学惰性,能够降低对正常细胞的毒性,从而减少治疗过程中的副作用。
3、联合化疗增强:Pt(IV)前药通常与其他药物共同应用,按照特定的剂量比例结合,可以提高Pt类药物的疗效并促进协同治疗效果。
4、提高细胞内药物积累:使用线粒体靶向肽结合Pt(IV)前药,可以抑制导致药物耐受性的ATP依赖性过程(如药物外排和DNA损伤修复),进而提高Pt类药物在癌细胞内的积累。
总之,Pt(IV)前药通过选择性激活和协同效应,在提高抗癌效果的同时,实现了对正常细胞的保护,展现出良好的应用前景。
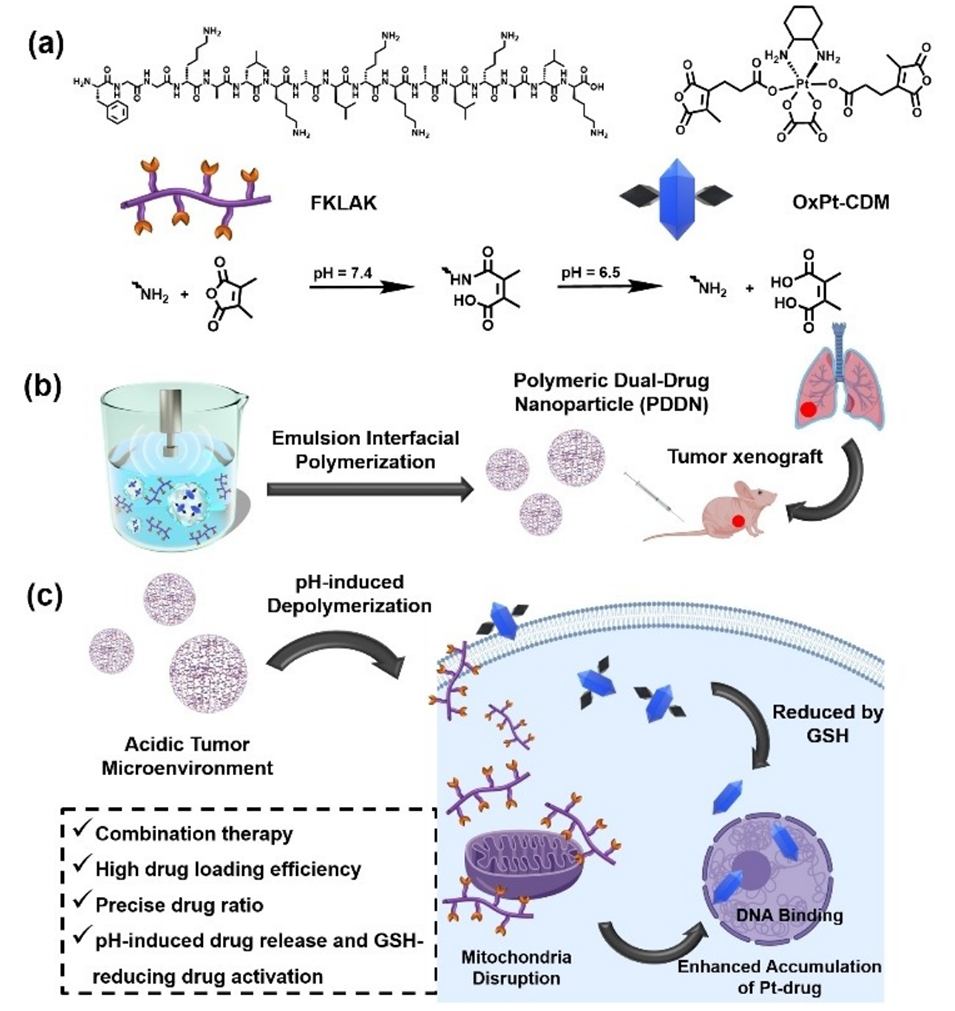
Scheme 1.(a)FKLAK和OxPt-CDM的化学结构,中性条件下酸酐基团和氨基反应形成酰胺基,酸性条件下酸敏感的酰胺基水解;(b)通过乳液界面聚合制备PDDN的示意图,以及建立患者来源的异种移植物肺癌模型;(c)PDDN在癌症环境中的解聚以及Pt前药的活化。
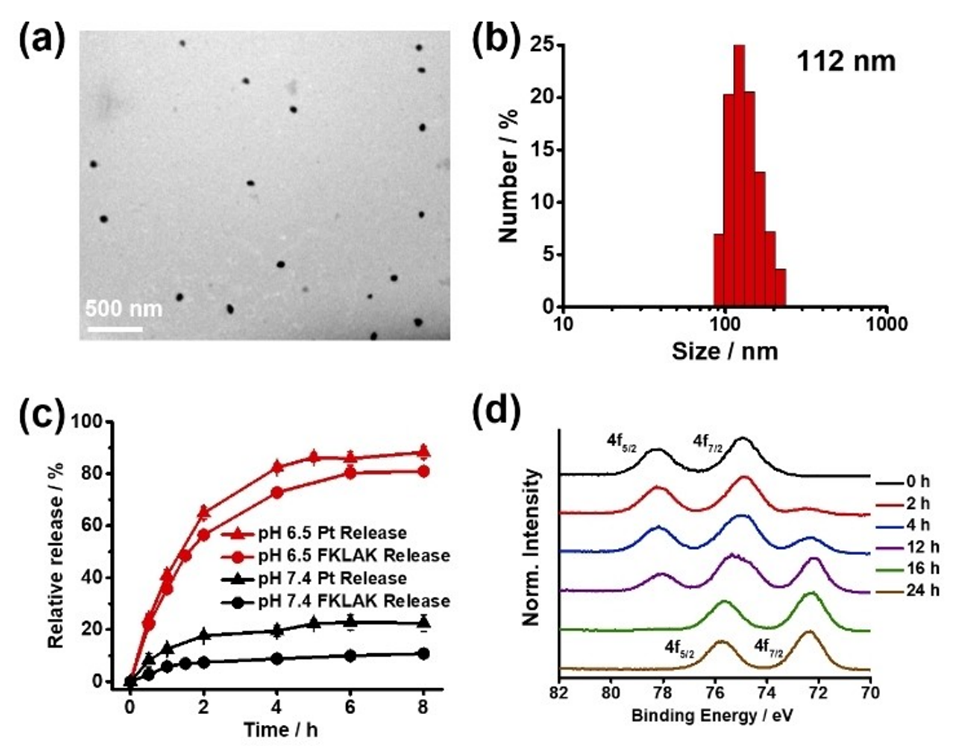
图1.PDDN的TEM图像(a)和DLS测量(b);(c)PDDN在不同pH条件下随时间释放FKLAK和铂药物的情况;(d)与GSH(10mM)孵育的Pt4f的时间依赖性XPS曲线。
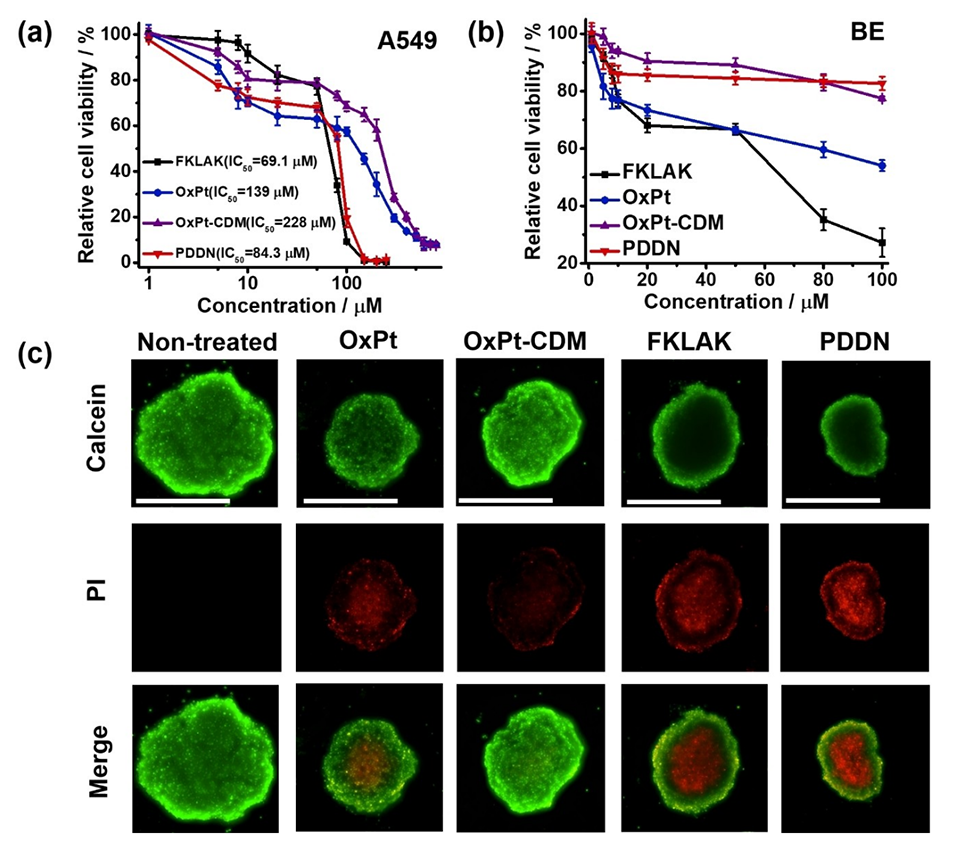
图2.OxPt、OxPt-CDM、FKLAK和PDDN对(a)A549细胞和(b)BE细胞的细胞存活率影响。数据为六次独立实验的平均值±标准差;(c)在pH6.5下用100μM OxPt、OxPt-CDM、FKLAK和PDDN处理的A549细胞三维球体模型(3DSM)最大横截面的CLSM图像(比例尺:500μM)。
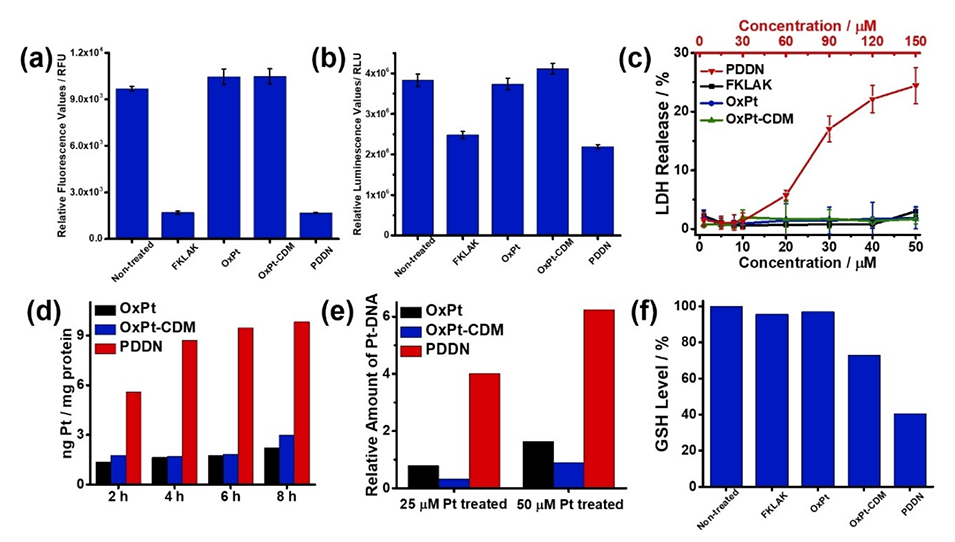
图3.不同处理后A549细胞的线粒体膜电位分析(a)、ATP水平分析(b)和LDH释放(c)。数据为六次独立实验的平均值±标准差;OxPt、OxPt-CDM和PDDN孵育后A549细胞的时间依赖性细胞内Pt摄取(d)和Pt-DNA加合物形成的相对量(e);不同处理后A549细胞的相对谷胱甘肽(GSH)水平(f)。
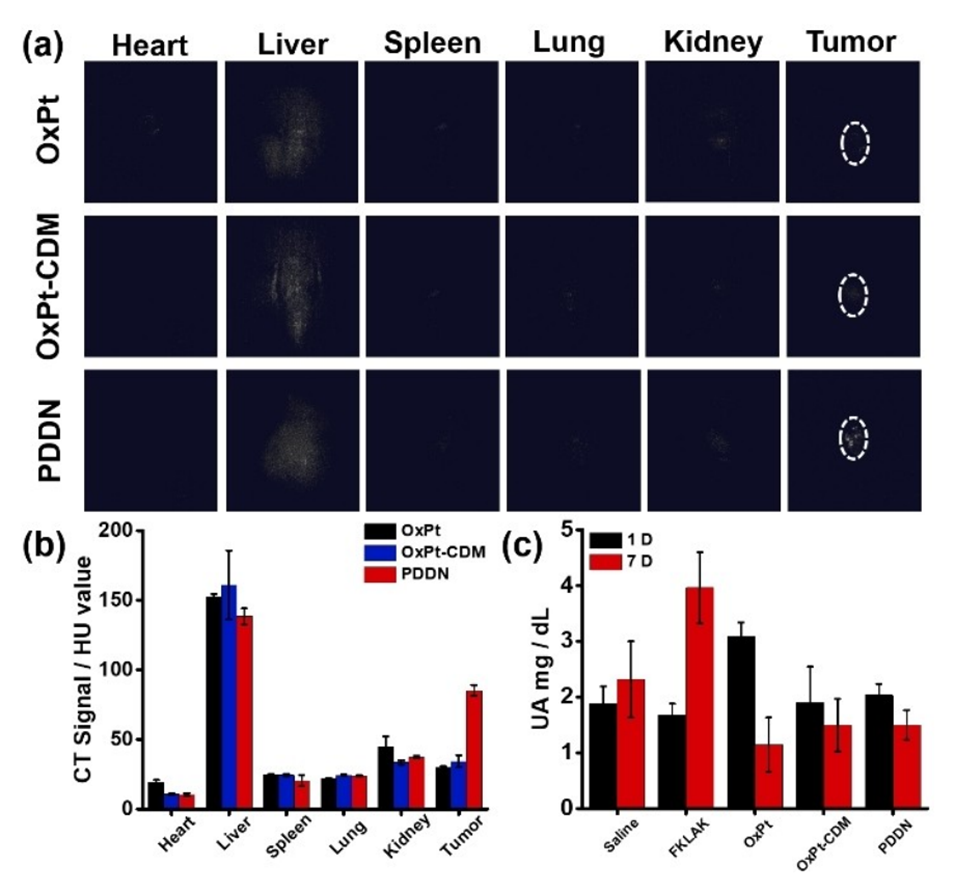
图4.在单次静脉注射OxPt、OxPt-CDM和PDDN 12小时后分离自小鼠的组织的CT图像(a)和CT信号分析(b);(c)在第1天和第7天单次静脉给药后小鼠UA的变化。数据为三次独立实验的平均值±标准差。
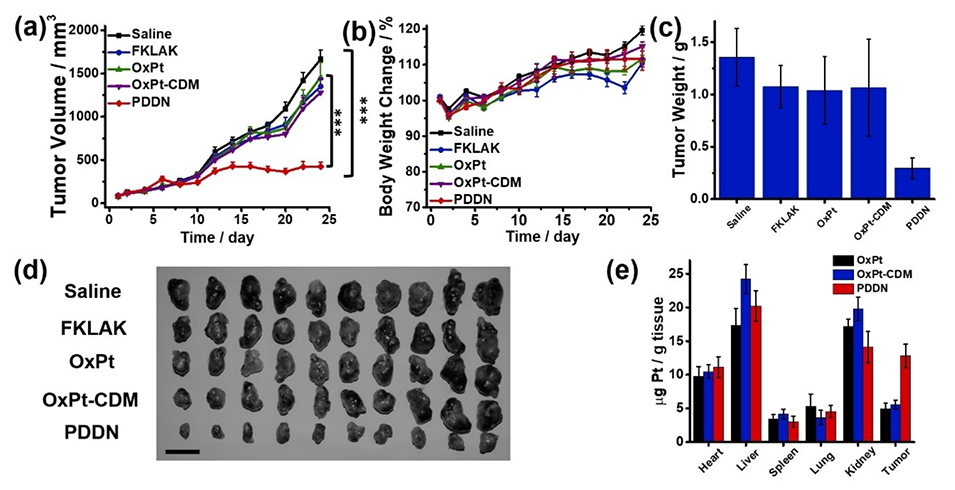
图5.对携带A549细胞系来源异种移植(CDX)模型的BALB/c小鼠进行不同治疗的疗效分析。A549肿瘤的肿瘤生长曲线(a)、体重变化(b)、肿瘤重量(c)和照片(d);静脉注射生理盐水、OxPt、OxPt-CDM、FKLAK和PDDN的小鼠在第24天分离出不同组织的Pt积聚(e)(n=10,***P<0.001)。
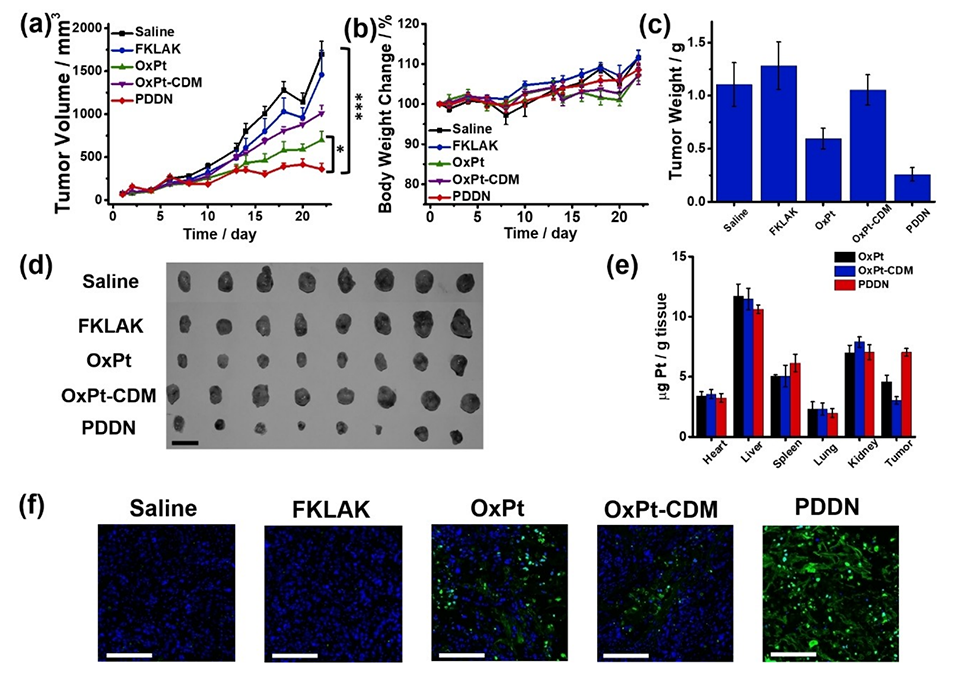
图6.对携带肺癌患者来源异种移植(PDX)模型的BALB/c小鼠进行不同治疗的疗效分析。肿瘤生长曲线(a)、体重变化(b)、肿瘤重量(c)和肿瘤照片(d);静脉注射生理盐水、OxPt、OxPt-CDM、FKLAK和PDDN的小鼠在第22天分离出不同组织的Pt积累(e)。(n=8,*P<0.05,***P<0.001);(f)第22天分离自小鼠的肿瘤切片的TUNEL染色。对于TUNEL检测,断裂的DNA链用FITC(绿色)染色。
论文链接:https://doi.org/10.1002/anie.202402291














