
导读:
近期,西安交通大学附属红会医院郝定均教授、黄大耿副主任医师、朱雷副主任医师等人开发了一种核壳结构的水凝胶微球(PC-GEN),用于脊髓损伤(SCI)治疗。该微球通过序贯释放氧化铈纳米颗粒(CONPs)和脊髓白质细胞外基质(swm-ECM),在缓解早期炎症的同时促进神经再生,显著改善了SCI大鼠的功能恢复。相关研究以“Core-shell hydrogel microspheres with sequential delivery of cerium oxide nanoparticles and spinal white matter extracellular matrix for improved functional recovery in spinal cord injury”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究开发了一种基于液滴微流控技术的核壳结构水凝胶微球(PC-GEN),用于脊髓损伤(SCI)的分阶段治疗。
2、微球外壳由聚乙二醇(PEG)包裹抗氧化抗炎的氧化铈纳米颗粒(CONPs),内核为负载脊髓白质细胞外基质(swm-ECM)与神经生长因子(NGF)的甲基丙烯酰化明胶(GelMA)水凝胶。
3、体外实验显示,PC-GEN在损伤初期(7天内)释放CONPs,有效清除活性氧(ROS),抑制炎症细胞浸润并促进巨噬细胞/小胶质细胞向M2表型极化;后续8周持续释放swm-ECM与NGF,通过调控细胞外基质沉积、减少胶质瘢痕形成,为轴突再生提供支持性微环境。
4、体内实验表明,PC-GEN显著降低脊髓损伤大鼠的神经元凋亡,促进轴突延伸、髓鞘再生及突触形成,并重建功能性神经环路。
5、行为学与电生理评估证实,PC-GEN治疗组大鼠运动功能明显恢复,后肢肌萎缩减轻。
6、RNA测序进一步揭示其通过上调促再生ECM基因、抑制炎症通路实现神经修复。该时序递送策略为脊髓损伤治疗提供了多阶段协同干预的新思路。
核壳结构水凝胶微球(PC-GEN)在脊髓损伤治疗中的优势和创新点如下:
1、精准时序控制:核壳分阶段降解匹配SCI病理进程(先抗炎后再生)。
2、生物相容性:微球低溶胀率(24小时溶胀比<18%)减少组织压迫损伤。
3、高活性保留:微流控温和交联保护CONPs抗氧化活性及NGF生物功能。
4、多靶点协同修复:通过调控细胞外基质沉积、减少胶质瘢痕形成,为轴突再生提供支持性微环境。
5、临床转化潜力:RNA测序证实其通过上调ECM相关基因(Fn1、Lama2)及神经营养因子(Ngf),下调炎症通路(NLRP3炎性小体),为复杂病理过程的系统干预提供新策略。
总之,该研究通过微流控技术实现复杂结构微球的可控合成,为脊髓损伤的序贯治疗提供了高效载体平台。
核壳结构水凝胶微球(PC-GEN)的制备主要基于液滴微流控技术,具体步骤如下:
1、材料准备
核心溶液:
10 wt% GelMA水凝胶,含5 mg/mL脊髓白质细胞外基质(swm-ECM)、5 mg/mL神经生长因子(NGF)及5%光引发剂(LAP)。
壳层溶液:
4 wt% PEG-4MAL水凝胶,负载1.5 mg/mL氧化铈纳米颗粒(CONPs)。
连续相流体:
矿物油(含25 mg/mL二硫苏糖醇(DTT)及2% Span-80表面活性剂)。
2、微流控芯片设计
三通道结构:
核心流通道:注入GelMA核心溶液。
壳层流通道:注入PEG-4MAL壳层溶液。
连续相通道:注入矿物油与交联剂(DTT)。
液滴生成单元:
通过Y型与T型结构结合,利用剪切力形成“油包水包水”(W/W/O)核壳液滴模板。
3、核壳微球生成
流体控制:
核心流速:2 μL/min(高粘度GelMA)。
壳层流速:10–20 μL/min(PEG-4MAL包裹核心)。
连续相流速:100–400 μL/min(矿物油剪切形成液滴)。
*流速调节可精确控制微球尺寸(平均直径143.8±7.6 μm)及壳层厚度。
紫外光固化核心:
液滴通过蛇形通道时,紫外光(波长365 nm)引发GelMA光聚合,形成稳定核心。
壳层交联:
壳层PEG-4MAL与连续相中的DTT通过迈克尔加成反应(Maletimide与硫醇基团)快速化学交联,形成致密外壳。
4、后处理与纯化
洗涤:
微球经PBS清洗3次,离心(1000 rpm,4℃,4分钟)去除矿物油残留。
保存:
纯化后的PC-GEN微球储存于无菌PBS中,备用。
5、关键参数与优化
尺寸均一性:
通过调节流速与溶液黏度,微球尺寸变异系数(CV)低至5.31%,确保批次稳定性。
载药效率:
CONPs封装率59.4%,NGF封装率84.1%,ECM浓度约3.5 μg/μL。
降解匹配性:
微球分两阶段降解:7天内壳层快速释放CONPs,56天内核心持续释放swm-ECM与NGF。
6、表征与验证
尺寸测量:
使用光学显微镜和ImageJ软件测量微球的尺寸,确保其均匀性和一致性。
结构观察:
荧光显微镜(FITC标记壳层)确认核壳分层结构。
成分分析:
FTIR光谱验证GelMA(3284 cm-1酰胺A带)与PEG-4MAL(1105 cm-1醚键)特征峰。
释放动力学:
ICP-MS(CONPs)与ELISA(NGF)检测时序释放曲线,确认无突释现象。
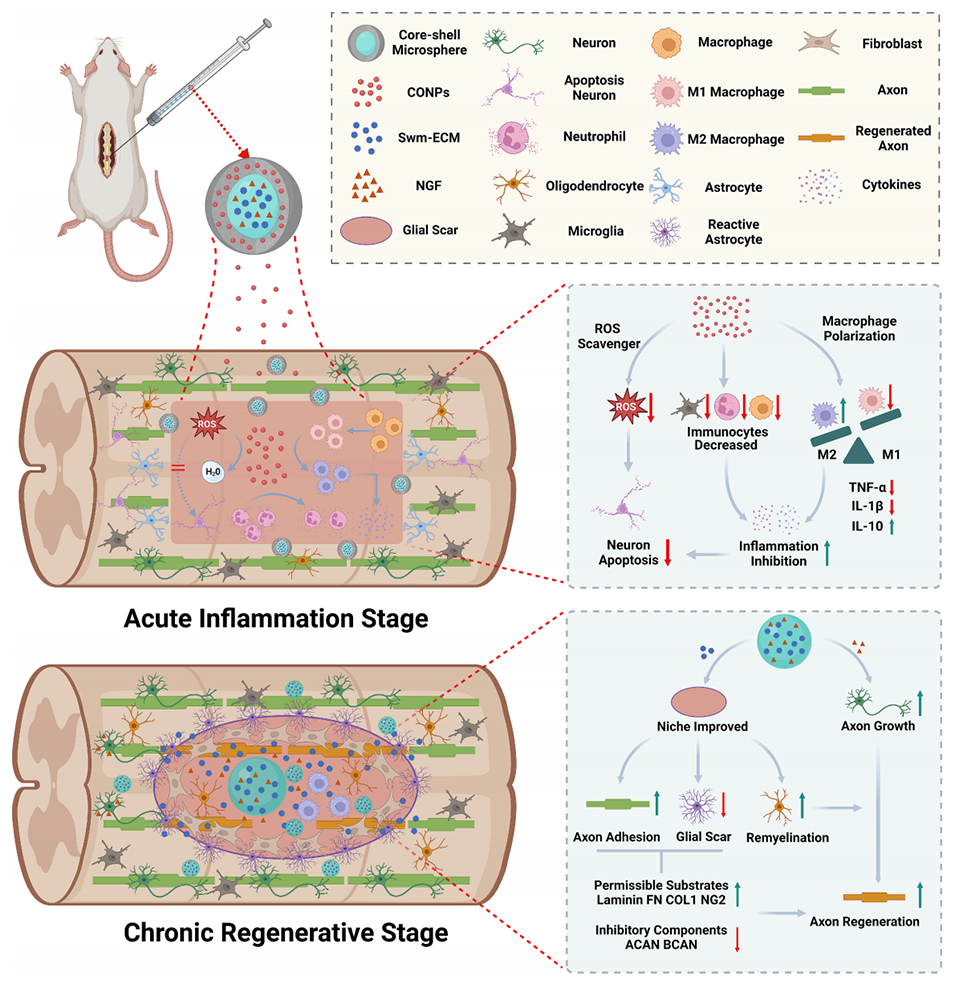
Scheme 1:核壳微球PC-GEN在T10脊髓损伤中的生物机制示意图。在急性炎症阶段,壳层释放的CONPs通过清除活性氧(ROS),减少炎症反应,并促进巨噬细胞/小胶质细胞向抗炎的M2表型极化,从而降低神经元凋亡。在慢性再生阶段,核心释放的swm-ECM调节胶质瘢痕周围的ECM沉积,促进轴突粘附和髓鞘再生。NGF激活神经元的内在生长能力,并与swm-ECM协同作用以增强轴突再生。
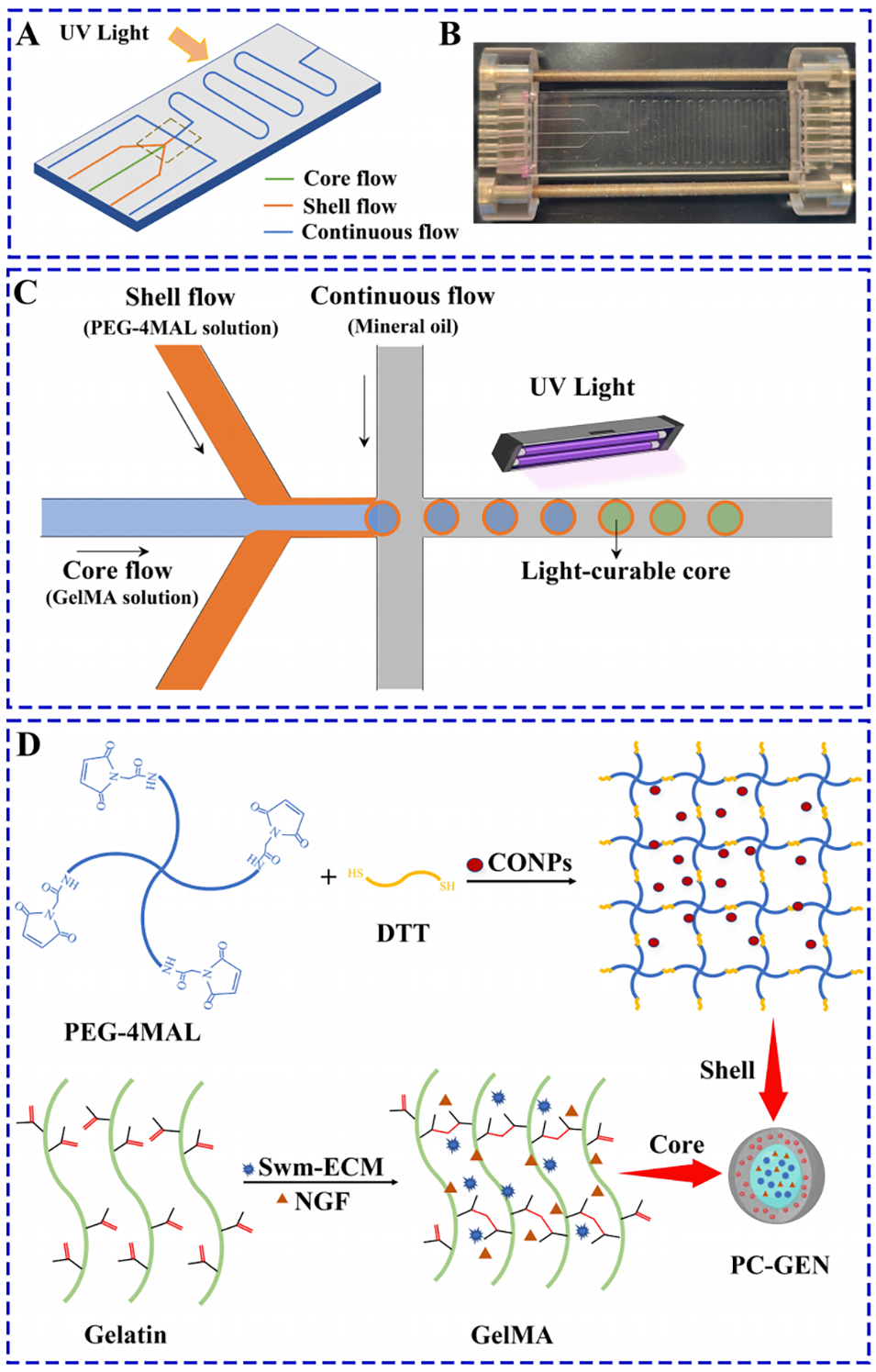
图1:微流控系统中PC-GEN合成和反应过程的示意图。
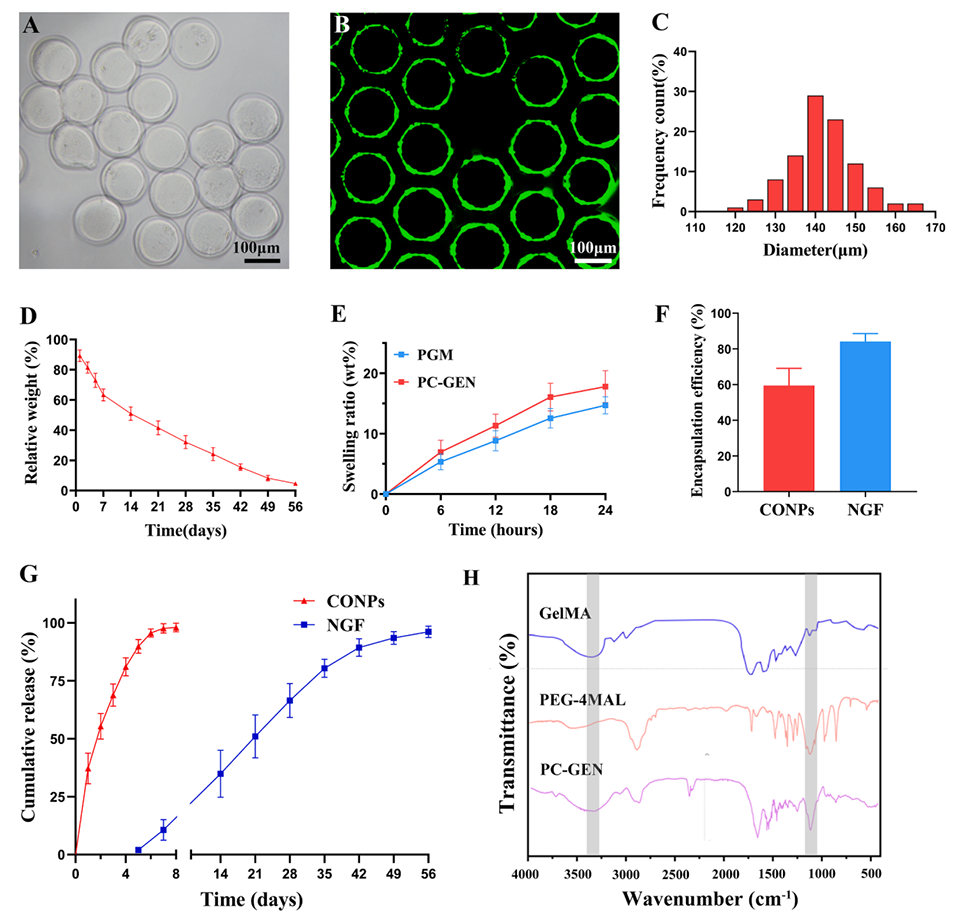
图2:核壳水凝胶微球(PC-GEN)的表征和释放特性。
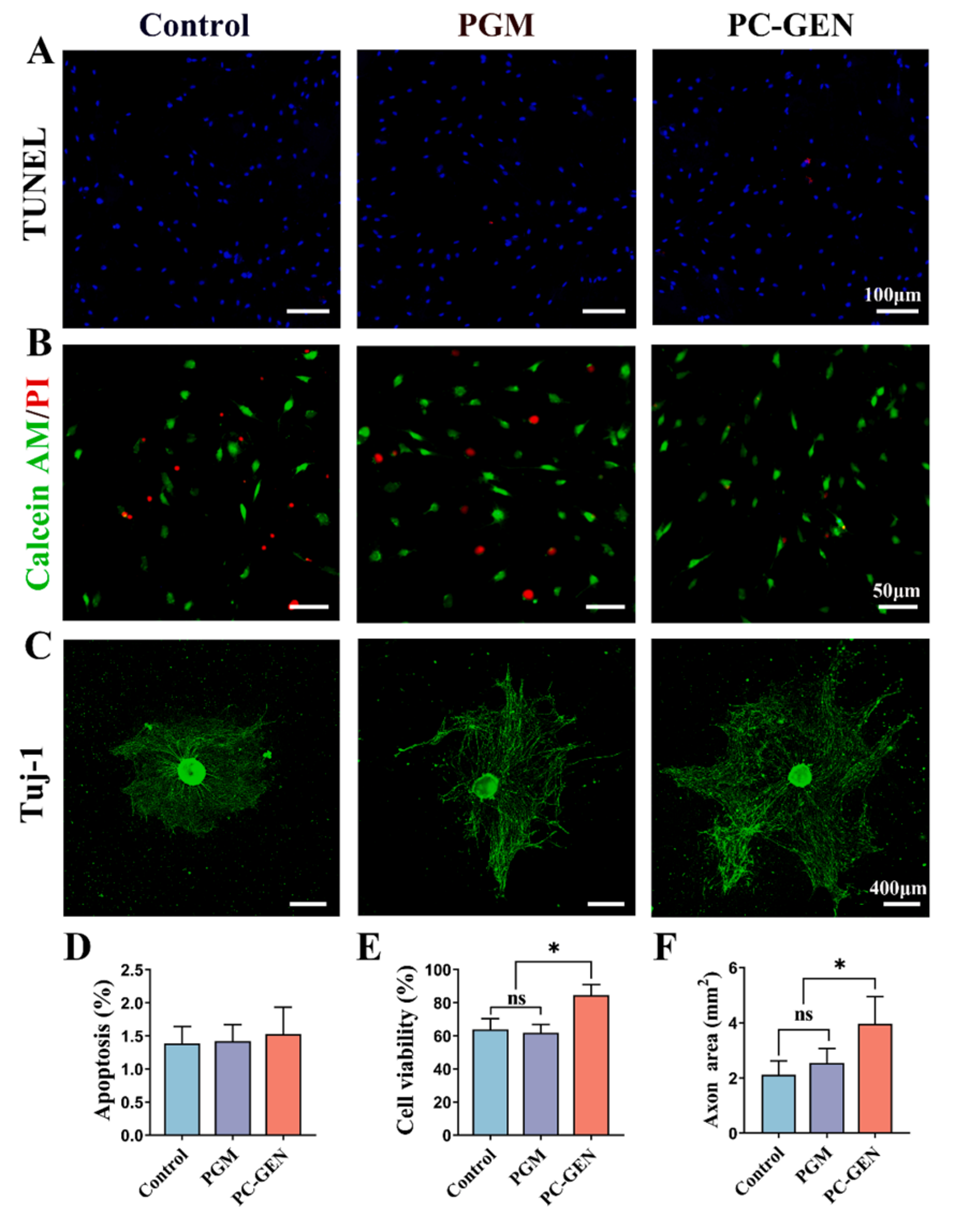
图3:PC-GEN表现出良好的生物相容性,降低了活性氧(ROS)水平,增强了轴突生长。
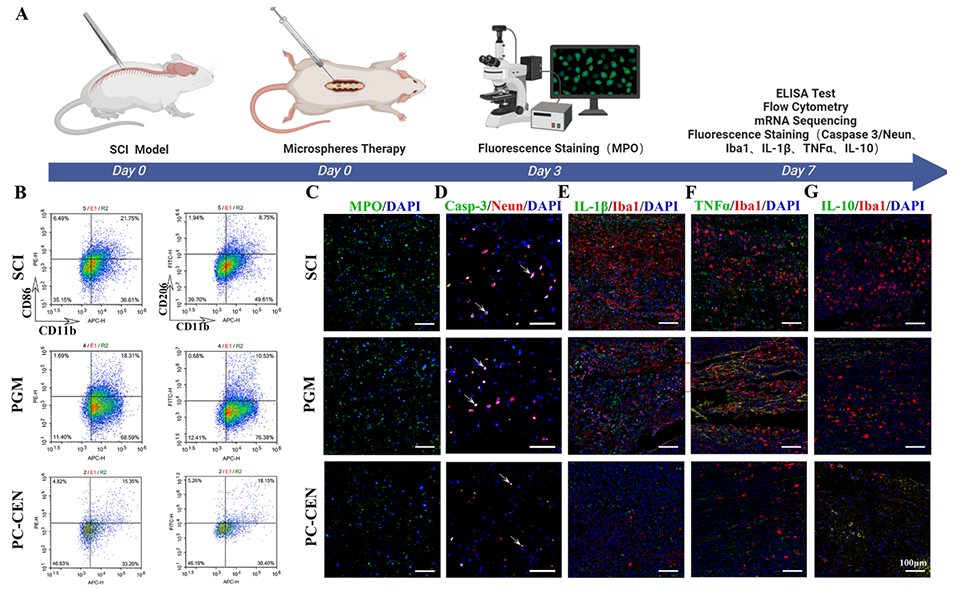
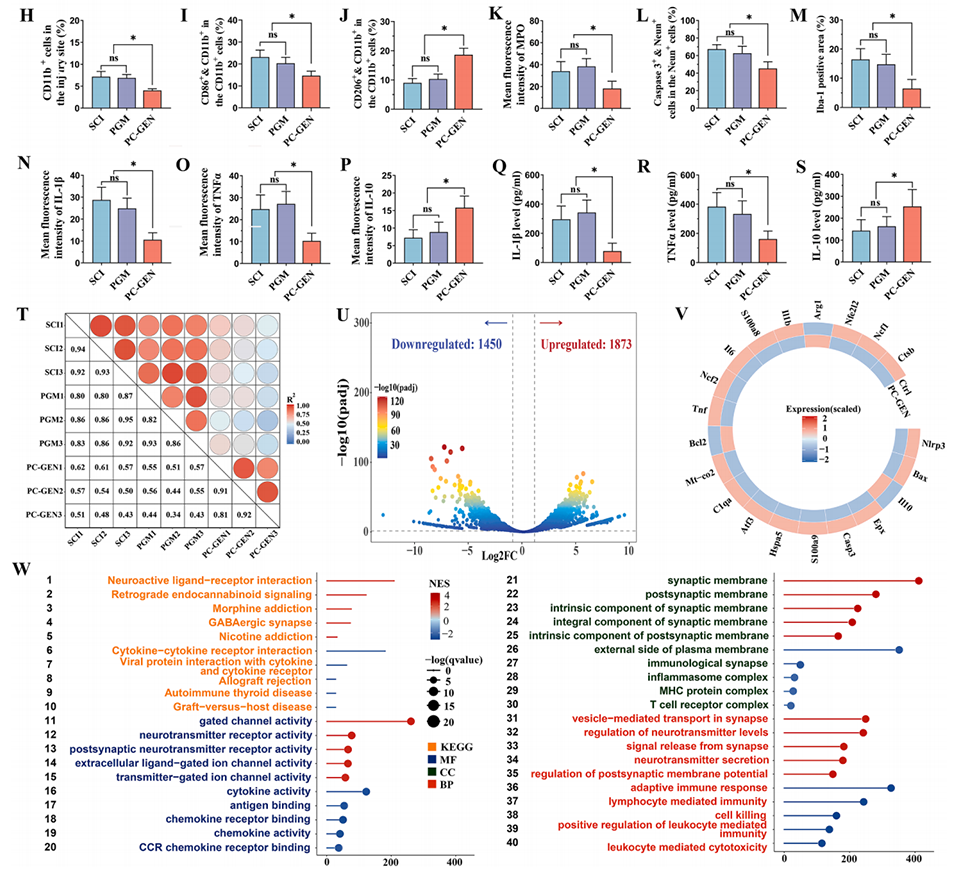
图4:PC-GEN在脊髓损伤后的抗炎和神经保护作用。PC-GEN减少了炎症细胞的浸润,调节了巨噬细胞/小胶质细胞的极化,并降低了炎症水平和凋亡。
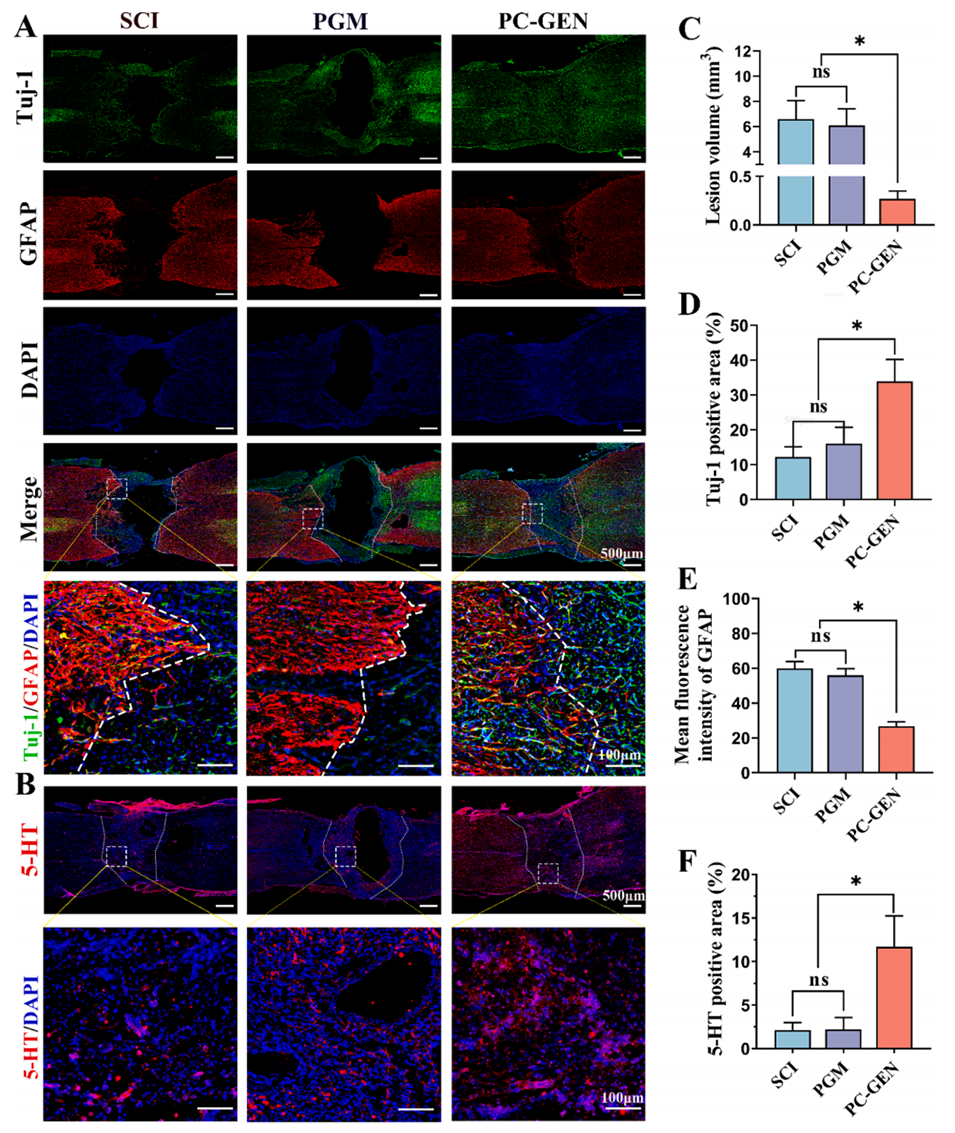
图5:PC-GEN在体内促进了神经轴突的再生,并减少了反应性星形胶质细胞增生的形成。
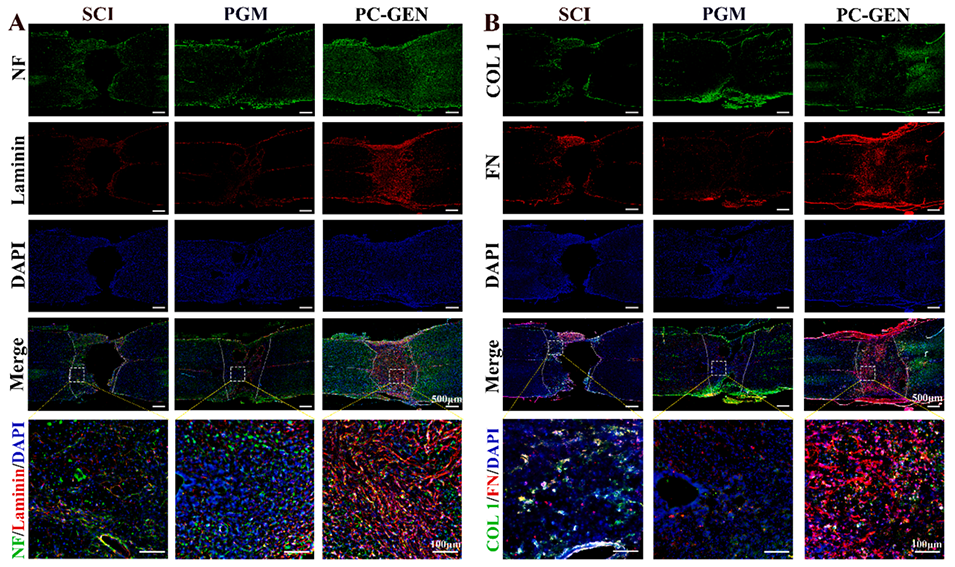
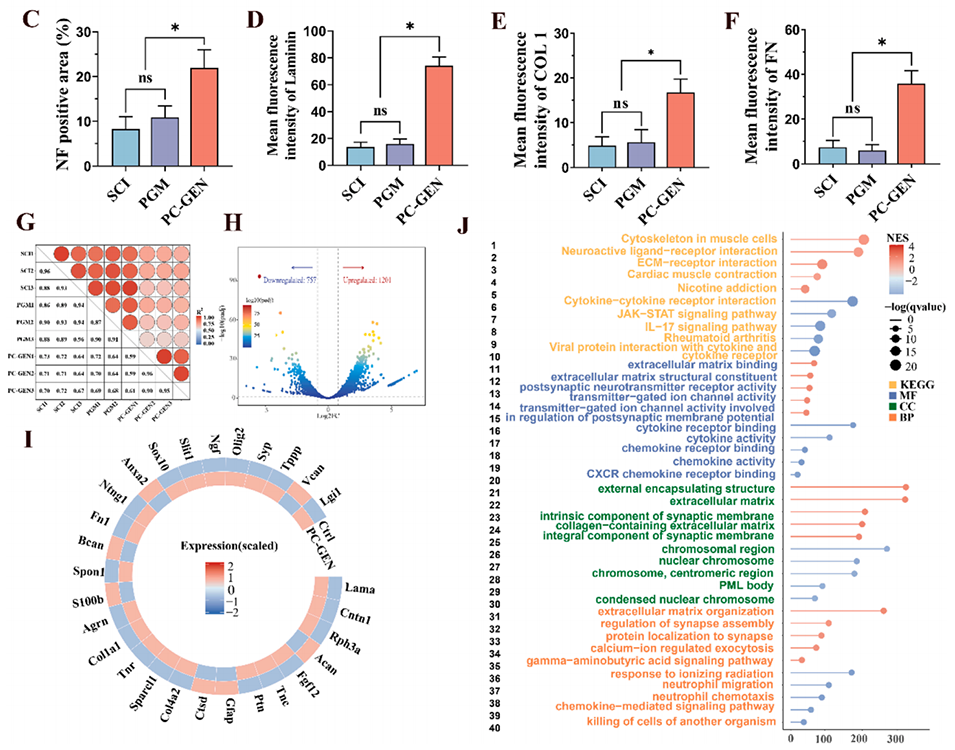
图6:PC-GEN增强了细胞外基质的沉积,并促进了受损区域神经丝的迁移。
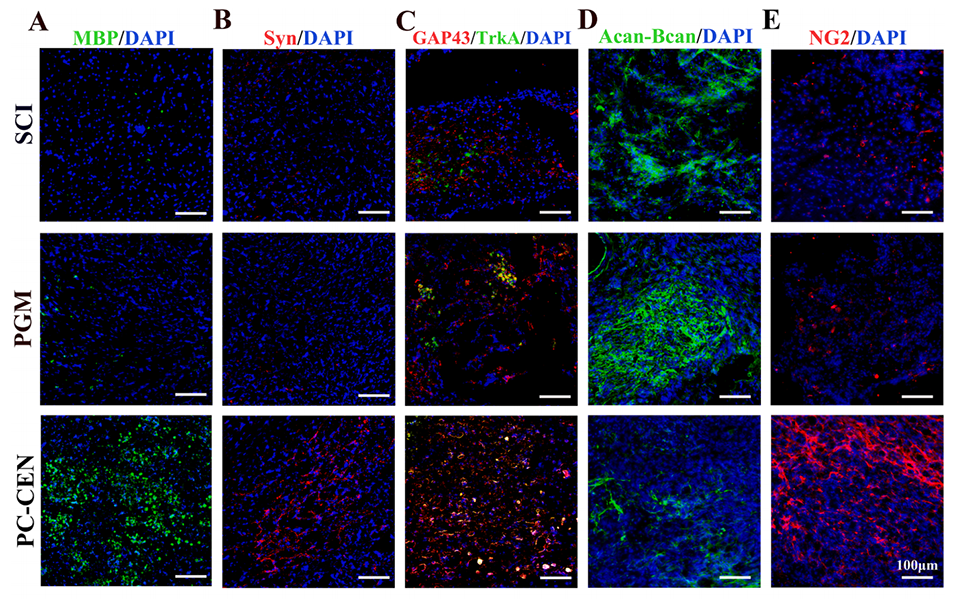
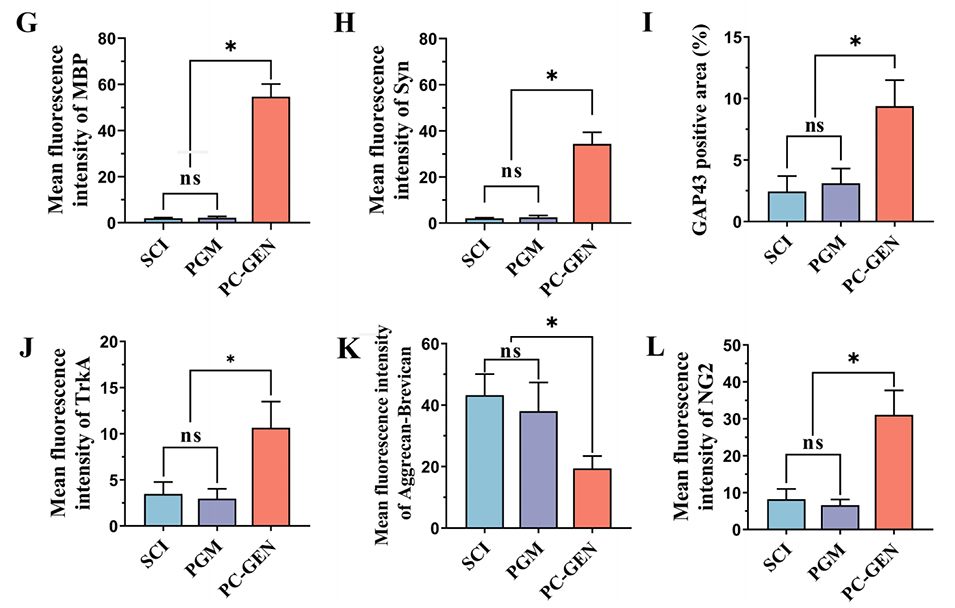
图7:PC-GEN为新生轴突创造了适宜的微环境,并构建了功能性神经网络。
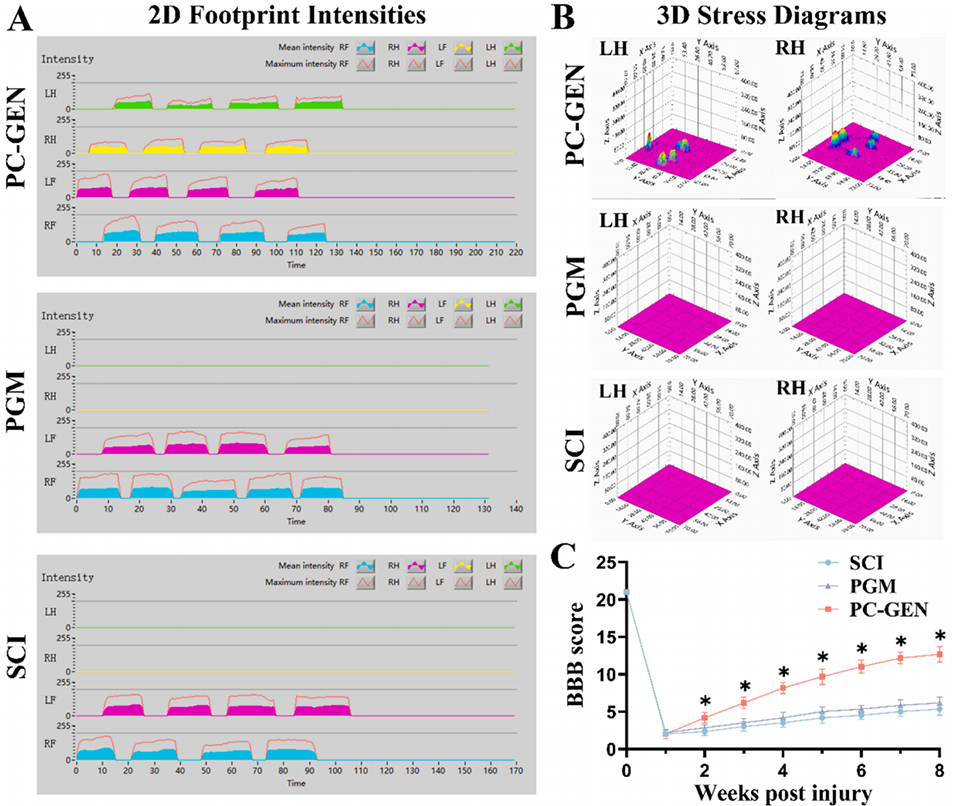
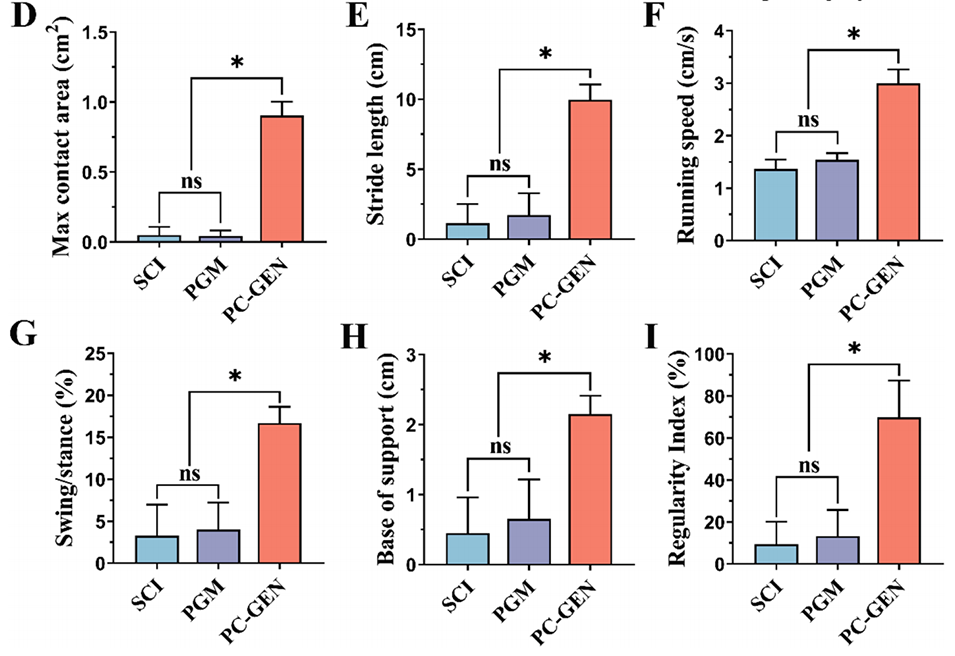
图8:PC-GEN促进了脊髓损伤后运动功能的恢复。
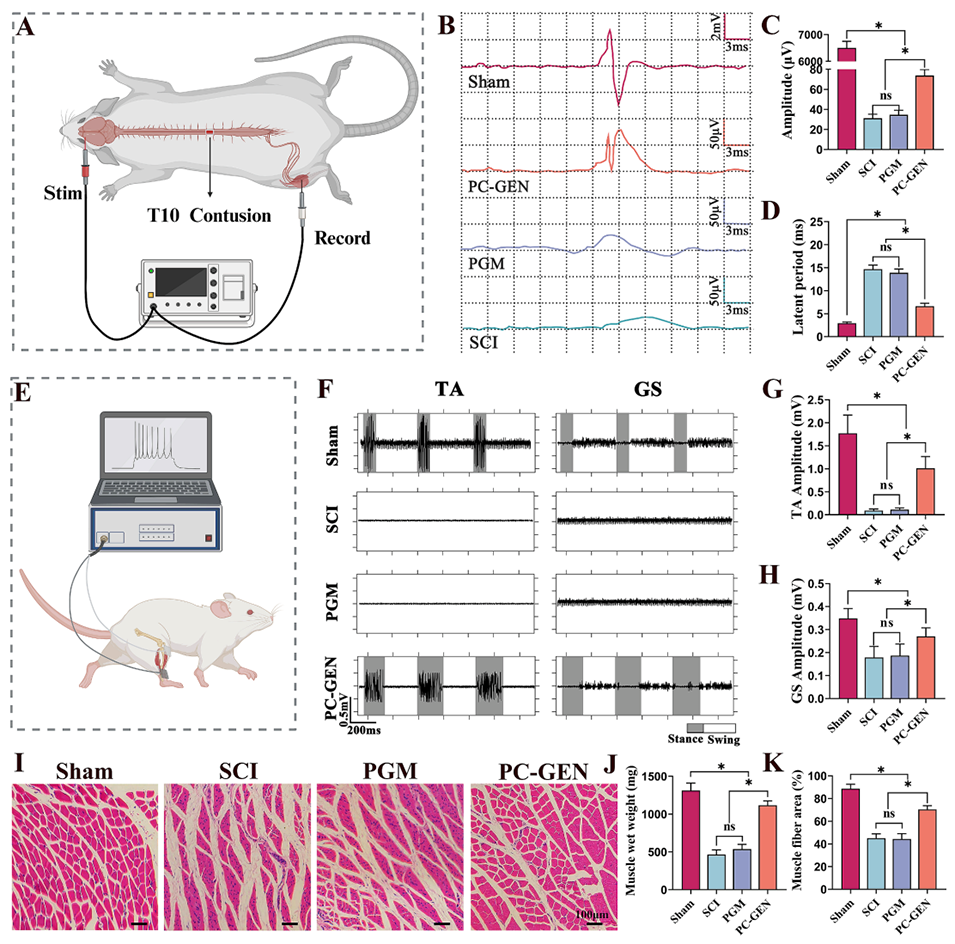
图9:PC-GEN促进了脊髓损伤大鼠的电生理恢复,并减轻了骨骼肌萎缩。
论文链接:https://doi.org/10.1016/j.cej.2025.160861














