
文献导读:
聚合物纳米颗粒(PNPs)因其在药物递送和治疗中的广泛应用而备受关注。近期,有研究人员发表综述,探讨了通过双乳化法和pH驱动法合成聚合物纳米颗粒以封装抗生素和天然产物,用于对抗大肠杆菌(Escherichia coli)感染的最新进展。这些方法不仅提高了药物的稳定性、溶解性和靶向释放能力,还为解决抗生素耐药性问题提供了新的思路。相关研究成果以“Synthesis of polymeric nanoparticles by double emulsion and pH-driven: encapsulation of antibiotics and natural products for combating Escherichia coli infections”为题目,发表在期刊《Applied Microbiology and Biotechnology》上。
本文要点:
1、本文综述了双乳液法(DE)和pH驱动法在合成聚合物纳米粒子(PNPs)中的应用,重点探讨其对抗大肠杆菌感染的潜力。
2、DE法通过水包油包水(W/O/W)结构封装亲水/疏水药物(如万古霉素、庆大霉素),可精准调控粒径、释放特性及封装效率(EE%达62%),显著增强抗菌活性(环丙沙星-PLGA纳米粒子MIC低至0.0188 µg/mL)。
3、pH驱动法通过调节蛋白质构象(如玉米蛋白、酪蛋白)实现疏水化合物(如姜黄素)的高效封装(EE%>90%),无需有机溶剂,且纳米粒子在高温和长期储存中保持稳定。
4、两种方法均能提高药物溶解度、靶向释放及抗菌效果(香芹酚纳米粒子10 mg/mL时抑菌率达85%),为克服抗生素耐药性提供了新策略。
5、未来需优化规模化生产,并探索多功能载体与天然抗菌蛋白的结合,以应对耐药菌挑战。
双乳液法在制备纳米颗粒时,具体是如何调控颗粒尺寸和载药率的?
双乳液法(Double Emulsion, DE)通过多因素的协同作用调控纳米颗粒的尺寸和载药率。在制备过程中,首先形成水相1(W1)和油相(O)的初级乳液,随后将此初级乳液与水相2(W2)混合,形成复杂的水包油包水(W/O/W)双乳液结构。
通过控制乳化过程中的剪切力和搅拌速度,可以调节颗粒的尺寸;增加搅拌速度或使用超声处理能够形成更小的乳液滴,进而得到更小的纳米颗粒。表面活性剂的浓度也起着关键作用,它能降低界面张力,有助于形成更小的颗粒,但过高的浓度可能导致颗粒聚集而增大尺寸。此外,有机溶剂的挥发速度会影响聚合物沉淀形成纳米颗粒的最终尺寸,较快的挥发速度通常得到更小的颗粒。
对于载药率,药物在水相中的浓度和聚合物在油相中的浓度是关键因素,增加药物浓度或优化药物与聚合物的比例可以提高载药率。合适的表面活性剂不仅能提高药物与聚合物之间的相容性,减少药物在制备过程中的泄漏,还能显著提高载药率。稳定的乳液能够防止药物在制备过程中泄漏,从而提高载药率,而优化乳化条件和选择合适的表面活性剂是提高乳液稳定性的关键。
pH驱动法制备纳米颗粒时,酸碱调控的具体作用是什么?
pH驱动法通过调节溶液的酸碱度来制备纳米颗粒,其核心在于利用蛋白质等材料在不同pH值下的溶解性和结构变化。在碱性条件下(通常使用NaOH将pH值调至12左右),蛋白质的氢键和疏水相互作用被破坏,导致蛋白质展开,形成更灵活的结构,这种展开的蛋白质更容易与其他分子相互作用,从而促进纳米颗粒的形成。
随后,通过加入HCl将pH值调至中性或接近中性,蛋白质会重新折叠,恢复其功能结构,这种重折叠过程有助于形成稳定的纳米颗粒,并且可以控制蛋白质的聚集状态,从而影响纳米颗粒的尺寸和稳定性。
此外,某些药物在碱性条件下具有更好的溶解性,通过调节pH值,可以将药物溶解在蛋白质溶液中,然后通过酸碱中和使药物包封在形成的纳米颗粒中,这种方法不仅提高了药物的包封效率,还增强了药物在高温和长期储存中的稳定性。
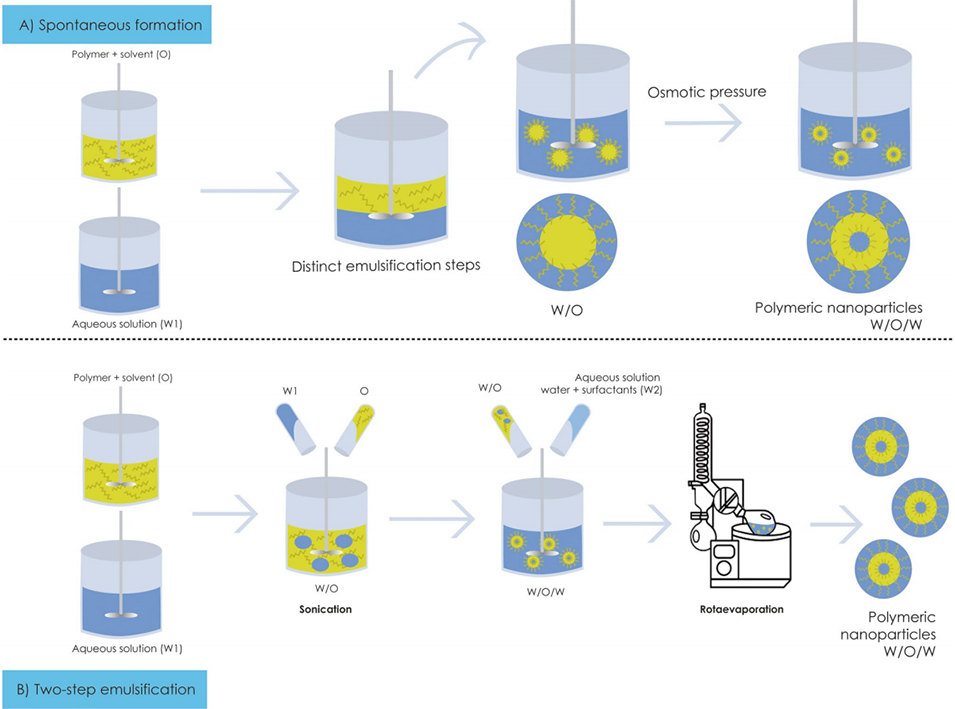
图1通过双乳液技术制备聚合物纳米粒子。O,油相;W1,水相1;W2,水相2;W/O,油包水;W/O/W,水包油包水。
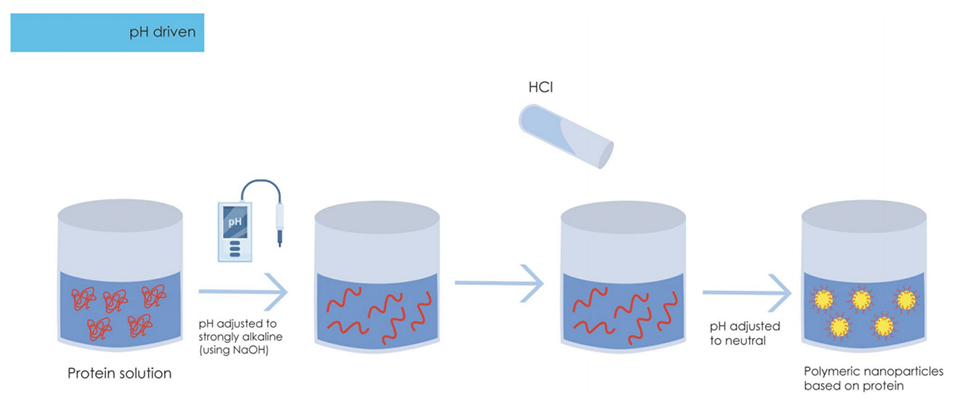
图2通过pH驱动法制备聚合物纳米粒子。NaOH,氢氧化钠;HCl,盐酸。
论文链接:https://doi.org/10.1007/s00253-024-13114-5














