
导读:
近期,有研究人员开发了一种基于合生元碳水化合物聚合物的微胶囊,通过添加不同益生元显著提升了益生菌在冻干、胃肠转运及储存过程中的存活率,为功能性食品和医药领域提供了新的技术方案。相关研究以“Fabrication of synbiotic carbohydrate polymer-based microcapsules: Effect of prebiotics on probiotic viability during freeze-drying, gastrointestinal transit and storage”为题目,发表在期刊《Carbohydrate Polymers》上。
本文要点:
1、本研究通过将益生菌与益生元共同封装于壳聚糖包覆的藻酸盐/结冷胶微胶囊中,探究了不同益生元对益生菌冷冻干燥存活率、胃肠传输稳定性及储存性能的影响。
2、结果表明,添加4 wt%低聚果糖(FOS)的微胶囊效果最优,冻干后益生菌存活率达83.36%,较未添加组提升28%。
3、理化分析显示,含4% FOS的微胶囊粒径为523.53 μm,孔隙尺寸为17.2 μm,水分含量为35.7%,水分活度为0.246,显著增强益生菌保护作用。
4、体外模拟消化实验表明,FOS组益生菌存活量达6.4 log CFU/g,释放符合Korsmeyer-Peppas动力学模型(R²=0.9035)。
5、储存稳定性测试显示,4°C下微胶囊可维持益生菌活菌数>6 log CFU/g达90天,25°C下可维持7天。
6、该研究为开发兼具益生菌保护与肠道靶向释放功能的合生元微胶囊提供了理论支持,在功能性食品与医药领域具有重要应用潜力。
在本研究中,为什么选择壳聚糖作为微胶囊的外壳材料,而不是其他常见的生物材料(如明胶或阿拉伯胶)?壳聚糖在提升益生菌微胶囊性能方面有哪些独特优势?
1、静电相互作用与结构稳定性:
电荷互补性:壳聚糖是一种阳离子多糖(带正电荷),而藻酸盐(alginate)和结冷胶(gellan gum)为阴离子多糖(带负电荷)。两者通过静电相互作用形成稳定的“核-壳”结构,这是其他中性或弱阴离子材料(如明胶、阿拉伯胶)无法实现的。
增强机械强度:壳聚糖涂层显著减少了微胶囊的孔隙率(Micro-CT分析显示孔隙从24.4 μm降至17.2 μm),形成致密屏障,有效抵御冻干过程中的结构塌陷和胃肠液的渗透。
2、生物相容性与安全性:壳聚糖是一种天然的多糖,具有良好的生物相容性和生物可降解性,对人体无毒无害,且在食品和医药领域有广泛的应用,符合益生菌微胶囊作为功能性食品或医药载体的安全性要求。
3、缓释与肠道靶向潜力:壳聚糖在模拟肠道环境(pH 7.0)中可逐渐溶解,延缓益生菌释放(Korsmeyer-Peppas模型显示超Case-II释放机制)。这种pH响应性有望实现肠道靶向释放。
4、潜在抗菌性能:壳聚糖具有一定的抗菌性,可以抑制有害微生物的生长,从而为益生菌创造一个相对稳定和安全的微环境,进一步提高益生菌的存活率和稳定性。
在本研究中,为什么低聚果糖(FOS)在提高益生菌存活率方面表现得比菊粉、低聚半乳糖(GOS)、低聚木糖(XOS)和抗性糊精(RD)更有效?
1、分子结构与物理保护作用
分子量适中:FOS的分子量范围为1200–1500 Da,相较于菊粉(1400–1600 Da)更小,更易与藻酸盐/结冷胶基质均匀结合,形成致密的微胶囊网络。
孔隙填充效应:FOS的小分子特性使其能够有效填充微胶囊内部的孔隙(图1b显示含FOS的溶液粘度较高),减少冻干过程中冰晶对益生菌的机械损伤。
玻璃态基质形成:FOS在冻干过程中通过氢键结合水分子,形成稳定的玻璃态基质,抑制水分子再结晶,保护益生菌细胞膜的完整性。
2、代谢支持与微环境调节
快速供能:FOS作为短链寡糖,易被益生菌(如乳杆菌属)代谢利用,生成短链脂肪酸(如丁酸、乙酸),为益生菌提供能量并维持其代谢活性。
降低氧化应激:FOS的代谢产物可能通过清除自由基或调节微环境pH值,减少氧化应激对益生菌的损伤(需进一步验证)。
3、与其他材料的协同效应
电荷与相容性:FOS的分子结构(含羟基和糖苷键)与藻酸盐、结冷胶及壳聚糖的化学基团(如羧基、氨基)形成氢键或静电相互作用(FTIR分析显示O–H和C–O峰增强),增强微胶囊的机械强度和稳定性。
水分活度控制:FOS的添加显著降低了微胶囊的水分活度(aw=0.246),抑制储存过程中微生物污染和益生菌代谢损耗。
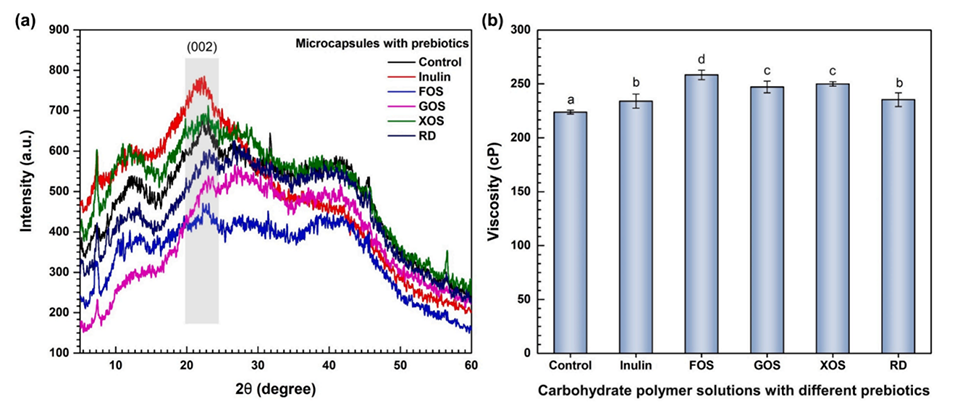
图1.(a)微胶囊的XRD图和(b)用于配制微胶囊的不同益生元添加剂的碳水化合物聚合物溶液的粘度。不同字母表示存在显著差异(p<0.05)。对照是指不添加益生元的微胶囊。FOS、GOS、XOS和RD分别代表低聚果糖、低聚半乳糖、低聚木糖和抗性糊精。
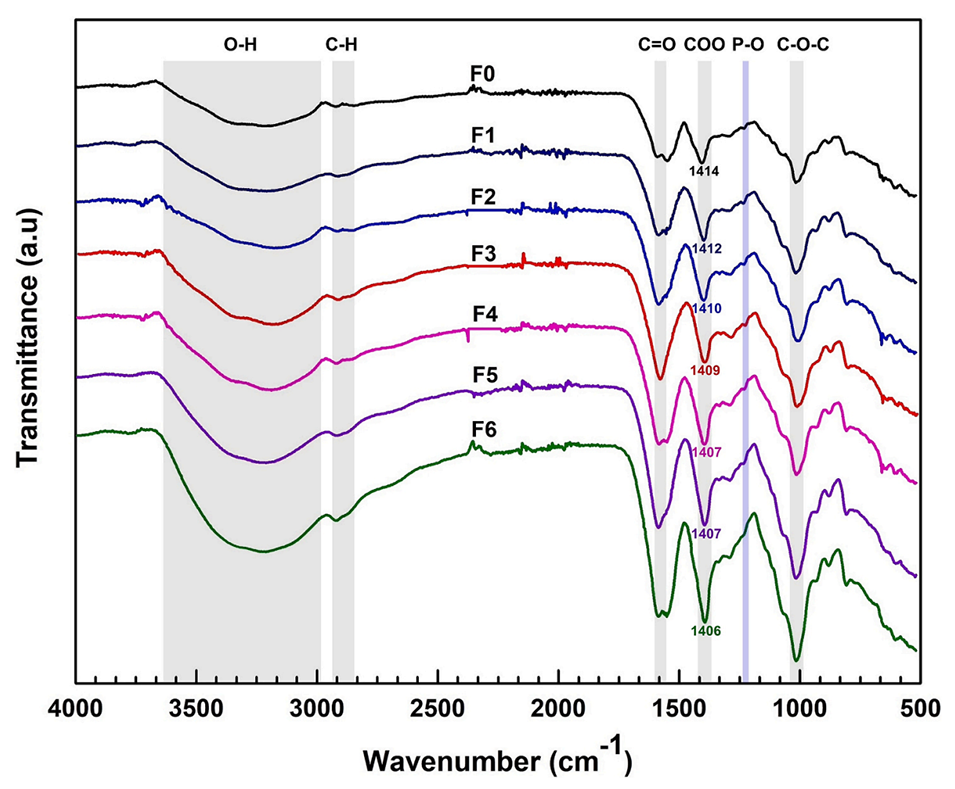
图2.封装益生菌的微胶囊的傅里叶变换红外光谱。F0–F6代表FOS浓度在0至6wt%范围内的微胶囊。
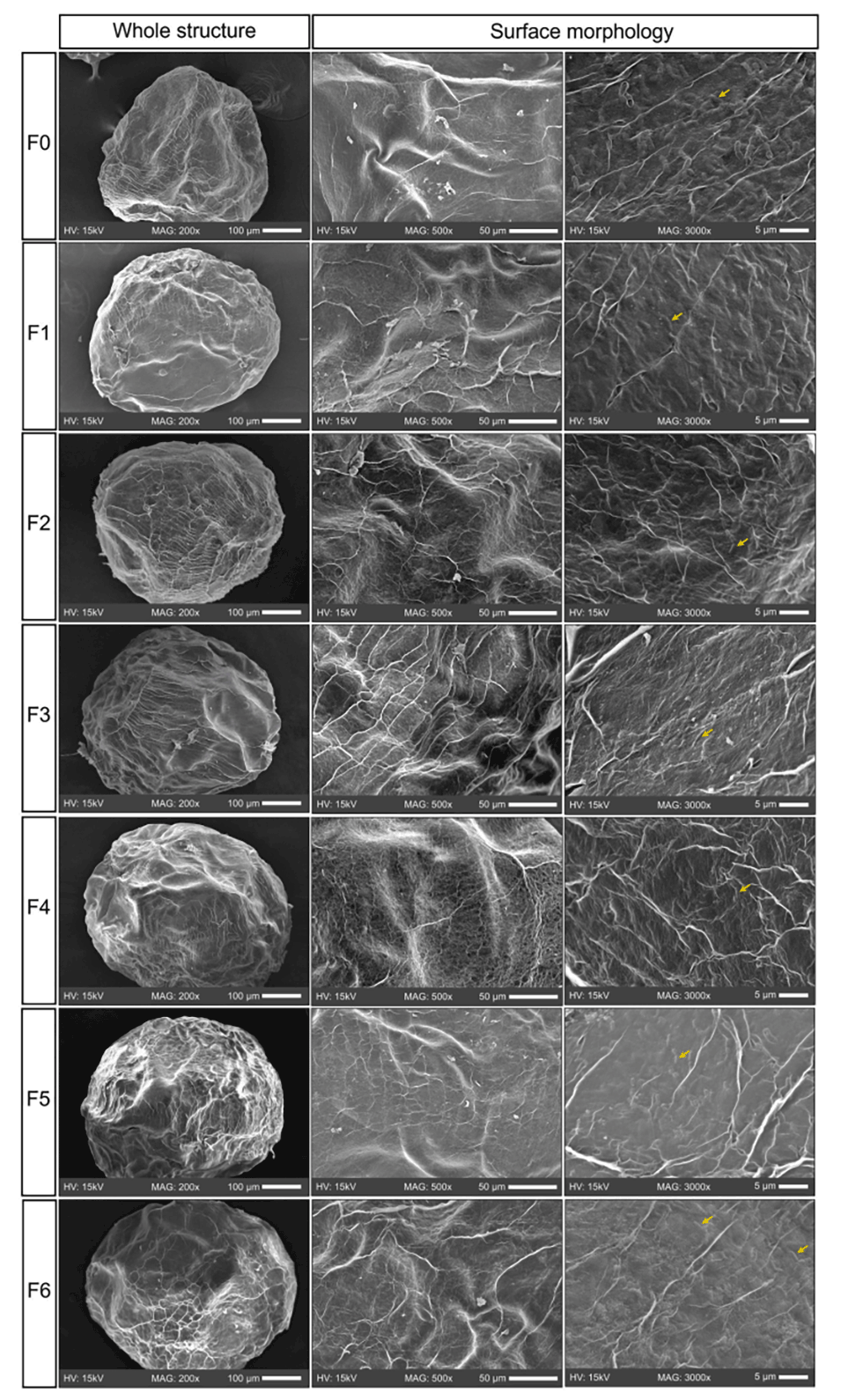
图3.微胶囊整体结构(200×)和表面形态(500×和3000×)的SEM显微照片。F0–F6代表FOS浓度在0至6wt%范围内的微胶囊。
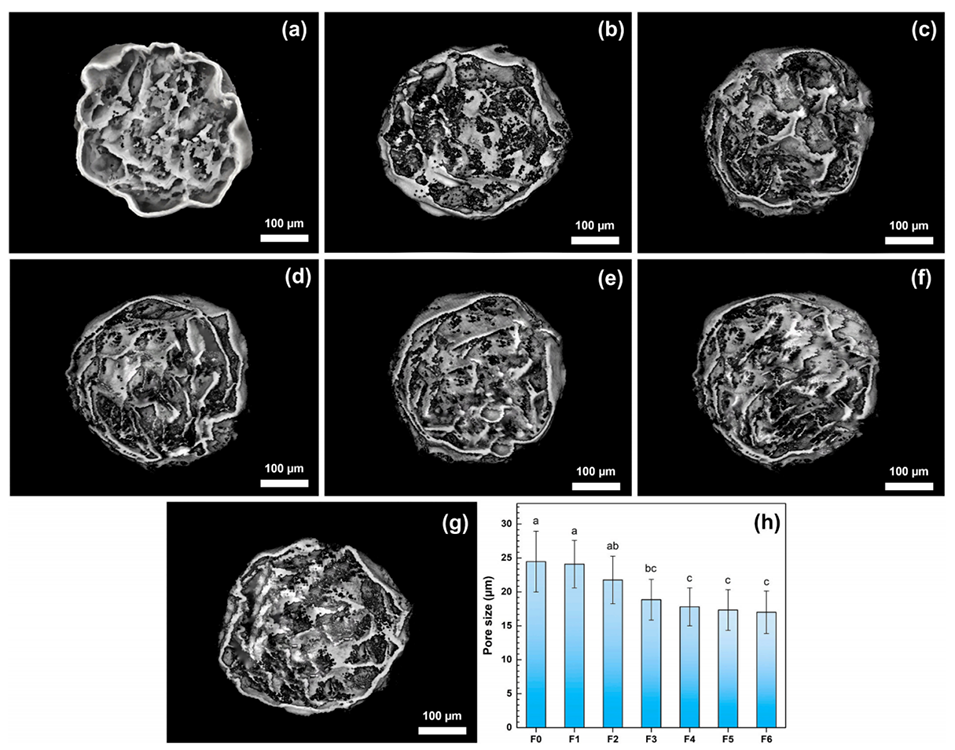
图4.微CT图像显示微胶囊的横截面视图;(a)F0、(b)F1、(c)F2、(d)F3、(e)F4、(f)F5和(g)F6微胶囊,以及(h)微胶囊的孔径大小。不同字母表示存在显著差异(p<0.05)。F0–F6代表FOS浓度在0至6wt%范围内的微胶囊。
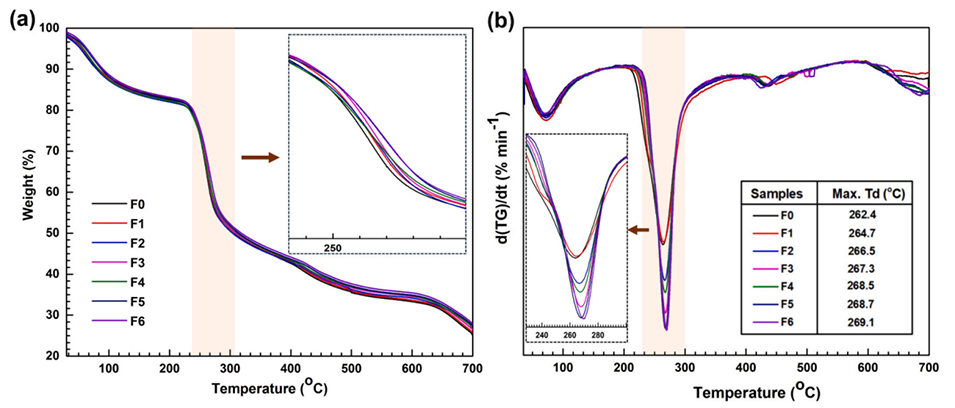
图5.(a)微胶囊的TGA和(b)DTG热谱图。F0–F6代表FOS浓度在0至6wt%范围内的微胶囊。
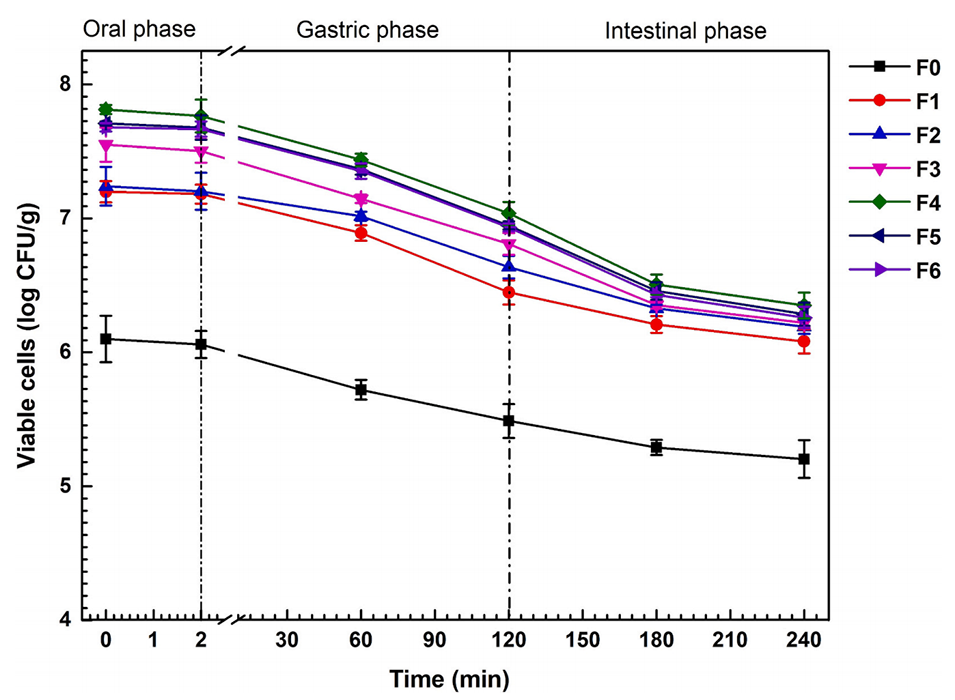
图6.体外消化条件下益生菌的存活率。数据以平均值±标准差表示(n=3)。F0–F6表示FOS浓度在0至6wt%范围内的微胶囊。
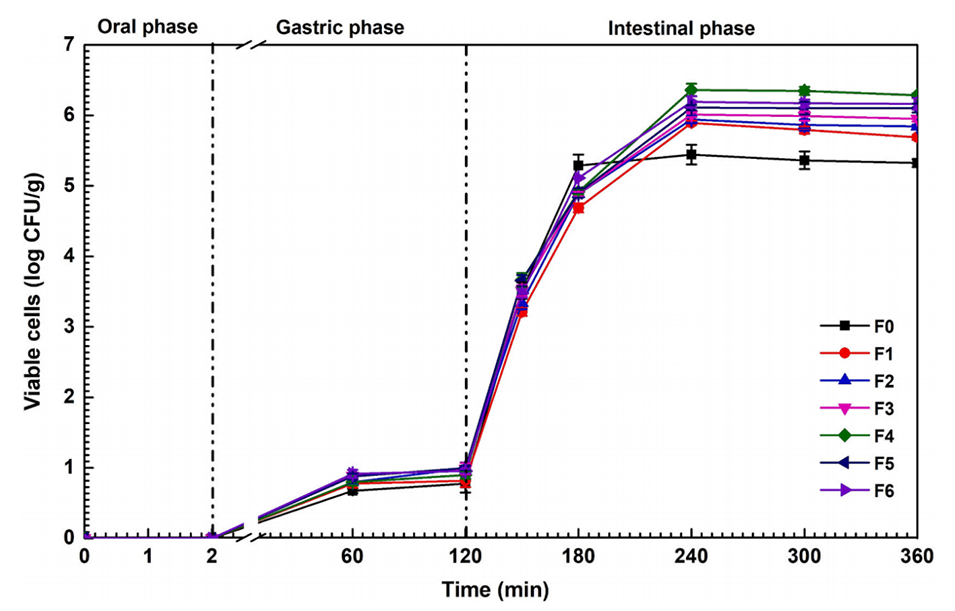
图7.益生菌从微胶囊中的释放情况。数据以平均值±标准差表示(n=3)。F0–F6表示FOS浓度在0至6wt%范围内的微胶囊。
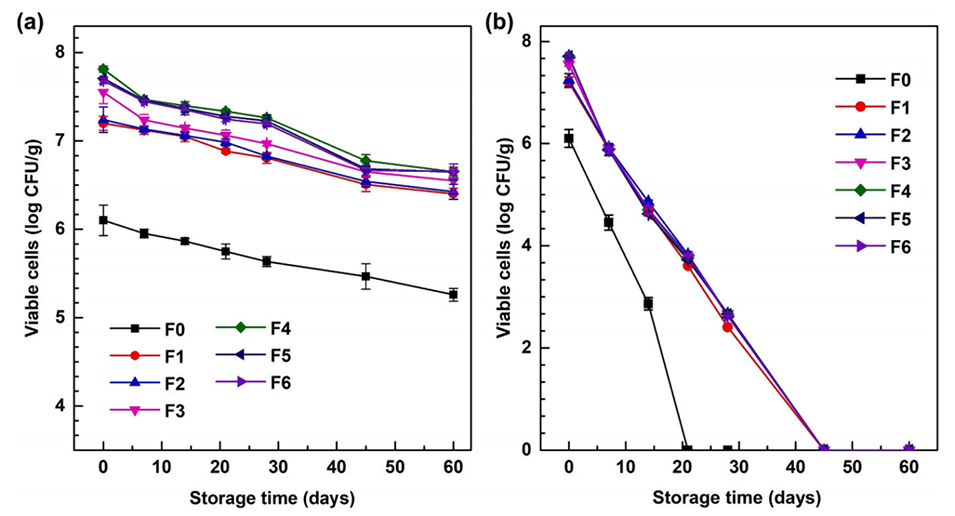
图8.微胶囊在4℃(a)和25℃(b)下储存60天的稳定性。数据以平均值±标准差表示(n=3)。F0–F6表示FOS浓度在0至6wt%范围内的微胶囊。
论文链接:https://doi.org/10.1016/j.carbpol.2025.123582














