
导读:
近期,河北科技大学胡连栋教授团队开发了一种创新的离心微流控技术,用于制备载利培酮的聚乳酸-羟基乙酸共聚物(PLGA)微球。该技术通过优化关键参数,如PLGA浓度、微通道内径和离心速度等,实现了对微球粒径、形态和药物释放特性的精确调控,并在动物实验中展现出良好的长效缓释效果。相关研究以“Innovative centrifugal microfluidic approach for risperidone-loaded PLGA microsphere production”为题目发表于期刊《International Journal of Pharmaceutics》。
本文要点:
1、本研究提出了一种新型的离心微流控技术用于制备载利培酮的聚乳酸-羟基乙酸共聚物(PLGA)微球(RIS-MS)。
2、系统评估了PLGA浓度、类型、微通道内径和离心速度等关键参数对微球粒径、形态及药物释放的影响,并进行了优化。
3、结果表明,在PLGA含量≥15%、微通道内径170-210 μm、离心速度400 rpm的条件下,可成功制备粒径均匀的RIS-MS。
4、体外释放实验显示,微球的药物释放符合一级动力学模型,最长可持续60天。
5、体内药代动力学研究(以兔子为模型)表明,RIS-MS组的血药浓度更稳定,Cmax显著低于混悬液组,并且药物释放可持续长达42天。
6、该离心微流控技术为微球的高效制备提供了新思路,优化后的RIS-MS具有优异的缓释性能,有望用于精神分裂症的长效治疗。
离心微流控技术制备微球的优势主要体现在以下几个方面:
1、设备简化与成本降低:无需依赖复杂的外部泵系统,仅通过离心力驱动流体,设备结构简单且易于操作,显著降低了硬件成本和维护难度。
2、参数精确可控:通过调节离心转速、微通道内径及聚合物浓度等参数,可精准调控微球粒径(如优化后粒径CV值低至3.1%),实现高度均一性和单分散性。
3、高效生产潜力:支持并行化处理,通过多通道设计可提升微球产量,具备规模化生产的可行性。
4、工艺环境友好:采用PVA循环系统减少试剂消耗与废水污染,符合绿色生产需求。
5、性能优化:与传统方法(如乳化法)相比,所制微球粒径分布更窄、药物包封率更高,且体外释放行为稳定(符合一级动力学模型),满足长效缓释需求。
6、应用灵活性:适用于多种生物相容性材料(如不同型号PLGA),在药物递送、诊断等领域展现广泛适用性。
这些优势使其在药物微球开发中兼具高效性、可控性和产业化潜力。
如何通过技术改进缩小RIS-MS在体内外释放行为的差异,提升临床预测性?
1、仿生释放环境模拟:
开发动态体外释放系统(如灌注式反应器),模拟体内肌肉组织的酶解环境、机械应力(如周期性压缩)及pH变化,更真实反映微球降解与药物释放动力学。
2、微球结构精准调控:
利用多级离心微流控芯片,实现核壳结构或梯度孔隙设计。例如,外层致密PLGA延缓初期突释,内部多孔结构加速后期降解,匹配体内需求。
结合原位交联技术(如紫外光固化),在微球表面形成交联网络,增强抗酶解能力,延缓体内降解速率。
3、数据驱动模型辅助优化:
建立基于机器学习(如神经网络)的体内外释放关联模型,通过体外释放数据预测体内药代动力学参数,反向指导工艺参数调整(如PLGA分子量选择、孔隙率控制)。
引入微球结构表征(如微CT成像)与释放数据融合分析,明确关键结构参数(孔径分布、壳层厚度)对体内外差异的影响机制。
通过上述技术改进,可系统性缩小体内外释放差异,提升微球制剂的临床转化效率。
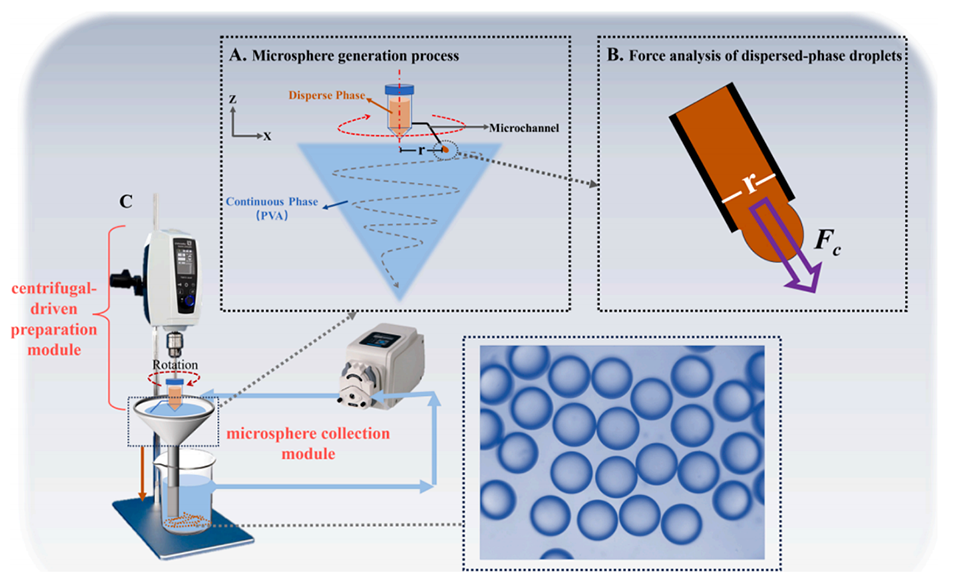
图1.离心微流控平台示意图。

图2.通过离心微流控技术制备的利培酮载药PLGA微球(RIS-MS)的显微镜和扫描电子显微镜(SEM)图像。
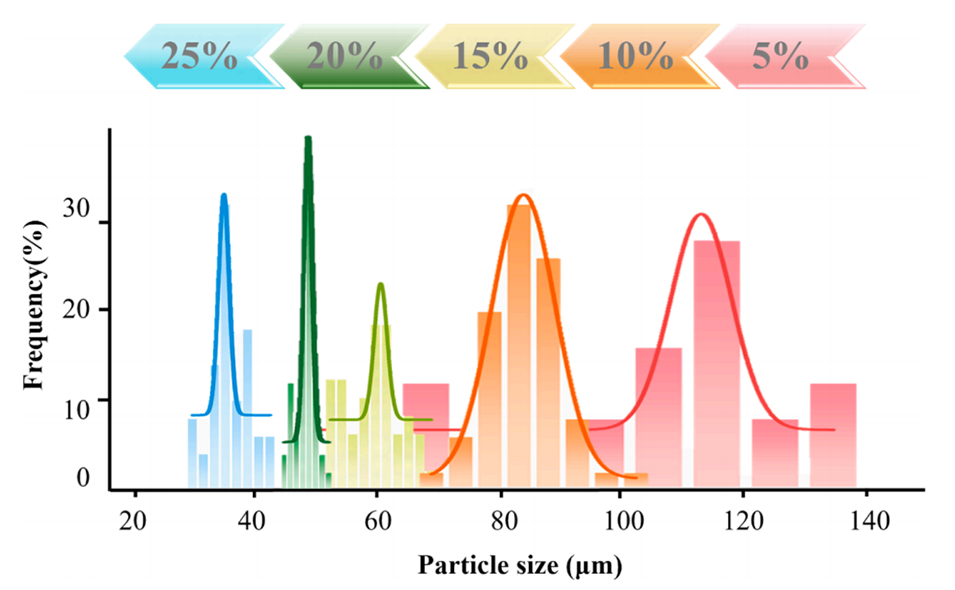
图3.不同PLGA浓度制备的RIS-MS的粒径分布。
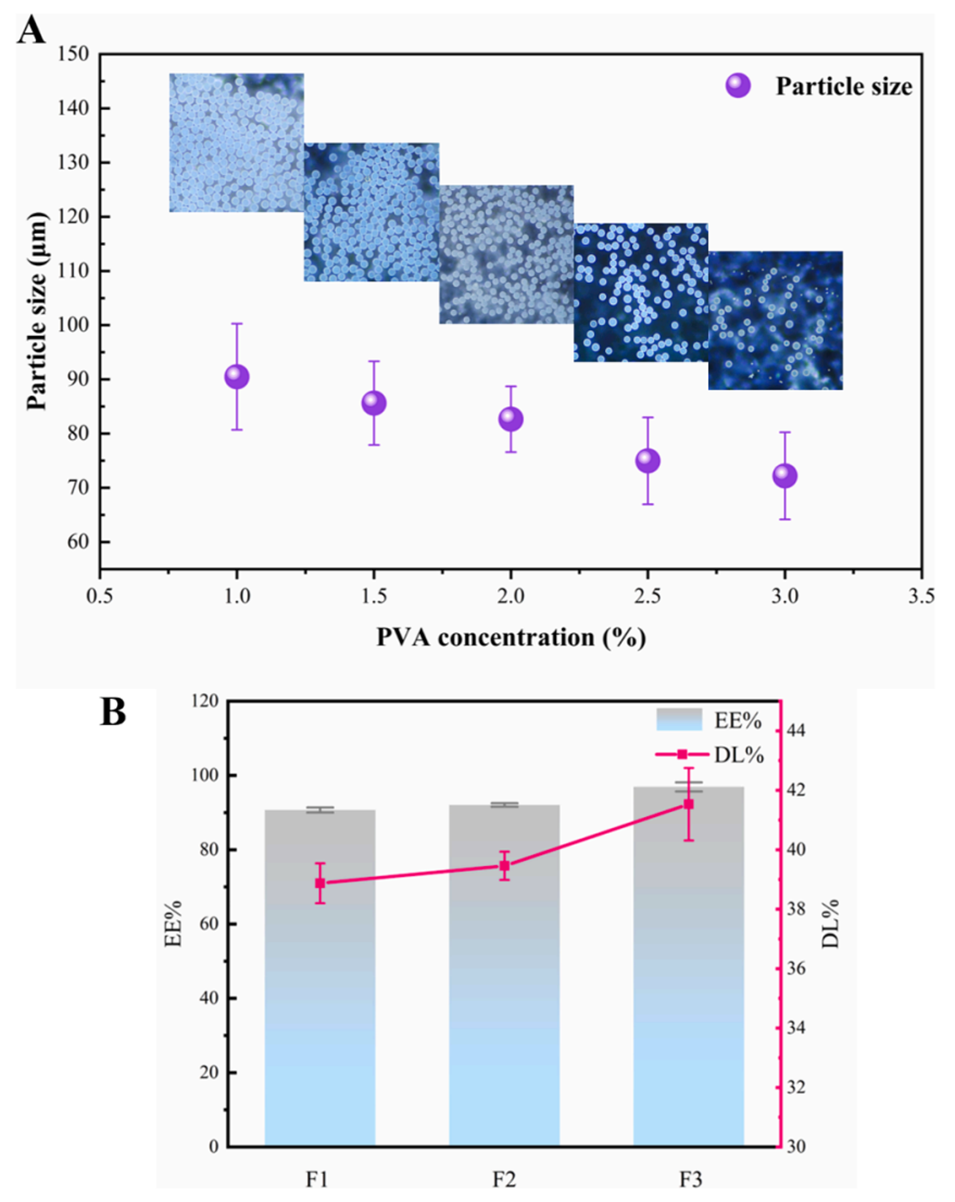
图4.(A)不同PVA浓度制备的RIS-MS(n=3);(B)不同PLGA类型制备的RIS-MS的包封率(EE%)和载药量(DL%,n=3)。
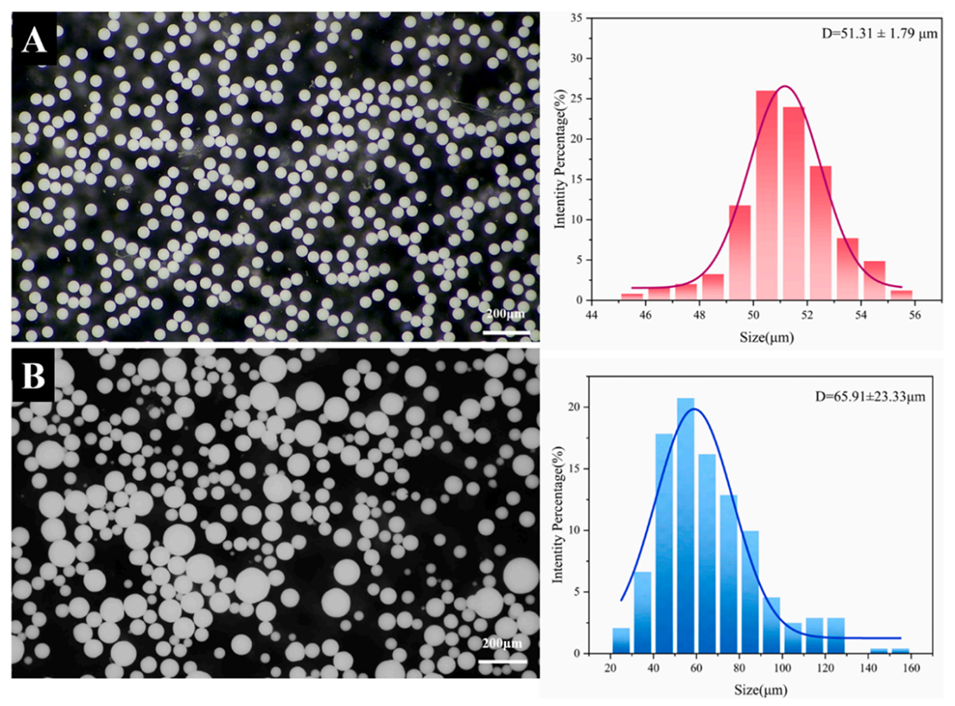
图5.不同方法制备的RIS-MS的粒径分布,(A)离心微流控法,(B)乳化溶剂挥发法。
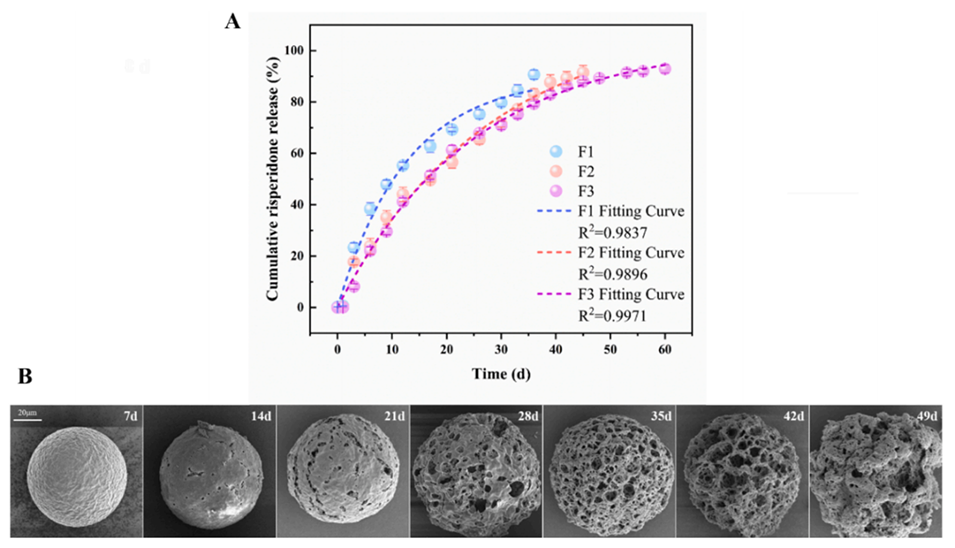
图6.RIS-MS的体外释放和降解。
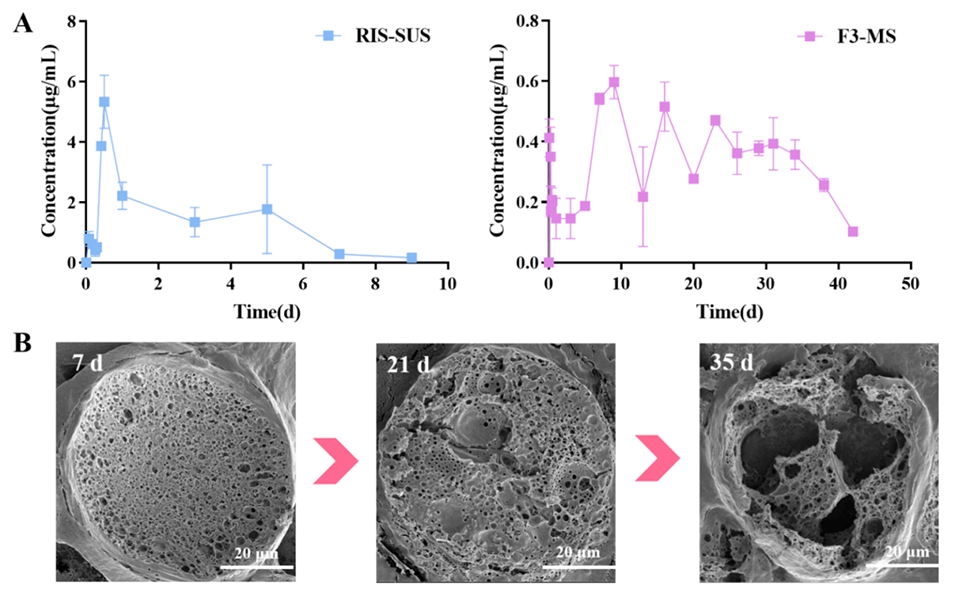
图7.RIS-MS组和混悬液组的利培酮平均血浆浓度(A)以及RIS-MS的体内降解(B)。
论文链接:https://doi.org/10.1016/j.ijpharm.2025.125484














