
近期,有研究人员开发了一种基于微流控双乳液模板和紫外光交联的技术,成功制备了具有可调壳层厚度和尺寸的聚乙二醇微凝胶胶囊。相关研究以“Microfluidic fabrication of polyethylene glycol microgel capsules with tailored properties for the delivery of biomolecules”为题目,发表在期刊《Biomaterials Science》上。该研究进一步验证了所得胶囊对10 kDa大分子的高效封装能力,并通过多孔壳层的水解作用实现了荧光标记物的缓释,为药物递送系统提供了可降解、高载量的软壳载体平台。
本文要点:
1、本研究开发了一种基于微流控技术的聚乙二醇(PEG)微凝胶胶囊制备方法,用于高效封装与控释生物分子。
2、通过双乳液模板法,在微流控装置内生成单分散的水包油包水(W/O/W)乳液液滴,并利用紫外光引发交联反应,将六臂丙烯酸化星形聚环氧乙烷-聚环氧丙烷(sPEG-A)预聚物固化形成微凝胶壳层。
3、通过调节微流控流速,可精确控制胶囊的壳层厚度(9.9–18.9 μm)与整体尺寸(178.6–210.0 μm)。
4、实验表明,所得微凝胶胶囊具有中空结构,可原位封装10 kDa FITC-葡聚糖等大分子,并通过壳层的水解作用实现分子缓释。
5、冷冻扫描电镜(cryo-SEM)显示壳层为多孔结构,溶胀实验验证了其亲水性PEG网络的快速吸水特性。
6、此外,胶囊在离心与超声处理下仍保持结构稳定,且降解产物无细胞毒性。
7、该方法为药物递送系统提供了高载量、可控释放的软壳载体平台,适用于生物医学、化妆品等领域的功能分子精准递送。
微流控技术在制备聚乙二醇微凝胶胶囊中的核心优势是什么?其在实际规模化生产中可能面临哪些挑战?
优势:
单分散性控制:通过调节流速参数(如外相、中相、内相流速),可精确控制胶囊壳层厚度(9.9–18.9 μm)与整体尺寸(178.6–210.0 μm),避免传统乳化法导致的尺寸不均问题。
原位封装:双乳液模板法支持在液滴形成过程中直接封装大分子(如10 kDa FITC-葡聚糖),无需后加载,提升载药效率。
快速固化:紫外光交联反应在数秒内完成,缩短生产周期,减少药物暴露于不利环境的时间。
挑战:
材料兼容性:预聚物溶液的粘度需与微流控设备匹配,高粘度可能导致液滴生成不稳定(如实验中需模拟非反应性sPEG-OH的粘度以确保工艺稳定)。
规模化限制:当前依赖玻璃毛细管装置,生产通量较低(流速为毫升/小时级别),需优化设备设计或采用并行微流控系统以提高产量。
如何调整聚乙二醇微凝胶壳层特性(如交联密度、降解速率)以实现药物的精准控释?
1、调控策略:
交联密度:通过改变预聚物浓度(如文中20% w/w sPEG-A)或光引发剂比例,调节壳层孔隙率,控制小分子扩散速率。例如,降低交联密度可增大网络孔径,加速释放。
降解速率:利用水解敏感的交联剂(如酯键)或引入酶响应基团,使壳层在特定生理条件下(如pH、酶环境)逐步降解,实现按需释放。本研究中胶囊通过酯键水解实现缓释,未来可结合靶向修饰提升特异性。
动态响应:引入温敏或光响应材料(如PNIPAM),通过外部刺激(温度、光照)实时调控壳层溶胀或收缩,实现脉冲式释药。文中未涉及此方向,但可作为扩展研究方向。
2、验证手段:
荧光示踪:通过监测FITC-葡聚糖的荧光信号分布,量化壳层渗透性与释放动力学。
溶胀与降解实验:结合溶胀度测试与SEM观察,分析壳层结构变化对释放行为的影响。

图1.A:sPEG-A的化学交联过程示意图。B:实验装置示意图:两根圆形毛细管放置在一个方形毛细管内。注入相应的液体,在毛细管对齐处形成双乳液。双乳液形成后,用紫外光照射双乳液液滴,持续5-15秒,以聚合sPEG-A并产生微凝胶胶囊。微凝胶胶囊中心出现的白点是由于与底部玻璃片接触所致。比例尺为100 µm。
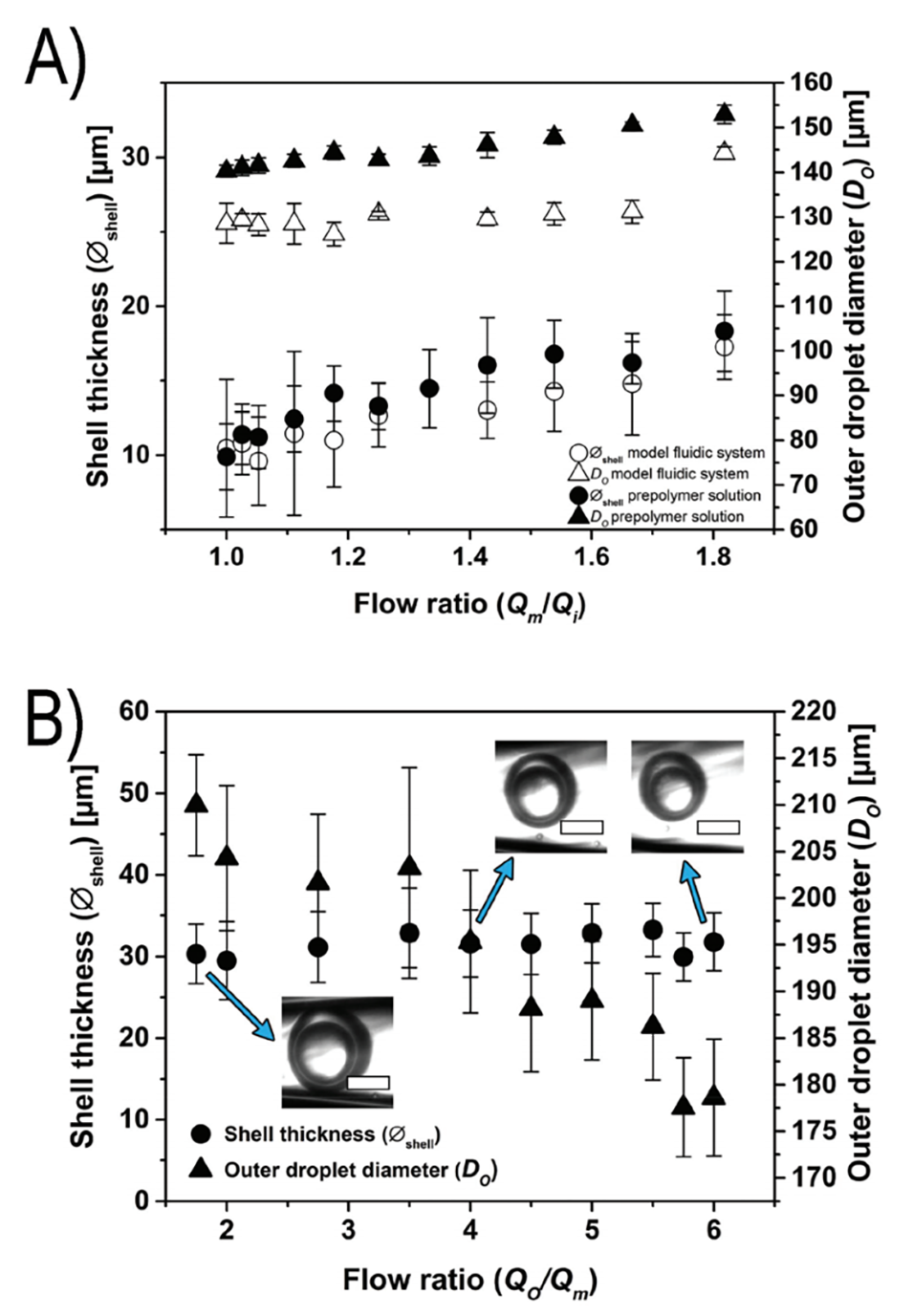
图2.A:通过改变内相流速(Qi)来调节壳厚度:在保持外相(Qo)和中相(Qm)流速分别为10 mL/h和2 mL/h的情况下,改变内相流速可以精确控制壳厚度,同时保持外径相对恒定。B:通过改变外相流速(Qo)来调节滴液尺寸:在保持中间相(Qm)和内相(Qi)流速分别为4 mL/h和1.5 mL/h的情况下,改变外相流速可以精确控制滴液的外径,同时保持壳厚度恒定。比例尺为100 µm。
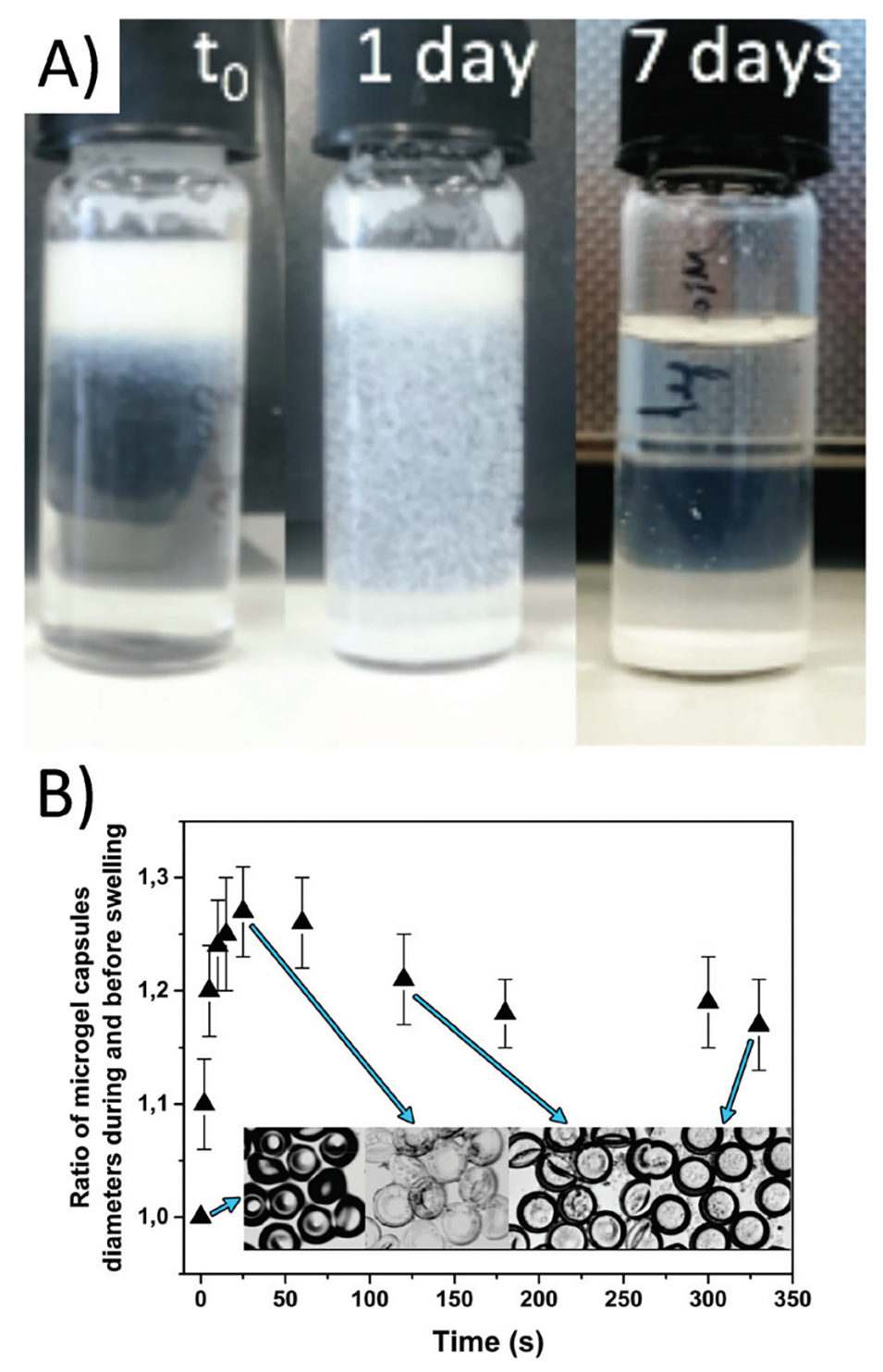
图3.A:sPEG微凝胶胶囊的溶胀行为:微凝胶胶囊中的甲苯被水置换的过程。甲苯蒸发后,微凝胶胶囊在9天内逐渐沉降。B:微凝胶胶囊在水中的溶胀实验。记录了微凝胶胶囊直径随时间的变化。干燥的扁平颗粒迅速溶胀。

图4.冷冻扫描电子显微镜(cryo-SEM)图像显示微凝胶胶囊的结构:样品经过纯化并储存在Milli-Q水中。A:在-80°C下,10分钟升华时间,700×放大。B:在-80°C下,10分钟升华时间,5000×放大。C:在-80°C下,25分钟升华时间,400×放大。D:在-80°C下,25分钟升华时间,3000×放大。比例尺为10 µm。
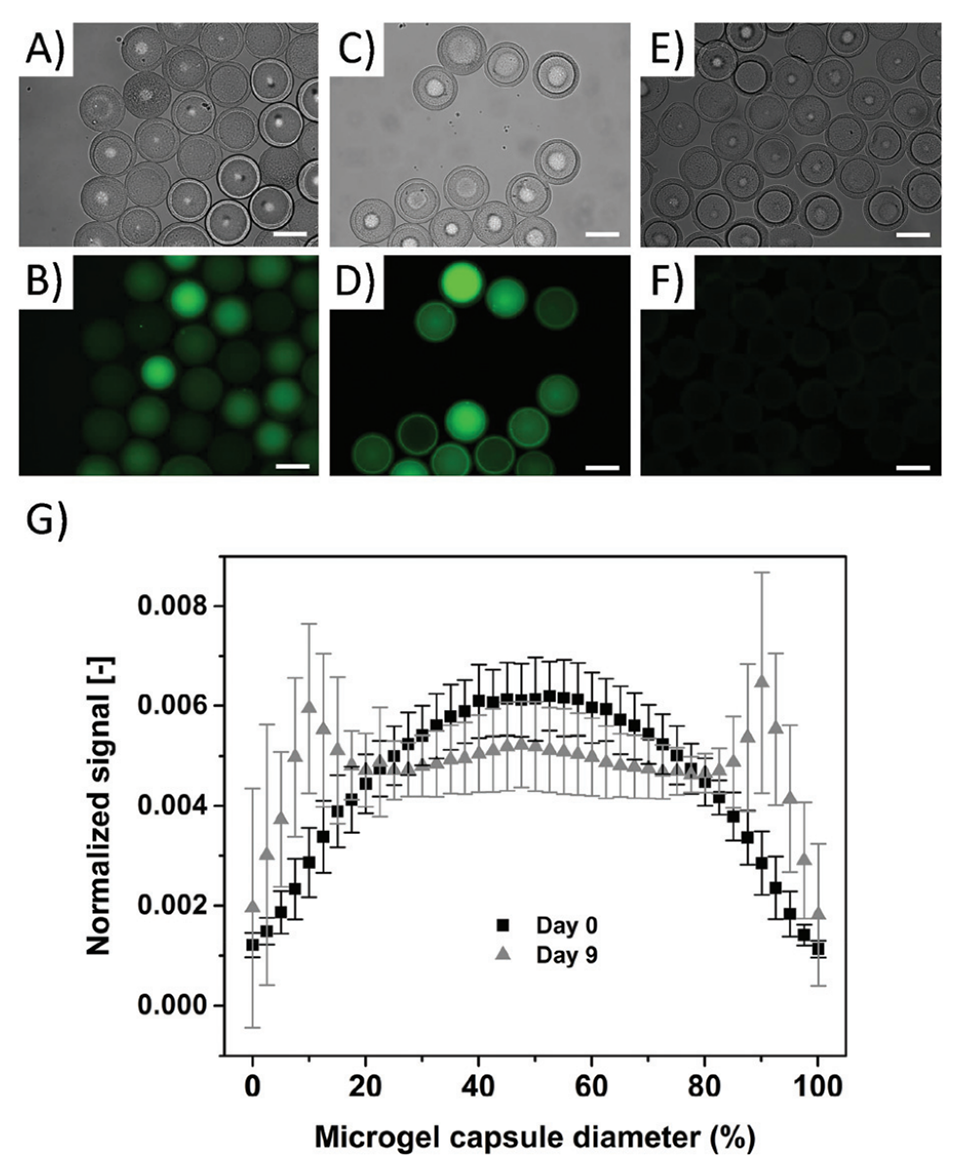
图5.A-B:纯化后(0天)含10 kDa FITC-葡聚糖的微凝胶胶囊明场及荧光图像,荧光信号集中于内腔。C-D:9天后荧光信号向壳层扩散,表明分子随壳层水解缓慢释放。E-F:无FITC-葡聚糖的对照胶囊无荧光信号。G:荧光信号分布分析显示,0天时信号呈钟形(集中于内腔),9天时信号在壳层处形成双峰,证实分子通过多孔网络扩散。
论文链接:https://doi.org/10.1039/C7BM00322F














