将外源性生物大分子有效递送至细胞内,在精准医疗和细胞治疗等领域至关重要。相较于受限于载体类型且效率较低的载体递送法,基于膜破坏的物理递送法展现出巨大潜力。然而,传统物理方法(如微针、电穿孔)难以平衡递送效率与细胞损伤。微流控芯片凭借其精确的流体控制、高通量和微型化优势,为解决这一难题提供了新平台。

近期,南京林业大学熊燃华教授、黄超伯教授、缪东洋等人发表综述,系统梳理了基于微流控芯片的物理性细胞内递送策略。文章将现有方法归纳为两大类:一类依赖微通道结构设计(如微注射、细胞挤压与流体剪切力)直接扰动细胞膜;另一类则结合外部物理场(如电、光、声、热)以提升递送效率与特异性,并详细探讨了其机制、优势及挑战。相关研究成果以“Physical Intracellular Delivery Based on Microfluidic Technology”为题,发表于期刊《Small》。
本文要点:
1、本文综述了基于微流控技术的物理胞内递送方法,指出胞内递送是精准医疗与细胞免疫疗法的核心策略,传统载体介导法受细胞类型限制、化学膜破坏法存在细胞损伤,而物理膜破坏法中微流控芯片因精准时空控制和高通量成为关键解决方案。
2、其核心递送方法分为两类:一是仅依赖芯片结构设计的微注射、细胞挤压、流体剪切力;二是结合外部物理场的电穿孔、光穿孔、声穿孔、热穿孔。文章重点阐述了各类方法的机制、具体途径、应用、优势与局限性。
3、同时分析了微流控芯片核心材料与微通道设计的影响,指出当前面临规模化制造、效率-细胞损伤平衡及FDA监管审批等挑战,展望了AI/深度学习优化参数、3D打印规模化及CAR-T制备等临床转化方向。
一张图读懂全文:
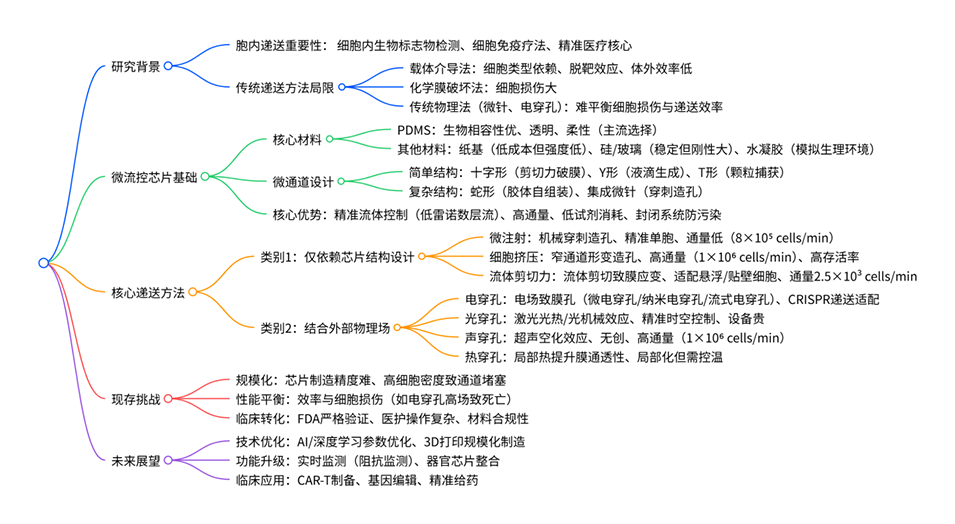
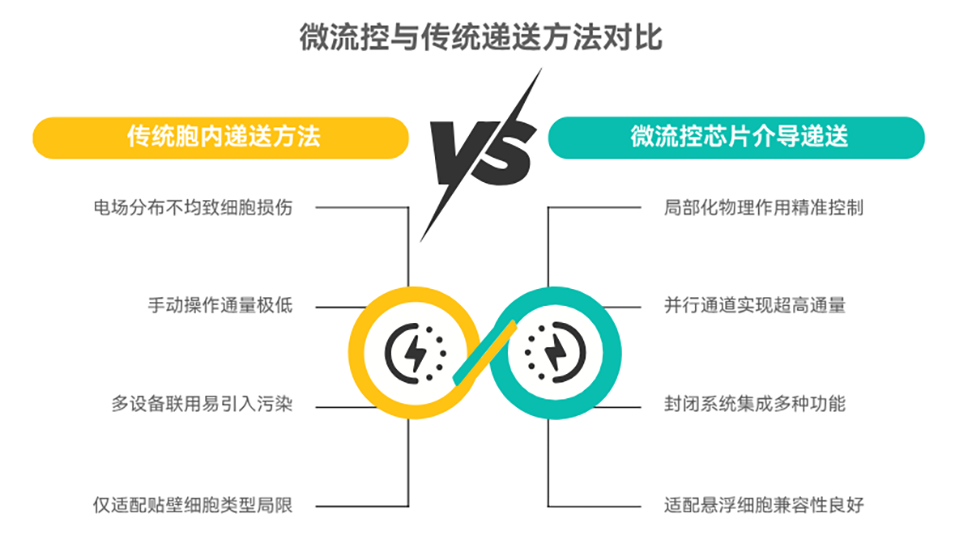
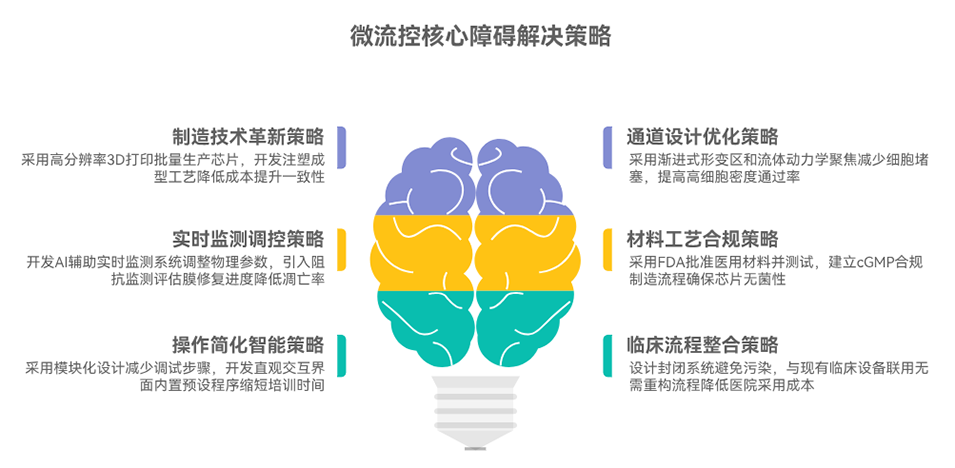

图1:基于微流控芯片的物理胞内递送示意图
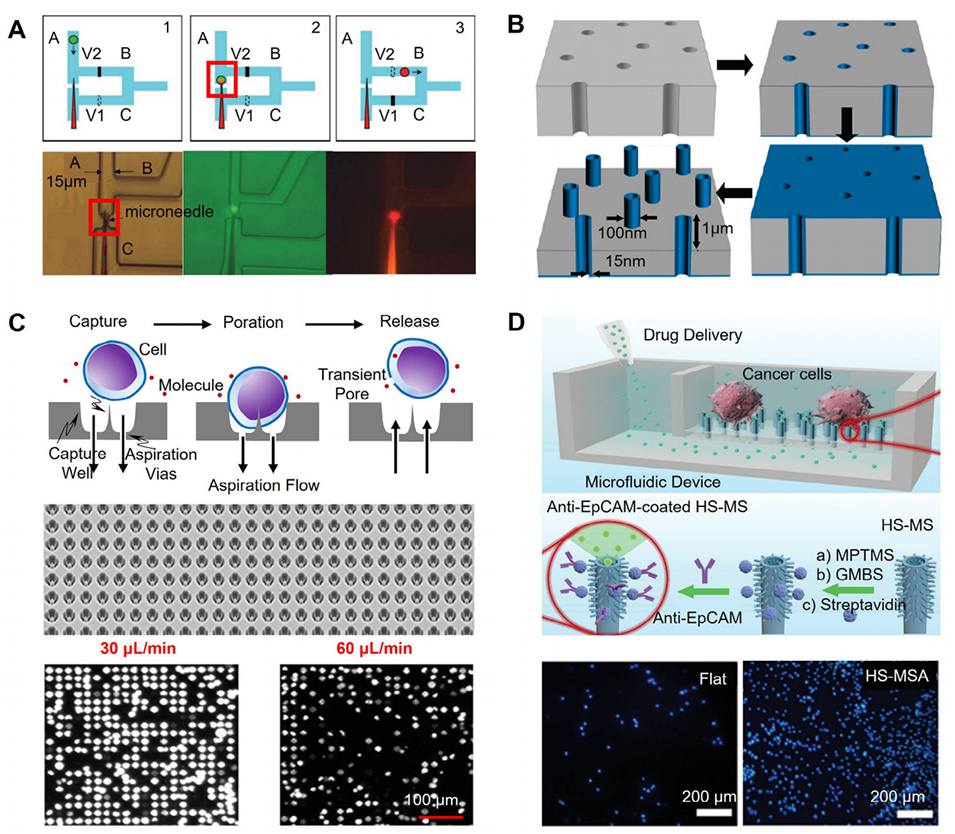
图2:微注射诱导膜透化用于胞内递送的示意图
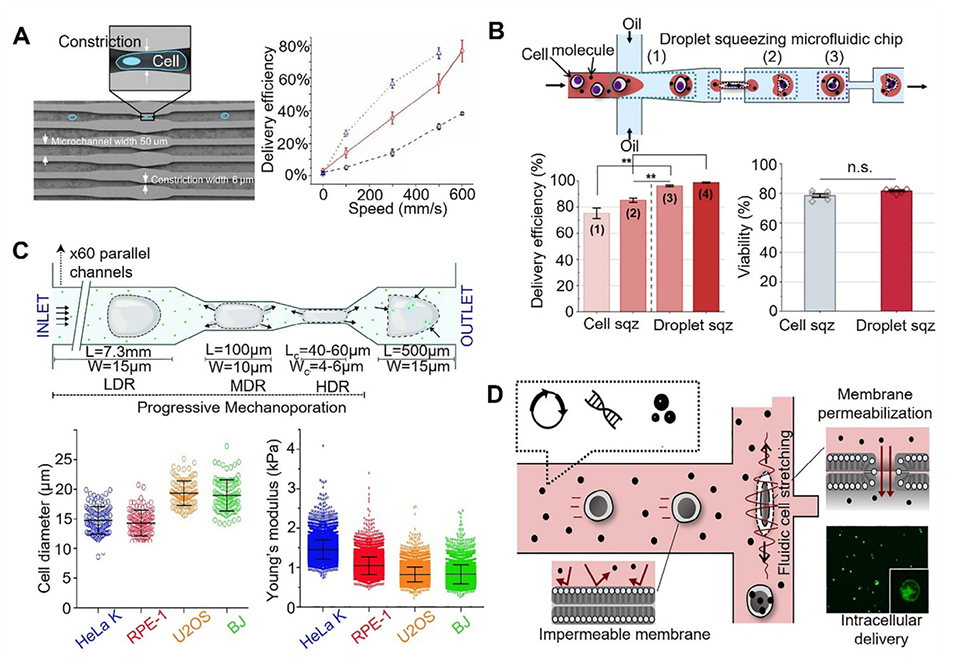
图3:用于胞内载体递送的微流控诱导细胞挤压平台示意图
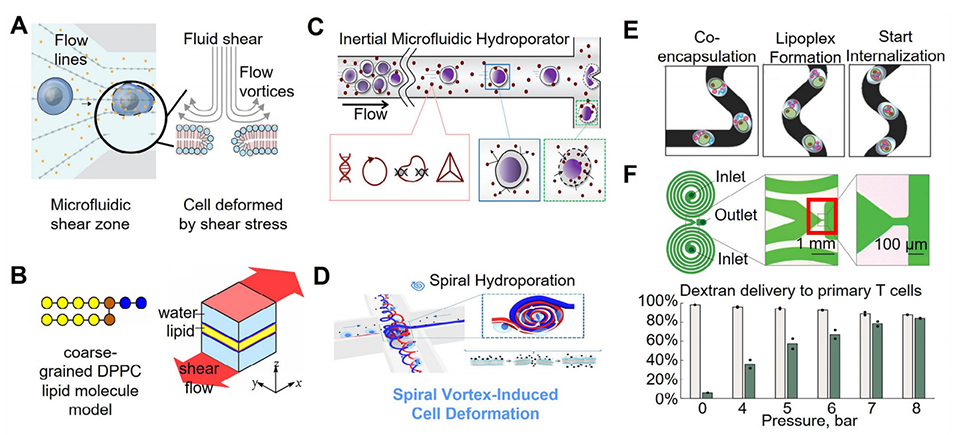
图4:利用微流控产生流体剪切力的胞内载体递送平台示意图
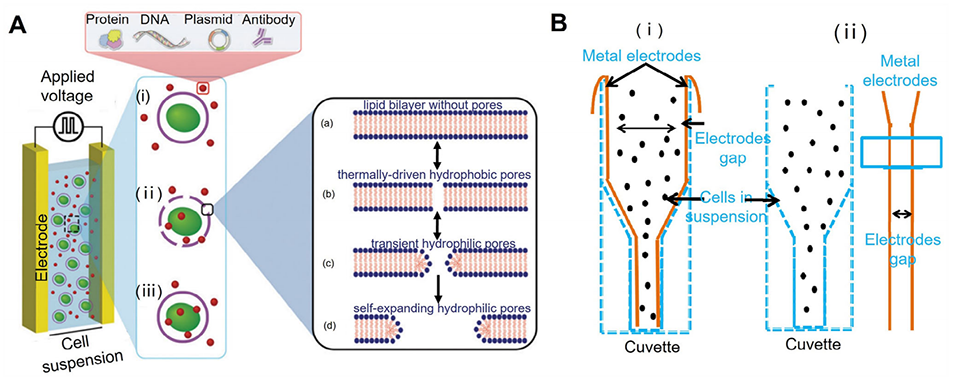
图5:用于胞内载体递送的批量电穿孔(EP)示意图
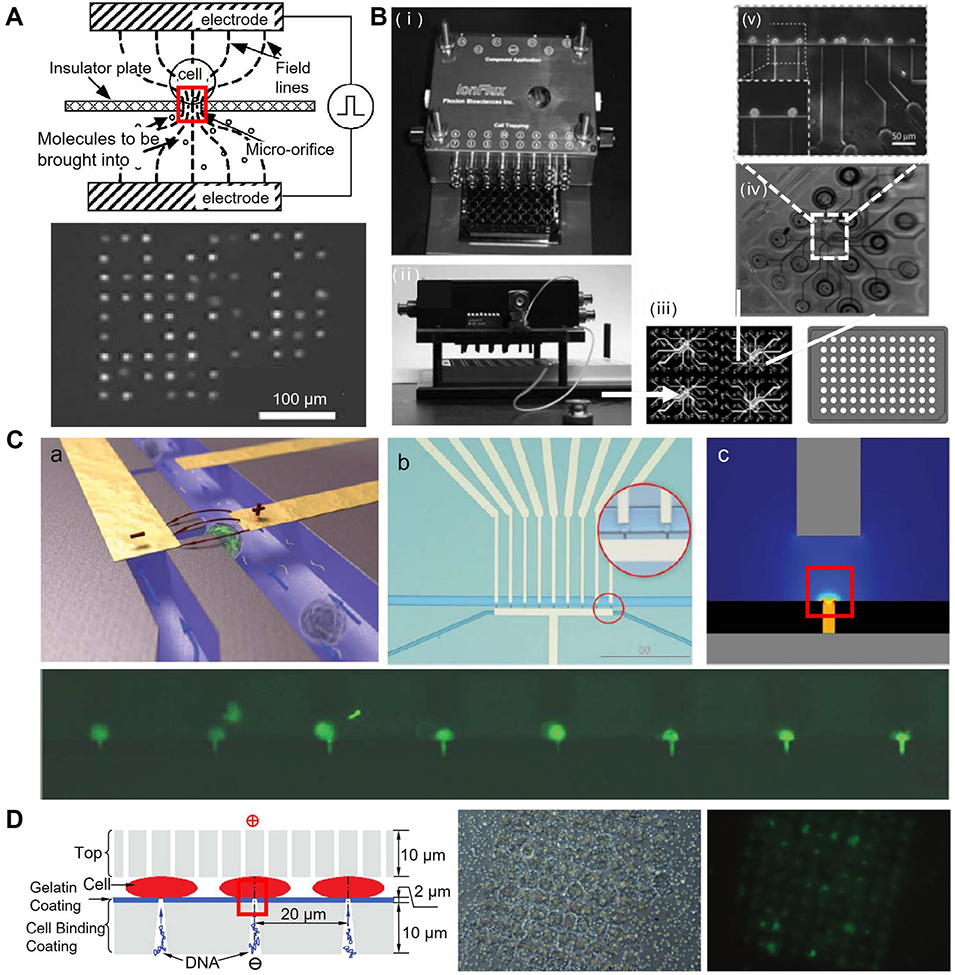
图6:结合单细胞电穿孔的微流控胞内递送平台示意图
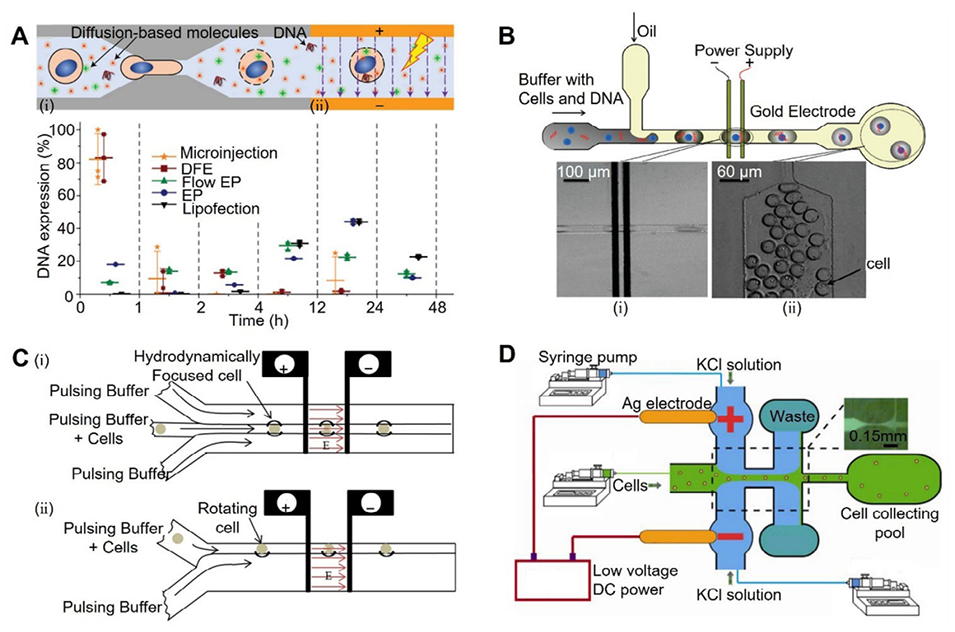
图7:结合连续电穿孔的微流控胞内递送平台示意图
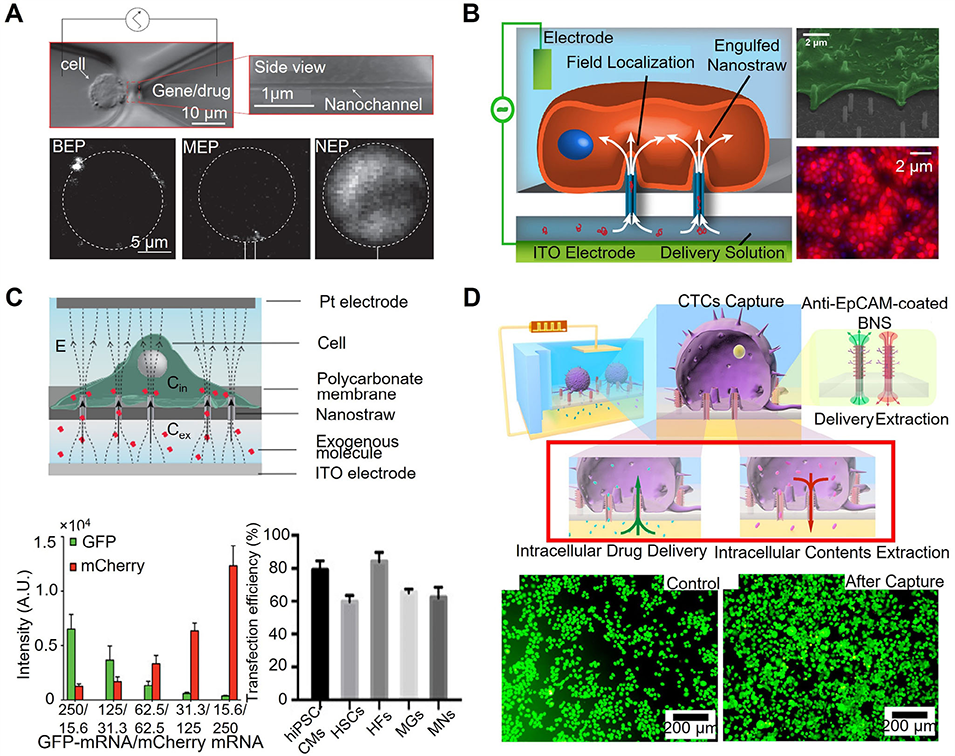
图8:结合静态电穿孔的微流控胞内递送平台示意图
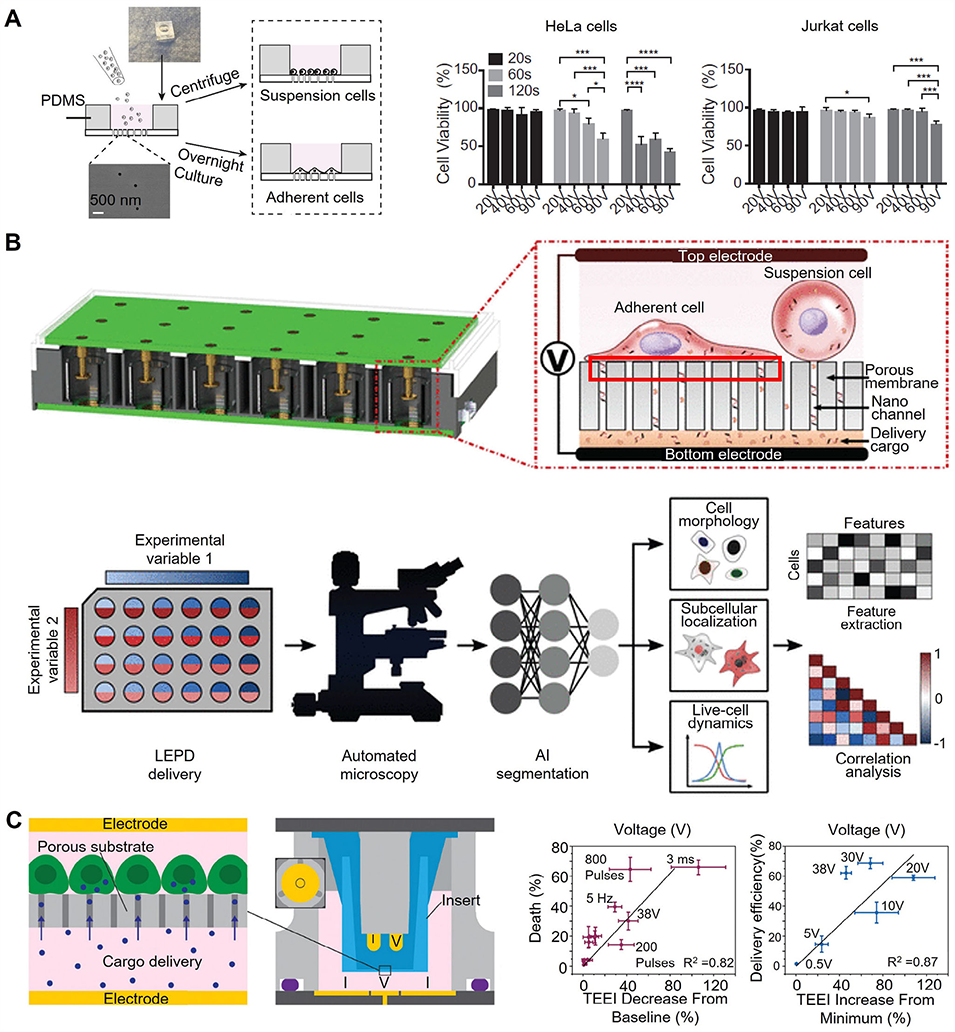
图9:结合纳米孔电穿孔的微流控胞内递送平台示意图
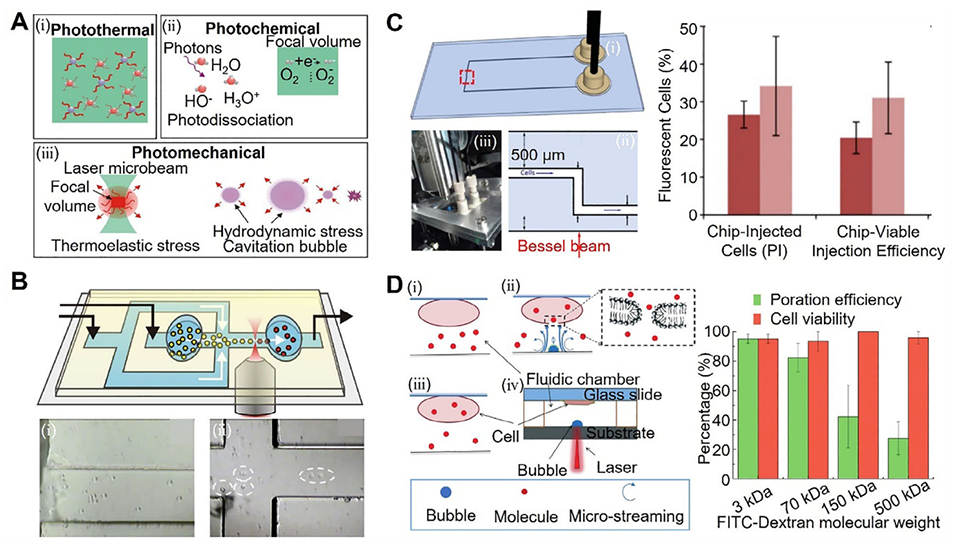
图10:结合光穿孔的微流控胞内递送平台示意图
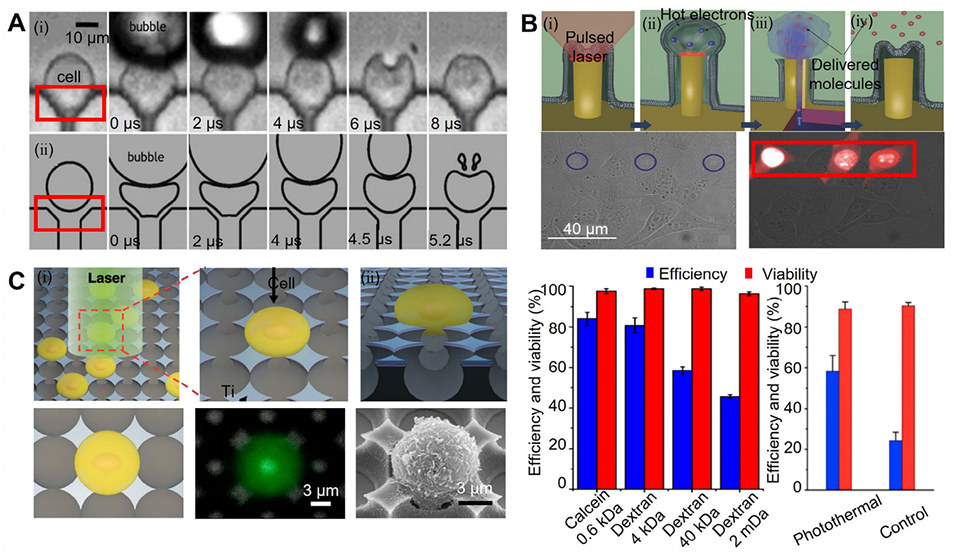
图11:结合光穿孔的微流控细胞捕获与胞内递送平台示意图
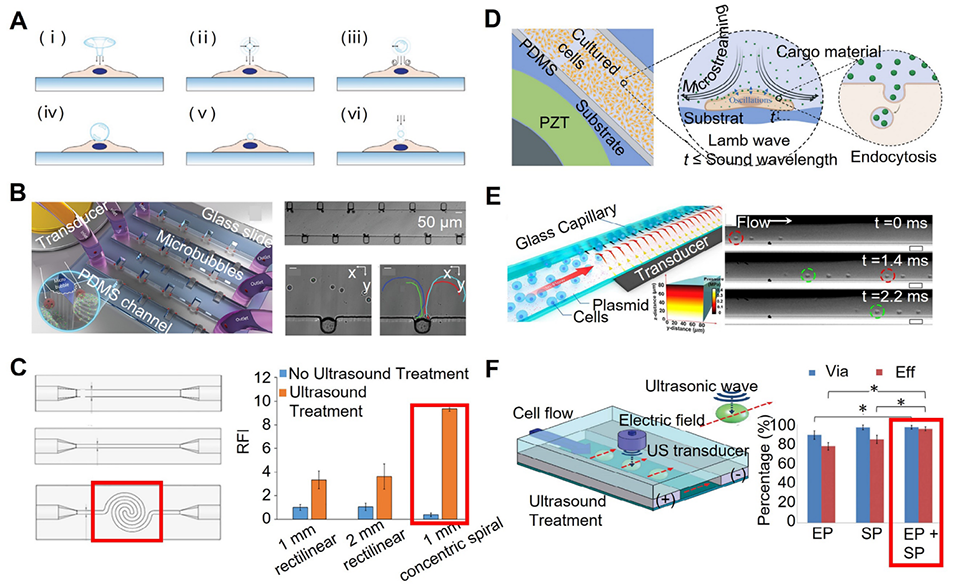
图12:结合声穿孔的微流控胞内载体递送平台示意图
论文链接:https://doi.org/10.1002/smll.202504048
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














