
导读:
疼痛是一项重大的公共卫生挑战。尽管药物治疗是主要镇痛手段,但其效用受到不良副作用和潜在依赖性的限制。针灸通过刺激穴位发挥镇痛作用,但存在特异性差、参数不明确等问题。近期,同济大学附属上海市第四人民医院麻醉与围术期医学科熊利泽教授、陈辉主任医师等人开发了一种负载腺苷的粘附性水凝胶微球,通过微流控技术制备,能精准附着于ST36穴位并缓慢释放腺苷,模拟针灸的镇痛作用。动物实验表明,单次给药即可实现长达7天的持续镇痛和全身抗炎效果。相关研究以“Adenosine-loaded adhesive microfluidic hydrogel microspheres stimulate acupoint activation for pain management”为题目,发表于期刊《Materials & Design》。
本文要点:
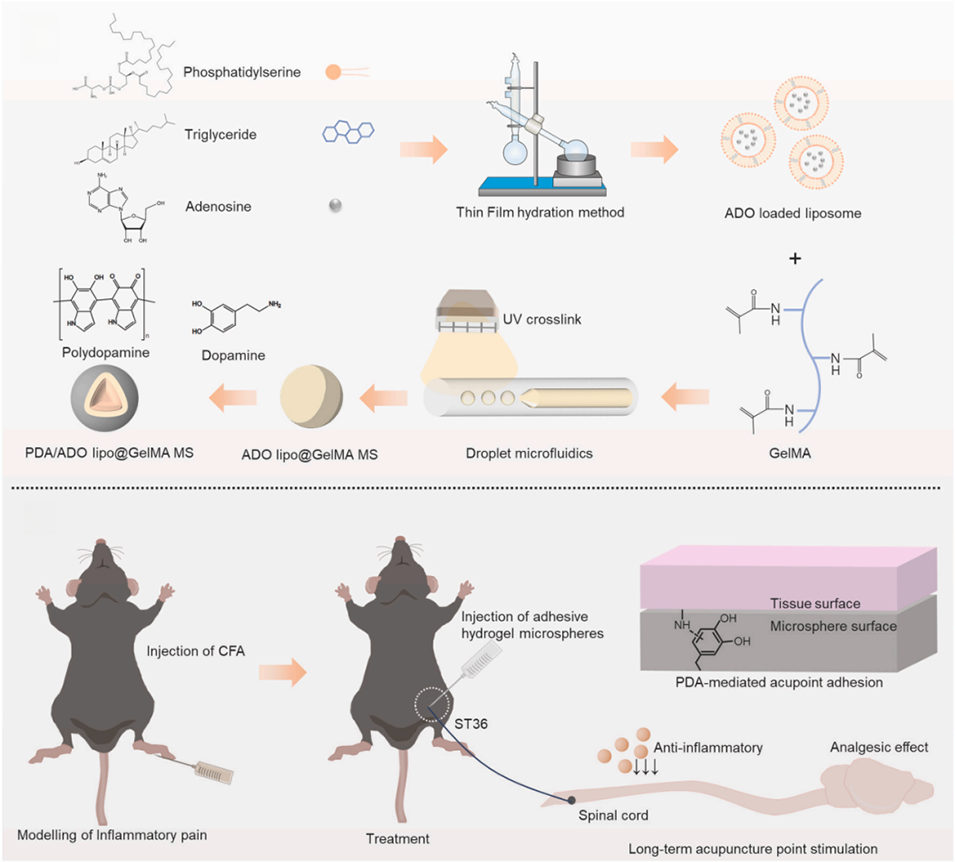
1、本研究开发了一种载腺苷(ADO)的粘性微流控水凝胶微球(PDA/ADO lipo@GelMA MS) 用于疼痛管理。
2、该微球通过微流控技术制备,以甲基丙烯酰化明胶(GelMA) 为水凝胶基底,包裹载ADO的磷脂酰丝氨酸(PS)脂质体,并在表面接枝聚多巴胺(PDA) 以增强粘性。
3、载有腺苷的粘性水凝胶微球可以在ST36穴位缓慢释放外源性腺苷,以模拟针灸的镇痛效果。
4、体外和体内研究表明,单次给药该粘性微球可有效靶向穴位、提高机械痛阈,并提供长达7天的全身抗炎作用。总体而言,所提出的粘性水凝胶微球系统为针灸实践和疼痛管理提供了新的视角。
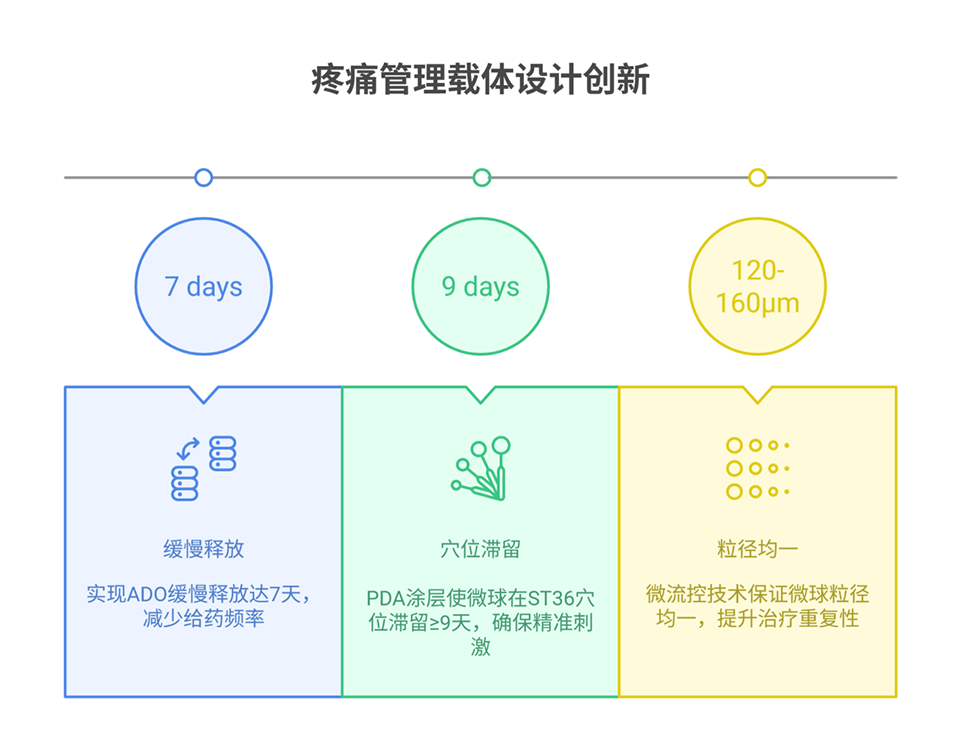

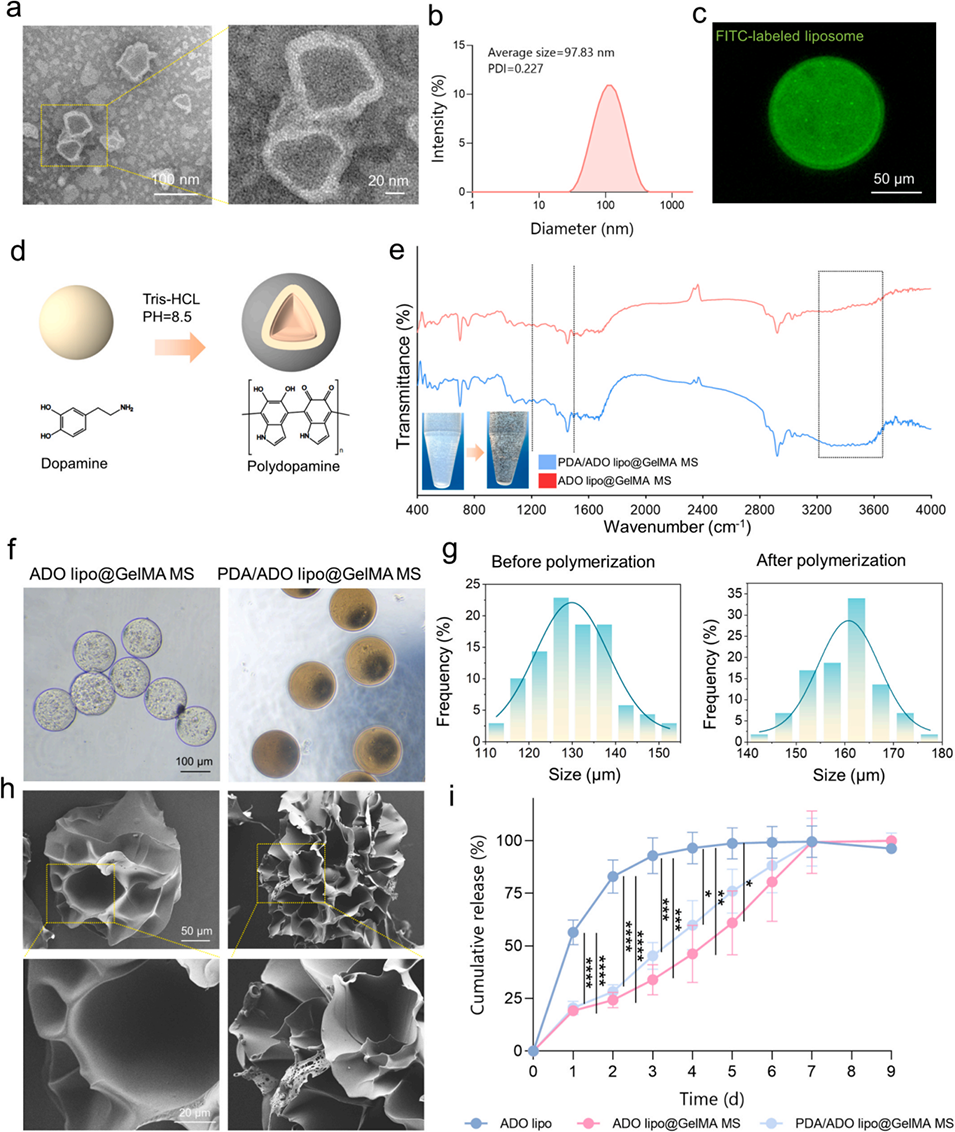
图1. 水凝胶微球的制备与表征。a)载腺苷(ADO)磷脂酰丝氨酸(PS)脂质体的透射电子显微镜(TEM)图像;b)脂质体的粒径分布;c)荧光素异硫氰酸酯(FITC)标记脂质体包封于水凝胶微球内的荧光图像;d)聚多巴胺(PDA)在甲基丙烯酰化明胶(GelMA)微球(MS)表面聚合的机制示意图;e)微球的傅里叶变换红外光谱(FTIR)图;f)微球的光学显微镜图像;g)聚多巴胺(PDA)包覆前后甲基丙烯酰化明胶(GelMA)微球的粒径分布;h)微球的扫描电子显微镜(SEM)图像;i)腺苷(ADO)的累积释放曲线(n=3)。采用双向重复测量方差分析(ANOVA)结合邦费罗尼事后检验分析时间×组间差异,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
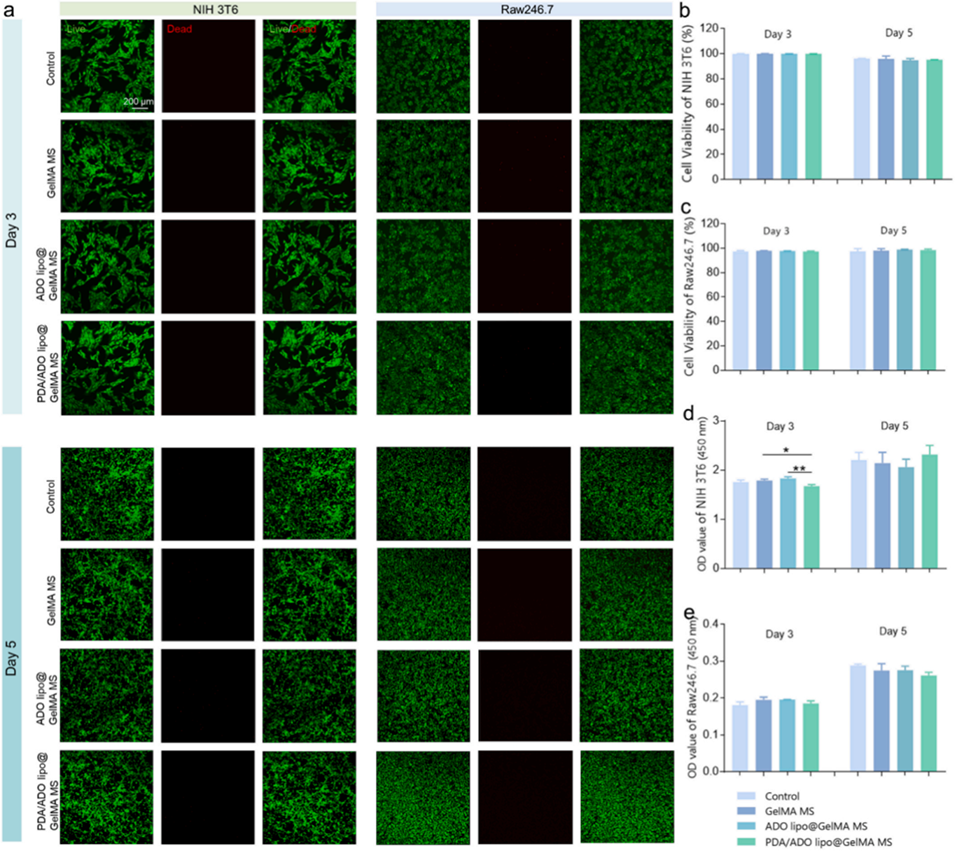
图2. 水凝胶微球的生物相容性表征。a)与水凝胶微球共培养细胞的活/死染色结果;b)NIH 3T6细胞的存活率定量结果(n=3);c)Raw246.7细胞的存活率定量结果(n=3);d)NIH 3T6细胞的细胞计数试剂盒-8(CCK8)检测结果(n=3);e)Raw246.7细胞的细胞计数试剂盒-8(CCK8)检测结果(n=3)。采用单因素方差分析(ANOVA)进行数据统计,*p<0.05,**p<0.01。

图3. 水凝胶微球的粘附性与穴位滞留性表征。a)水凝胶微球粘附性能的评估结果;b)穴位注射示意图;c)微球在穴位处的体内滞留能力表征(n=6)。采用双向重复测量方差分析(ANOVA)结合邦费罗尼事后检验分析时间×组间差异,*p<0.05。
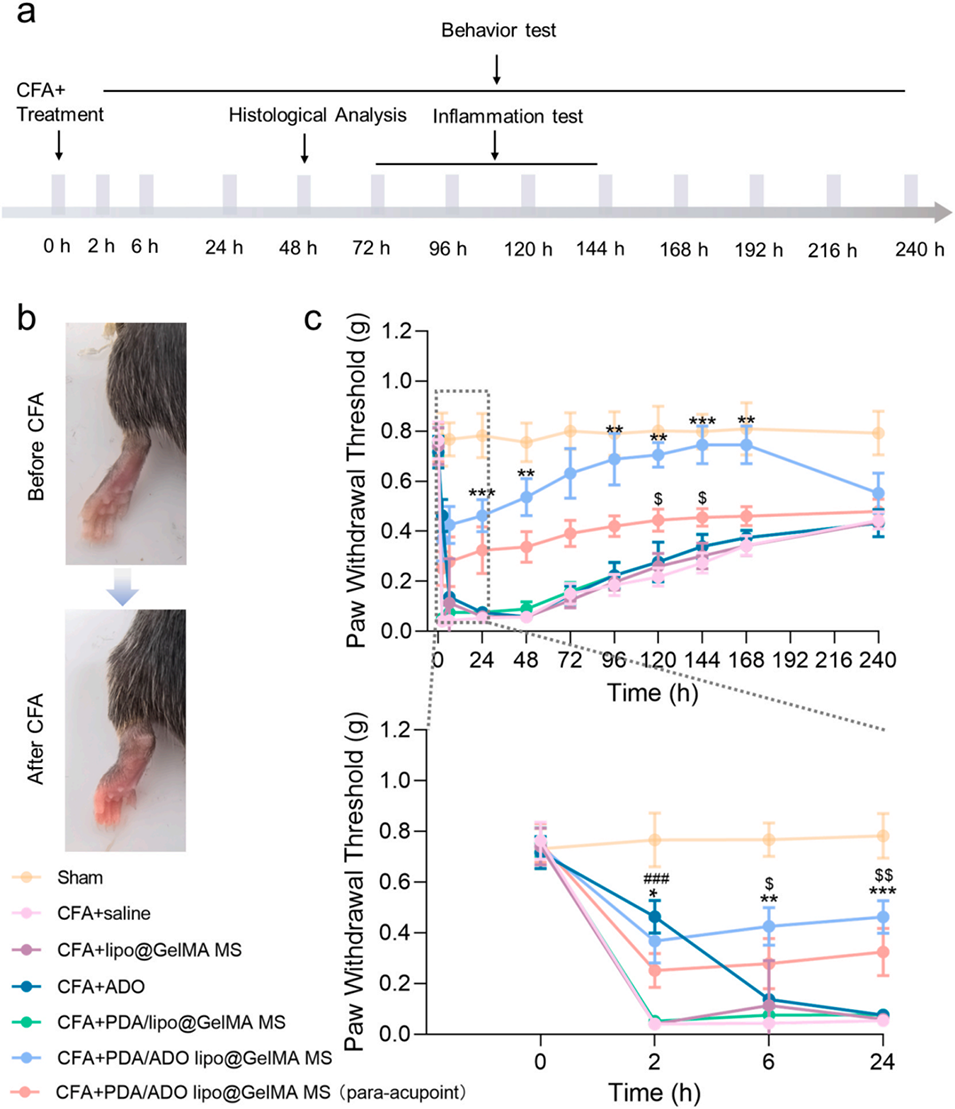
图4. 炎症疼痛模型中的体内镇痛效果评估。a)造模、治疗及疼痛检测的时间线示意图;b)完全弗氏佐剂(CFA)处理后小鼠爪部的照片;c)腺苷(ADO)或各材料处理对完全弗氏佐剂(CFA)模型小鼠爪退缩阈值(PWT)的影响(n=6)。
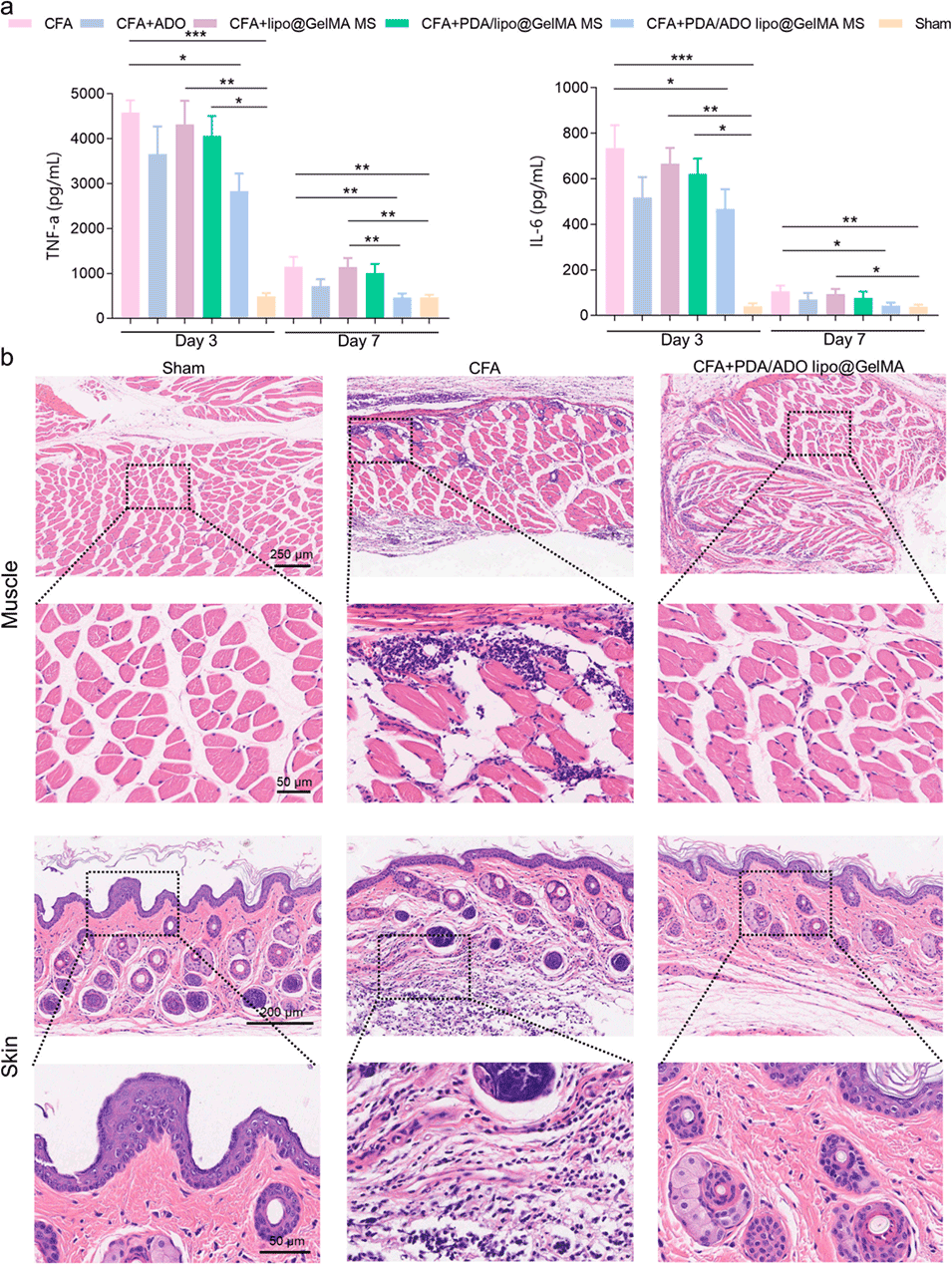
图5. 炎症疼痛模型中的体内抗炎效果评估。a)体内炎症相关细胞因子(肿瘤坏死因子-α,TNF-α;白细胞介素-6,IL-6)的水平;b)小鼠足底周围肌肉与皮肤组织的苏木精-伊红(H&E)染色结果(n=6)。采用克鲁斯卡尔-沃利斯检验(Kruskal-Wallis tests)进行数据统计,*p<0.05,**p<0.01,***p<0.001。
论文链接:https://doi.org/10.1016/j.matdes.2025.114708
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














