重金属因其毒性和不可生物降解性而对人类生命构成严重威胁。生物修复是一种通过自然生物过程去除有害物质的有效绿色策略。然而,微生物的应用在很大程度上受到限制,因为浮游微生物难以抵抗恶劣环境,并且在自然界中很难回收。

近期,山东第一医科大学魏云云、韩子强、毛小龙等人开发了一种利用液滴微流控技术制备的活性益生菌Janus微粒,可有效去除废水中的铜离子(Cu2+),提供了一种绿色可持续的生物修复策略。相关研究以“Bioremediation of heavy metal ion (Cu2+) by live probiotic Janus microparticles using droplet-based microfluidic technique”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究采用液滴微流控和光交联技术制备了具有磁性的活性益生菌Janus微粒。
2、布拉氏酵母菌(S. boulardii)和Fe3O4纳米粒子分别被包裹在Janus微粒的两个半球中,封装的S. boulardii在第10天和第15天的存活率均超过90%,且未从水凝胶中释放。
3、这种活性益生菌Janus微粒可以有效去除废水中的铜离子(Cu2+),7天后Cu2+的去除率达到64.78%。微粒中布拉氏链球菌的吸附能力达到51.83mg/g。
4、暴露于Cu2+ 5天后,包封的布拉氏链球菌的细胞活力是游离布拉氏链球菌的5倍。
5、RNA测序和western blotting结果表明,布拉氏链球菌Janus微粒对Cu2+的去除主要依赖于铜/锌超氧化物歧化酶介导的生物转化过程。
在这项研究中,Janus微粒由两个不同的半球组成,每个半球都有特定的功能:
聚乙二醇二丙烯酸酯(PEGDA)半球:这个半球提供了一个物理屏障,用于封装活性益生菌 boulardii。PEGDA是一种水凝胶材料,能够保护封装在内的S. boulardii免受外界恶劣环境的影响,并且防止S. boulardii从微粒中释放。
乙氧基化三羟甲基丙烷三丙烯酸酯(ETPTA)半球:这个半球赋予了微粒良好的磁性,使其能够在外部磁场的作用下被操纵和移动。这主要源于该半球中包裹的磁性纳米颗粒(Fe3O4NPs),这些磁性纳米颗粒使得Janus微粒具备磁性特性,便于通过磁力回收和重复使用。
这种结构设计使得Janus微粒在生物修复应用中具有独特的优势:一方面,活性益生菌S. boulardii可以在PEGDA半球中进行生物转化和重金属离子的吸附;另一方面,ETPTA半球的磁性特性使得微粒可以方便地从废水中回收,实现循环利用。这种设计提高了微粒的环境适应性和操作便利性,对于提高生物修复效率和降低成本具有重要意义。
活性益生菌Janus微粒通过以下机制有效去除废水中的铜离子(Cu2+):
1、吸附作用:Janus微粒中的活性益生菌S. boulardii具有吸附铜离子的能力。S. boulardii细胞表面的官能团(如羧基、氨基、羟基和硫酸基)可以与铜离子形成络合物,从而实现铜离子的吸附。
2、生物转化:S. boulardii通过其代谢活动,将铜离子转化为较低毒性或者更易于处理的形式。这一过程涉及到铜/锌超氧化物歧化酶(SOD1)等酶的催化作用,促进铜离子的生物转化。
3、细胞内部积累:S. boulardii能够将铜离子吸收到细胞内部,通过细胞内的生物化学反应将铜离子转化为细胞可耐受的形式,从而减少外界环境中的铜离子浓度。
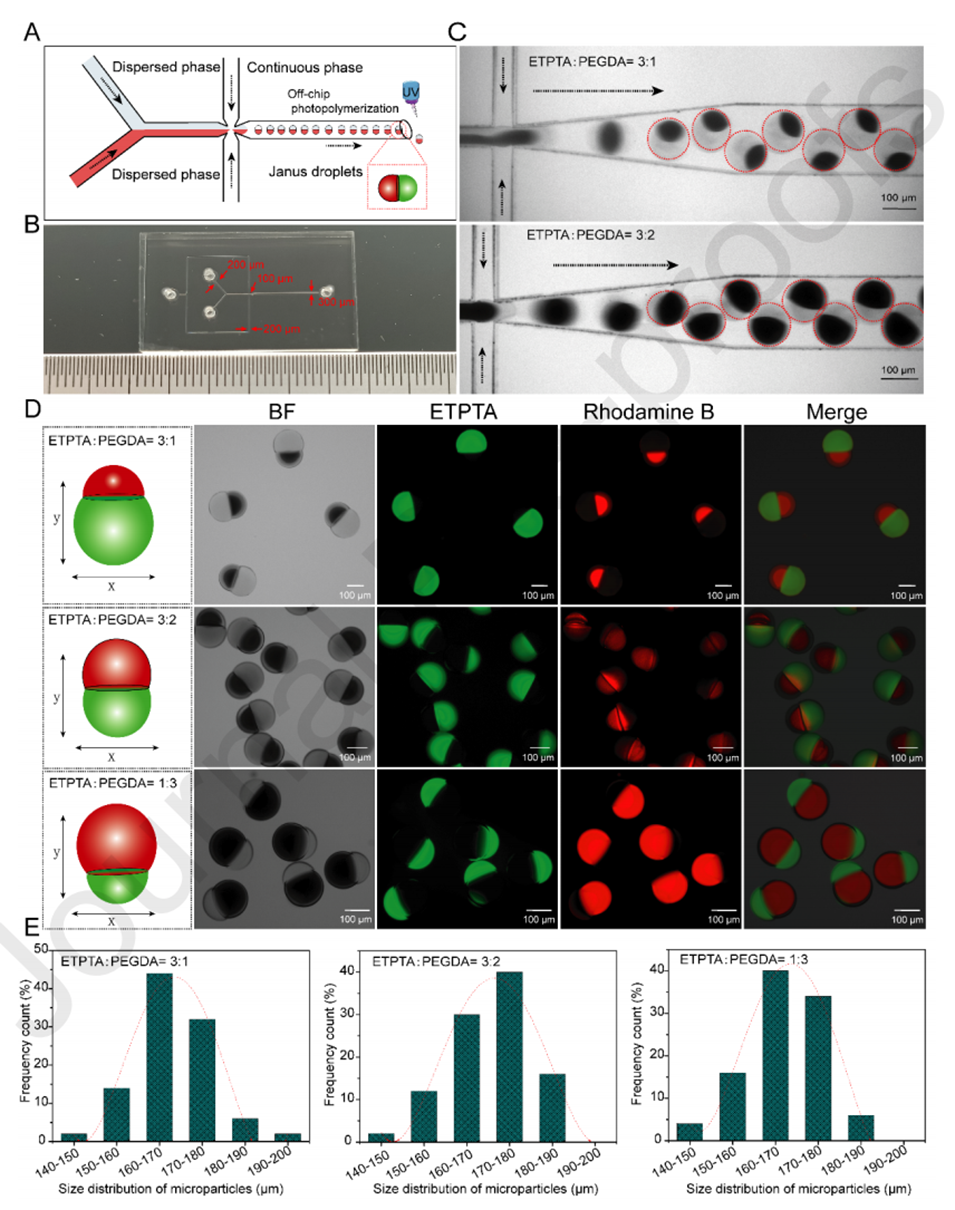
图1.(A)流动聚焦微流体装置中Janus微粒的生成示意图。(B)微流控芯片的图片,标明了通道的宽度。(C)当ETPTA和PEGDA之间的流速比为3:1和3:2时,微流体通道中会产生Janus液滴。(D)当ETPTA和PEGDA之间的流速比为3:1、3:2和1:3时,Janus微粒的亮场和荧光图像。ETPTA发出绿色荧光,而包封在PEGDA中的罗丹明B发出红色荧光。(E)不同分散相流速下产生的Janus微粒的尺寸分布。
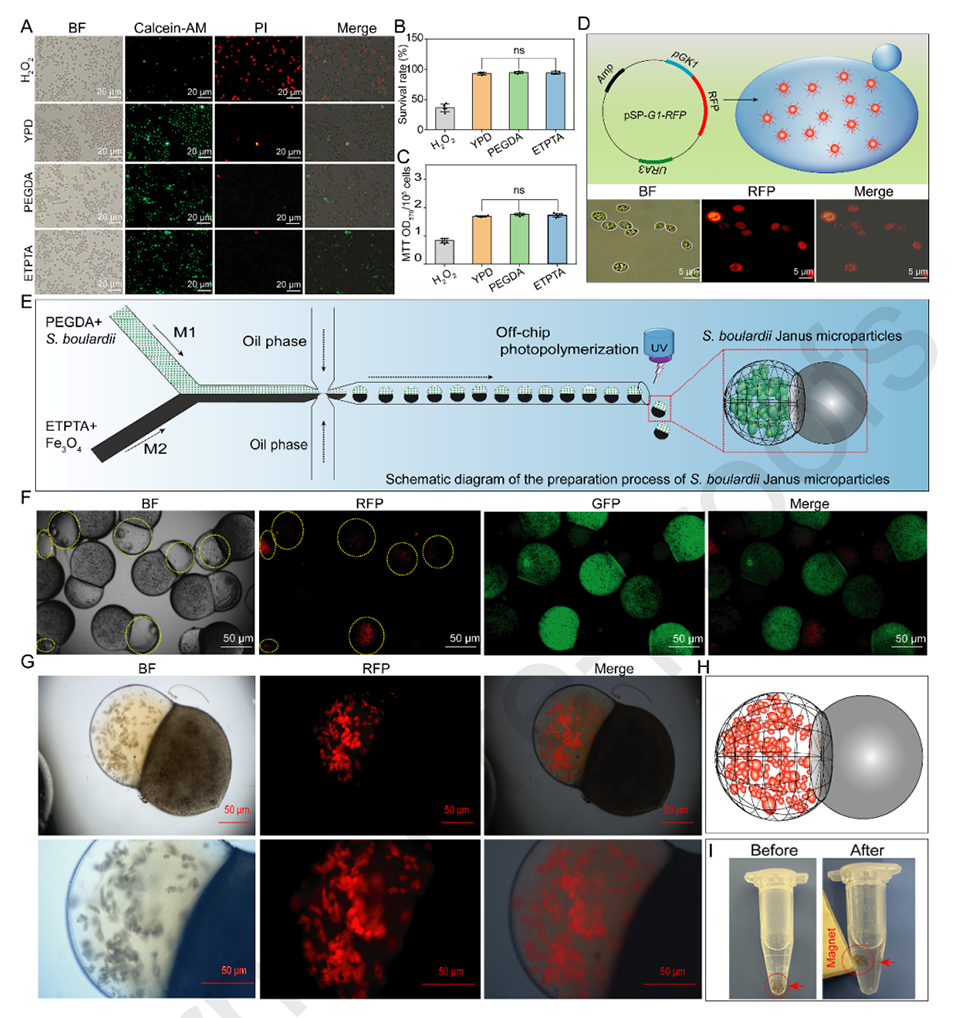
图2.(A)PEGDA和ETPTA对布拉氏酵母菌的生物相容性。用H2O2(10mM)、PEGDA和ETPTA培养24小时后,用钙黄绿素AM/PI对布拉氏酵母菌进行染色。BF(亮场)、钙黄绿素AM(活细胞)和PI(死细胞)。不同条件下培养的布拉氏酵母菌的存活率(B)和细胞活性(C)。(D)RFP标记布拉氏酵母菌的结构和光学图像。pSP-G1-RFP质粒转化布拉氏酵母菌后,在不含Uri的YPD培养基中培养细胞。(E)Fe3O4纳米粒子和布拉氏酵母菌功能化Janus微粒的制备过程示意图。(F)活性益生菌包裹磁性Janus微粒的光学图像。RFP标记的布拉氏酵母菌在Fe3O4纳米粒子功能化的Janus微粒中的荧光图片(G)和示意图(H)。使用荧光显微镜观察布拉氏酵母菌。(I)磁性表征。通过外部磁体收集由Fe3O4 NPs和布拉氏酵母菌功能化的Janus微粒。根据不同的p值定义统计显著性:*p<0.05、**p<0.01和***p<0.001,ns:两组数据之间的比较没有统计学意义。
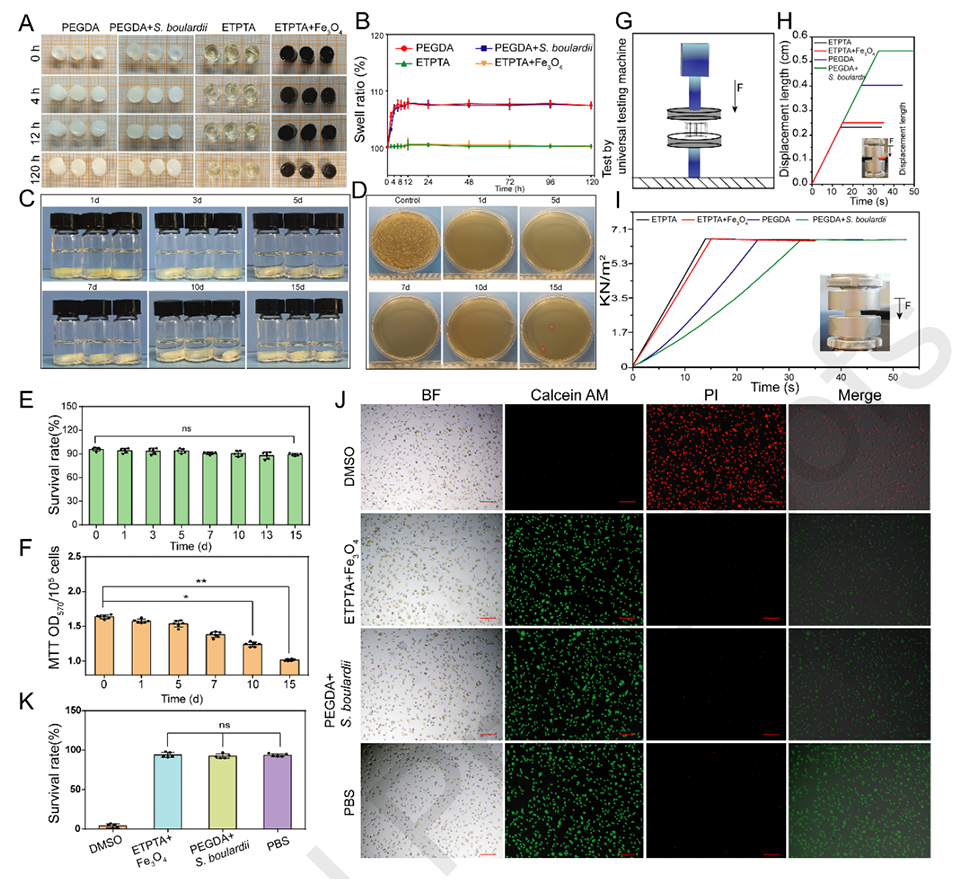
图3.不同组分(PEGDA、PEGDA+布拉氏酵母菌、ETPTA和ETPTA+Fe3O4)在无菌水中浸泡不同时间后的照片(A)和溶胀比(B)。(C)PEGDA+S. boulardii水凝胶在PBS缓冲液中浸泡不同时间后的图像。(D)布拉氏酵母菌菌落在YPD培养基上的照片,该培养基来源于不同时间的PEGDA+布拉氏酵母菌浸泡溶液。采用多功能酶联免疫吸附测定仪测定布拉氏酵母菌的存活率(E)和细胞活性(F)。(G)使用万能试验机进行压缩强度测试的示意图。PEGDA+S.boulardii和ETPTA+Fe3O4的位移时间曲线(H)和载荷时间曲线(I)。(J)PEGDA+S.boulardii和ETPTA+Fe3O4的生物相容性试验。L929细胞用PEGDA+S.boulardii和ETPTA+Fe3O4浸提液培养2小时后,用钙黄绿素AM/PI试剂盒染色。钙黄绿素-AM(活细胞),PI(死细胞)。比例尺=50μm。(K)L929细胞的存活率。根据不同的p值定义统计显著性:*p<0.05、**p<0.01和***p<0.001,ns:两组数据之间的比较没有统计学意义。
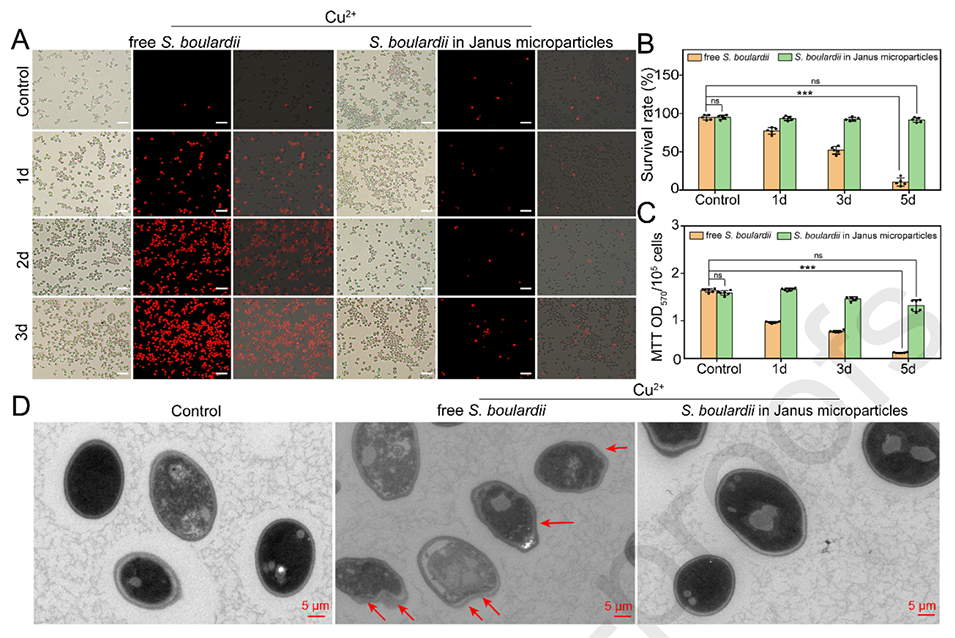
图4.(A)游离布拉氏酵母菌和包封在Janus微粒中的布拉氏酵母菌的PI阳性细胞。将布拉氏酵母菌和布拉氏酵母菌微粒与Cu2+(80mg/L)一起培养不同时间,然后用PI染色。布拉氏酵母菌和包封在Janus微粒中的布拉氏酵母菌在用Cu2+(80mg/L)培养后的存活率(B)、细胞活性(C)和TEM图像(D)。比例尺=50μm。根据不同的p值定义统计显著性:*p<0.05、**p<0.01和***p<0.001,ns:两组数据之间的比较没有统计学意义。
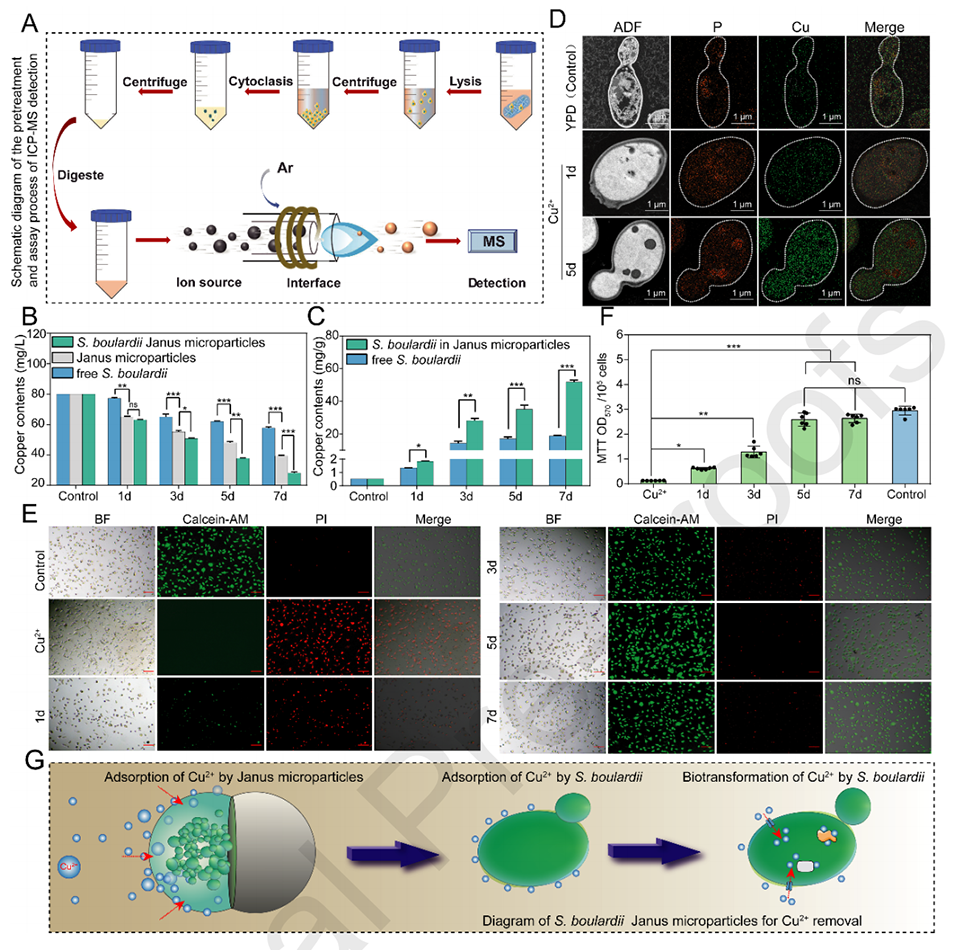
图5.(A)ICP-MS检测的预处理和分析过程示意图。(B)不同组别(布拉氏酵母菌、Janus微粒和布拉氏酵母菌Janus微粒)初始溶液中的残留铜含量。(C)游离布拉氏酵母菌和包裹在Janus颗粒中的布拉氏酵母菌细胞内铜含量的直方图。(D)布拉氏酵母菌的EDS。将布拉氏酵母菌微粒与Cu2+溶液培养1天和5天后,通过EDS对布拉氏酵母菌进行分析。(E)与布拉氏酵母菌微球孵育不同时间后,对Cu2+溶液进行细胞毒性试验。钙黄绿素AM/PI染色后,通过荧光显微镜观察PI阳性细胞。比例尺=50μm。(F)L929细胞在不同条件下的细胞活性。(G)Fe3O4 NPs和布拉氏酵母菌功能化的Janus微粒用于去除Cu2+的示意图。根据不同的p值定义统计显著性:*p<0.05、**p<0.01和***p<0.001,ns:两组数据之间的比较没有统计学意义。
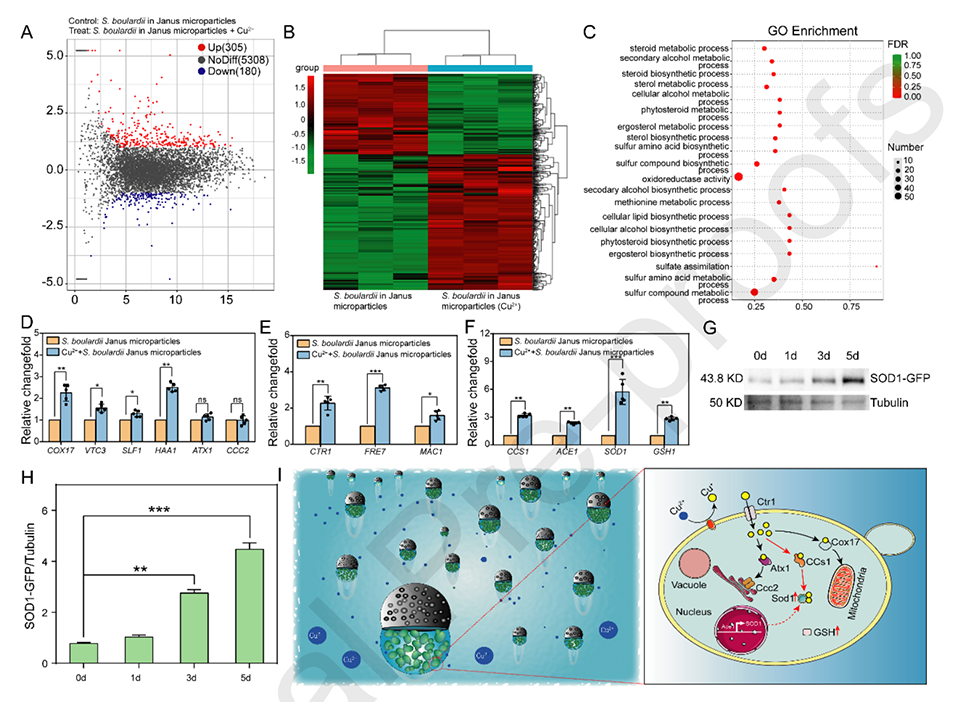
图6.(A)差异基因表达的转录组学分析。将布拉氏酵母菌微粒与Cu2+一起培养后,通过RNA-seq检测布拉氏酵母菌的基因表达。(B)差异基因表达的基因热图和(C)基因本体(GO)富集分析。(D,E和F)使用ACT1作为标准化基因通过RT-PCR分析Janus微粒中布拉氏酵母菌的基因表达水平。(G)SOD1-GFP的蛋白质印迹分析。布拉氏酵母菌微粒(SOD1-GFP-URA3)与Cu2+培养1、3和5天后,使用抗GFP进行蛋白质印迹分析以检测SOD1-GFP。使用抗微管蛋白抗体作为对照。(H)SOD1-GFP的图像灰度值分析。(I)布拉氏酵母菌微粒去除Cu2+的示意图。根据不同的p值定义统计显著性:*p<0.05、**p<0.01和***p<0.001。
论文链接:https://doi.org/10.1016/j.cej.2024.157855














