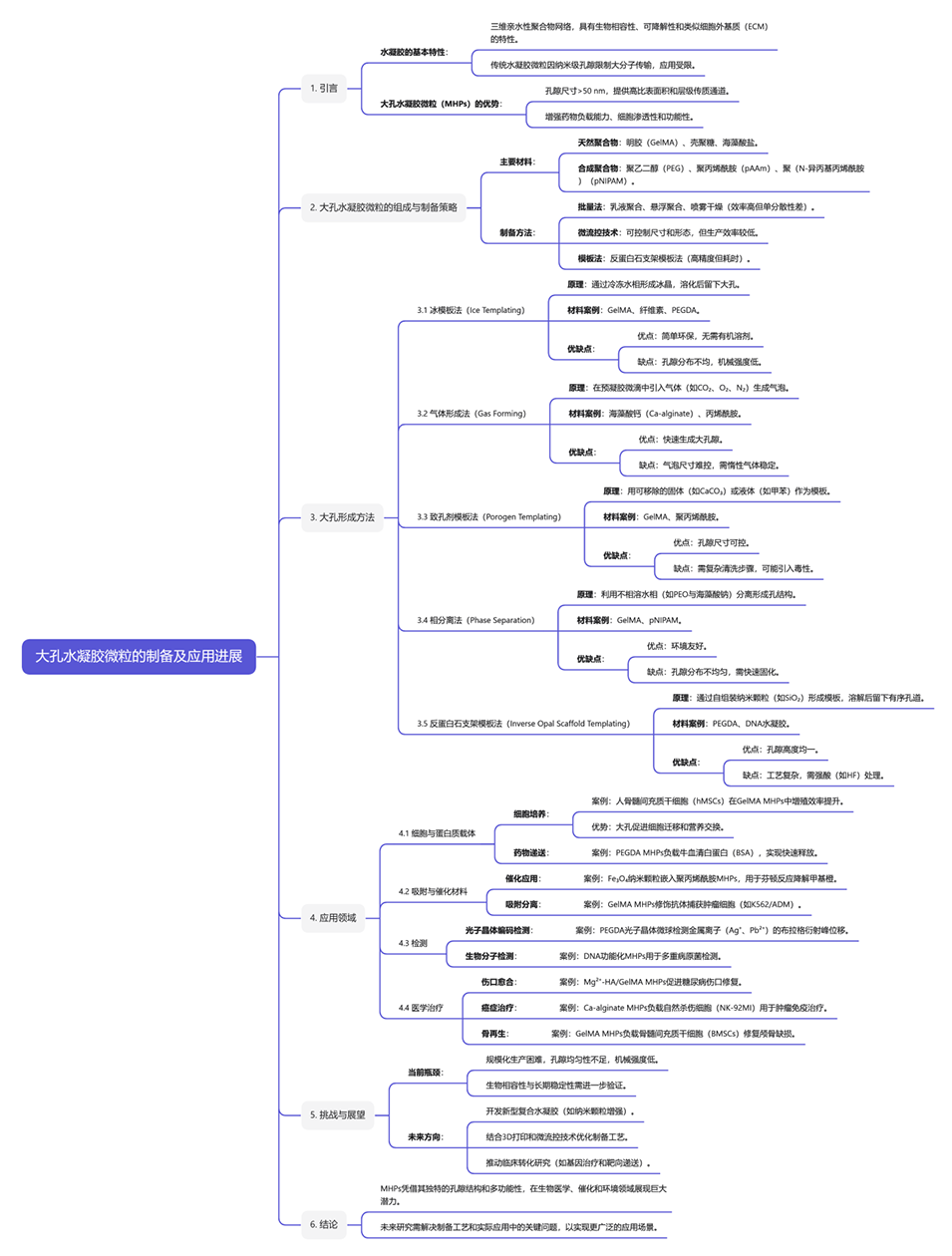
大孔水凝胶微粒(MHPs)是一种孔径大于50nm的水溶胀交联聚合物网络,因其优异的生物相容性、生物降解性和非细胞毒性而被广泛应用于生物、医学和化学领域。MHPs的高比表面积和分层传质通道使其成为药物递送、细胞相互作用和生物催化等特定应用的理想微载体。MHPs的合成通常需要一个协同过程,既要兼顾微珠的产生,又要兼顾其内部微孔结构的形成。近年来,研究人员开发了多种策略来制备具有高度可控大孔形态的功能性MHPs。

鉴于此,厦门理工学院刘英喆副教授联合清华大学徐建鸿教授、陈卓等人发表综述,全面概述了MHP生产和设计策略的最新进展,以及它们在不同领域的进一步应用。相关研究成果以“Recent advances of macroporous hydrogel microparticles: Fabrication and applications”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、综述了大孔水凝胶微粒研究的最新进展。
2、重点探讨了不同孔形成方法在水凝胶微珠中生成大孔的机制。
3、讨论了每种生成方法的优缺点。
4、提供了大孔水凝胶微粒的最新应用实例。
5、展望了大孔水凝胶微粒的发展前景。
一张图读懂全文
大孔水凝胶微粒(MHPs)在药物递送中的独特优势主要体现在以下几个方面:
1、高负载能力:其层级孔隙结构(孔隙尺寸>50 nm)提供了更大的比表面积和内部空间,能够高效负载药物分子甚至大分子(如蛋白质、核酸),例如GelMA MHPs可负载多柔比星(DOX)并通过孔隙网络实现高包埋率。
2、可控释放:孔隙的连通性和尺寸直接影响药物扩散速率,通过调控孔径大小(如冷冻模板法分阶段冷冻生成梯度孔隙)可实现从快速突释到长期缓释的灵活调节。
3、环境响应性:结合温敏(如pNIPAM)、pH敏感(如聚甲基丙烯酸,PMAA)或酶响应材料,MHPs可在特定生理条件下(如肿瘤微酸环境)触发孔隙结构变化,实现靶向释放,例如PMAA MHPs在pH 6.0以下溶胀加速药物释放。
4、生物相容性与保护作用:天然聚合物(如海藻酸盐、壳聚糖)构建的MHPs可减少免疫排斥,同时大孔结构隔离药物与外界环境,避免提前降解(如核酸药物在胃肠液中的保护)。
该综述得出了多项重要发现和见解:
1、大孔水凝胶微粒(MHPs)通过引入大于50 nm的孔隙结构,显著提升了比表面积和传质效率,使其在药物递送、细胞培养和生物催化等领域展现出比传统水凝胶更优的负载能力和响应速率。
2、多种制备方法(如冷冻模板法、气体形成法和反蛋白石模板法)被开发用于调控孔隙尺寸与分布,其中微流控技术能实现单分散微粒的高精度制备,但规模化生产和机械强度仍是主要挑战。
3、MHPs在生物医学应用中表现突出,例如负载自然杀伤细胞(NK-92MI)用于肿瘤免疫治疗、搭载干细胞促进骨再生,以及通过光子晶体编码实现多重生物分子检测,验证了其功能多样性。
4、当前研究需解决材料机械强度不足和生物相容性优化问题,未来方向包括开发动态响应型复合水凝胶、结合3D打印技术提升制备效率,以及推动临床转化中的标准化评价体系建立。
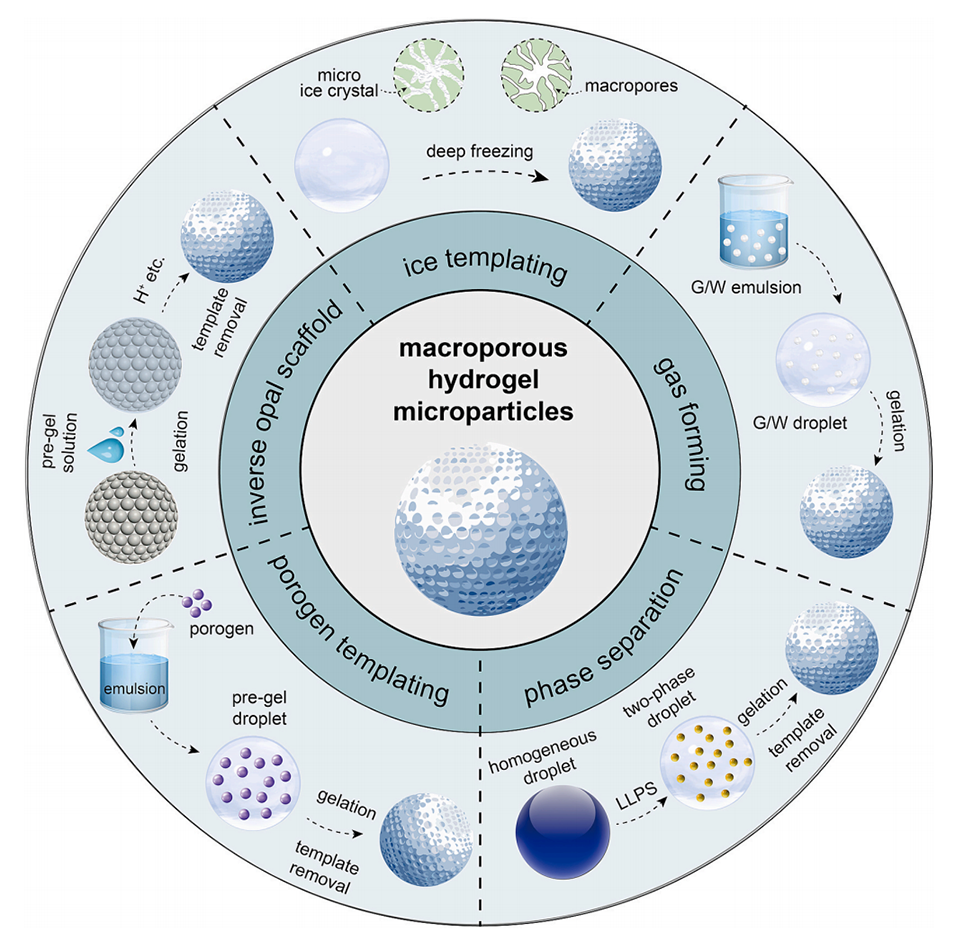
图1.制备大孔结构水凝胶微粒的传统方法示意图,包括冷冻模板法、气体形成法、相分离法、致孔剂模板法和反相蛋白石支架模板法。
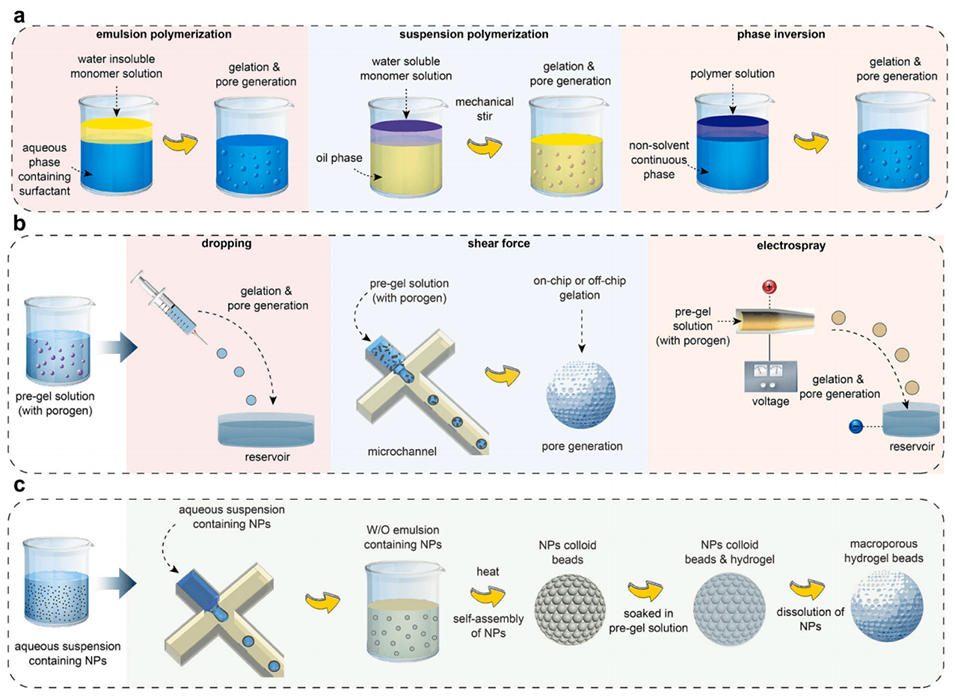
图2.适合后续形成大孔结构的传统水凝胶微粒制备方法示意图。(a)本体聚合。(b)微流控技术。(e)基于纳米颗粒自组装的模板法。

图3.冷冻模板法制备大孔水凝胶微粒。
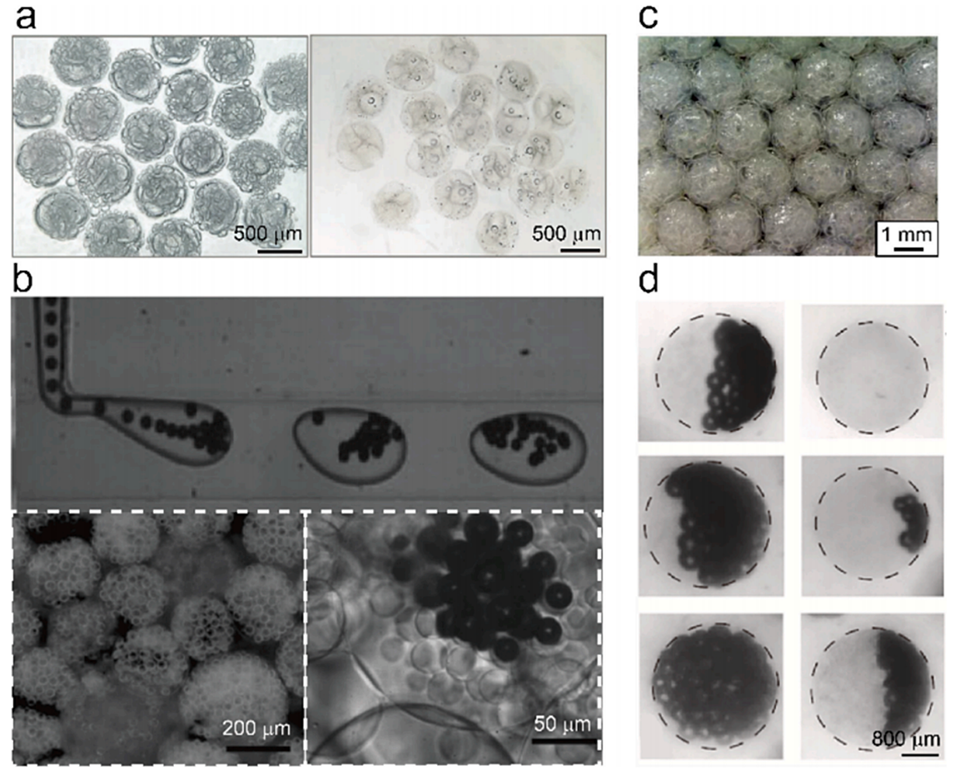
图4.通过气体形成法制备大孔水凝胶微粒。
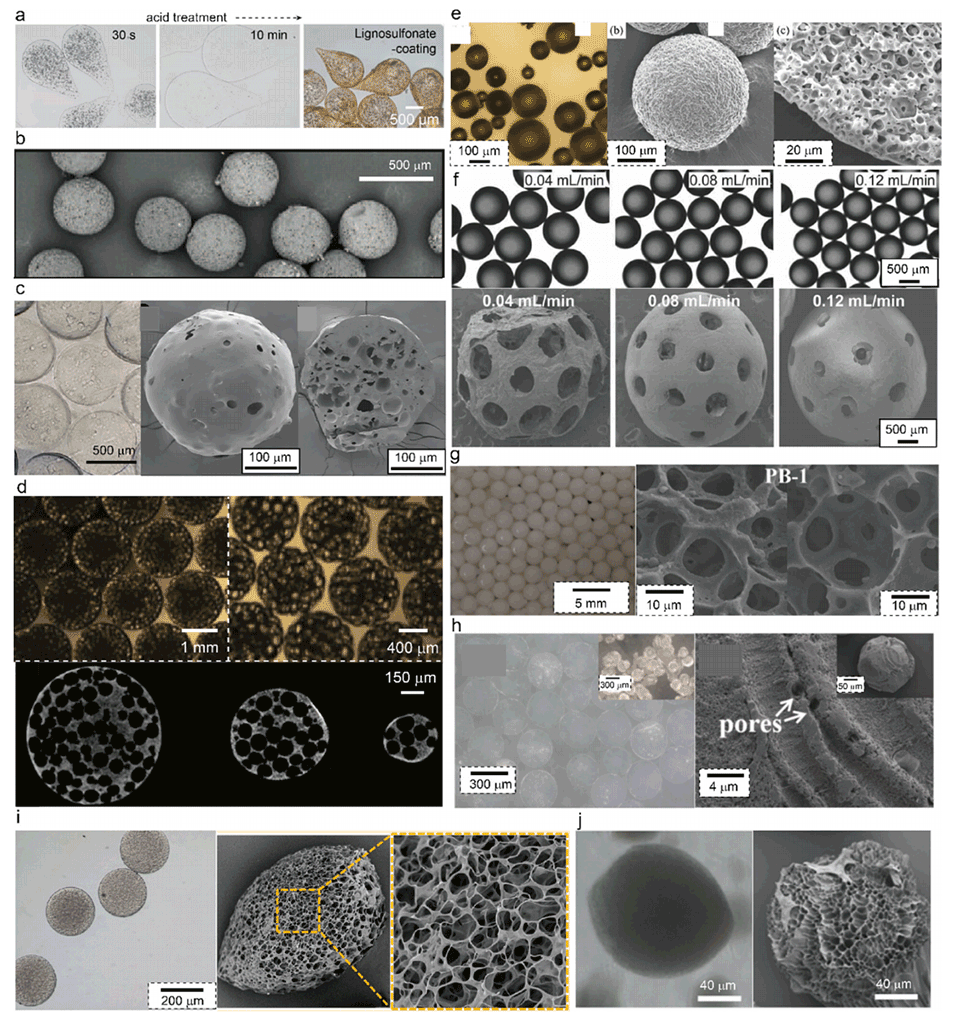
图5.通过致孔剂模板法制备大孔水凝胶微粒。

图6.通过相分离法制备大孔水凝胶微粒。

图7.通过反相蛋白石支架模板法制备大孔水凝胶微粒。
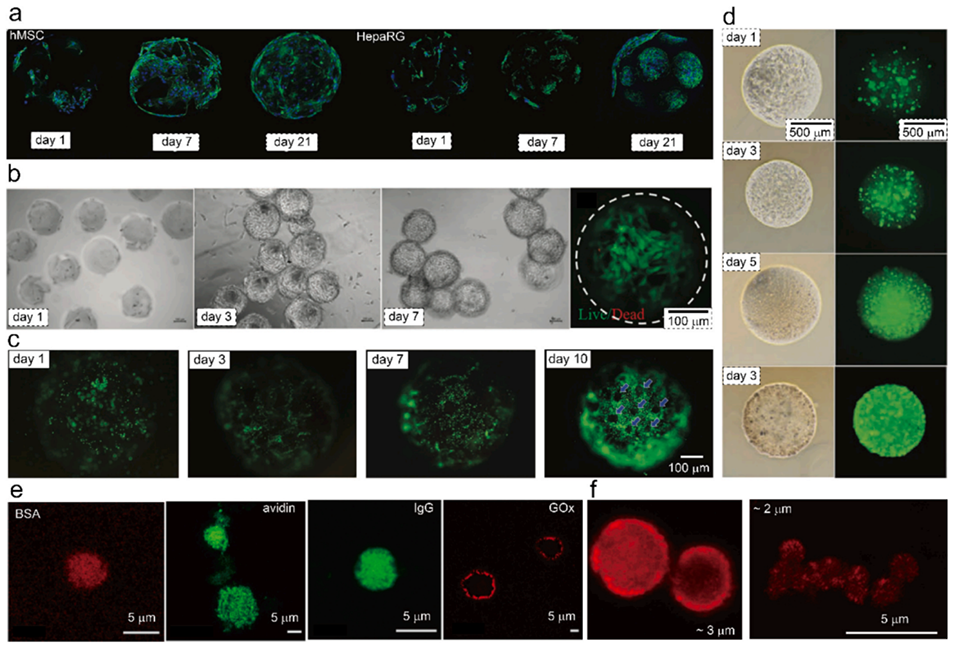
图8.大孔水凝胶微粒用作微载体。
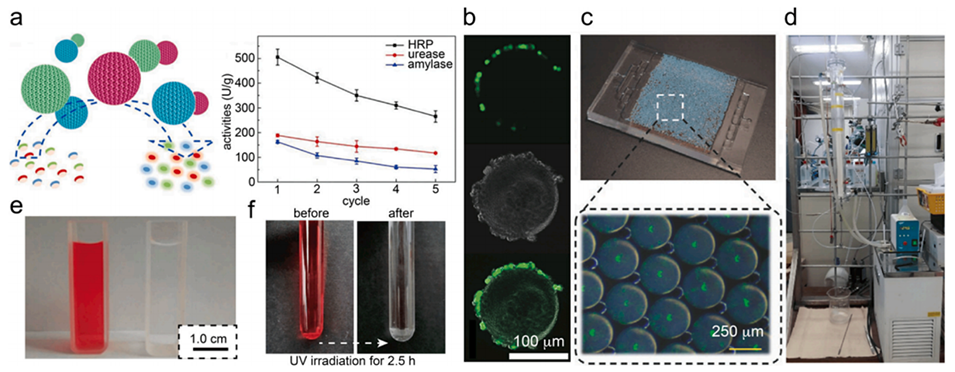
图9.大孔水凝胶微粒用作吸附和捕获材料。
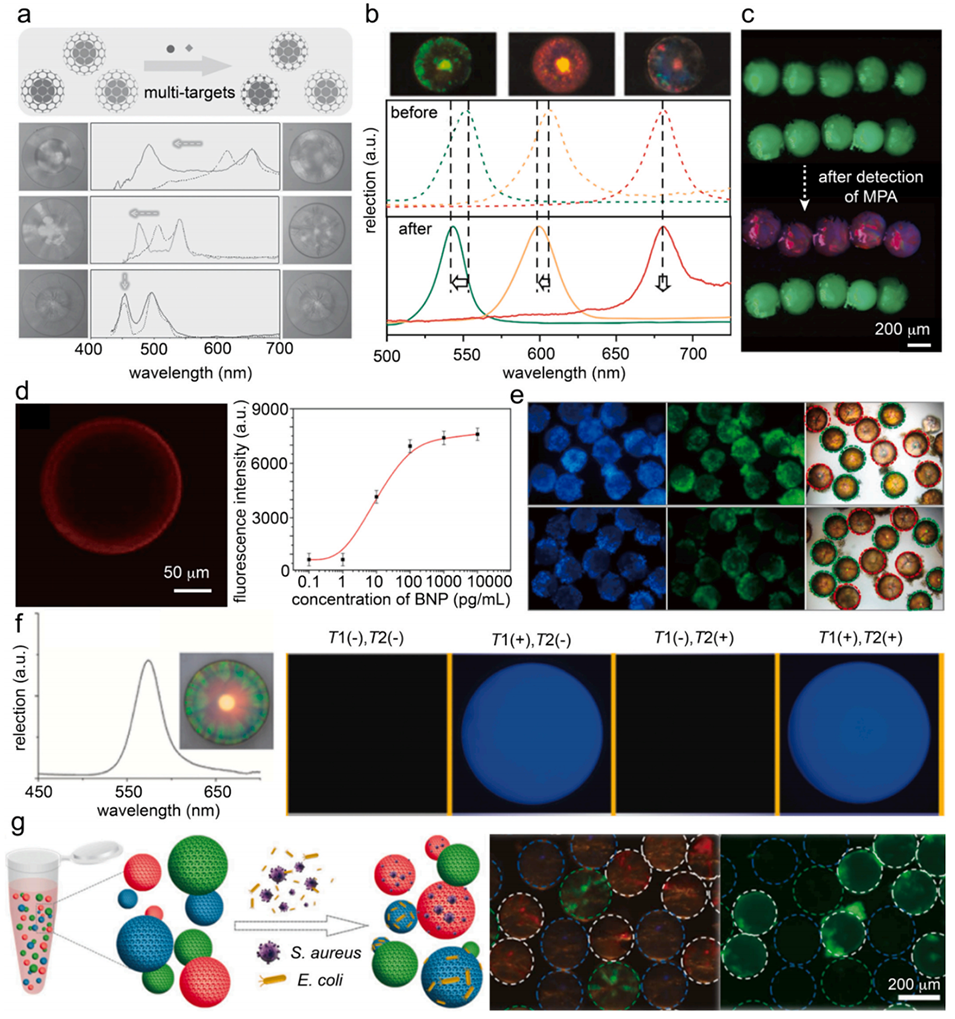
图10.大孔水凝胶微粒用于检测。
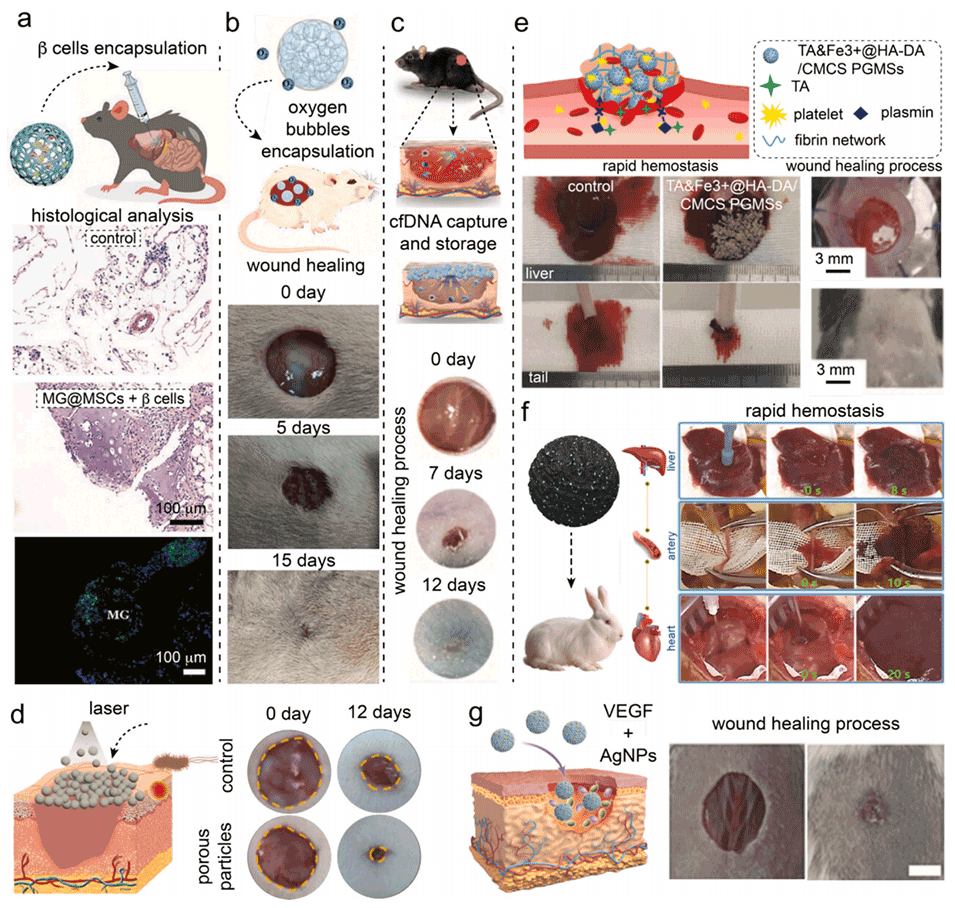
图11.大孔水凝胶微粒用于伤口愈合。
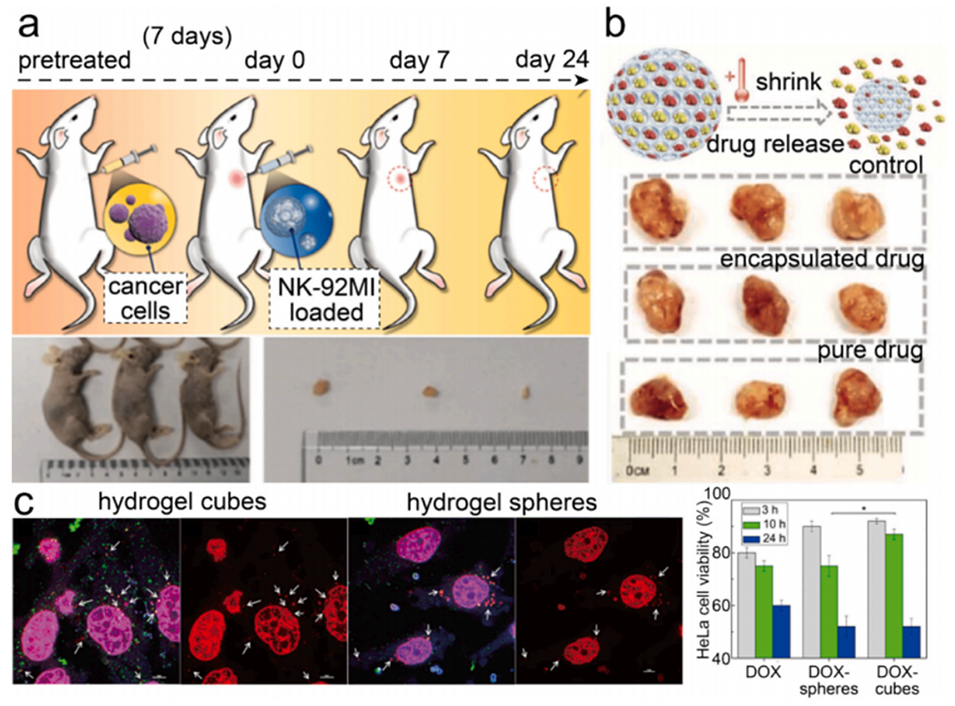
图12.大孔水凝胶微粒用于癌症治疗。

图13.大孔水凝胶微粒用于骨生成。
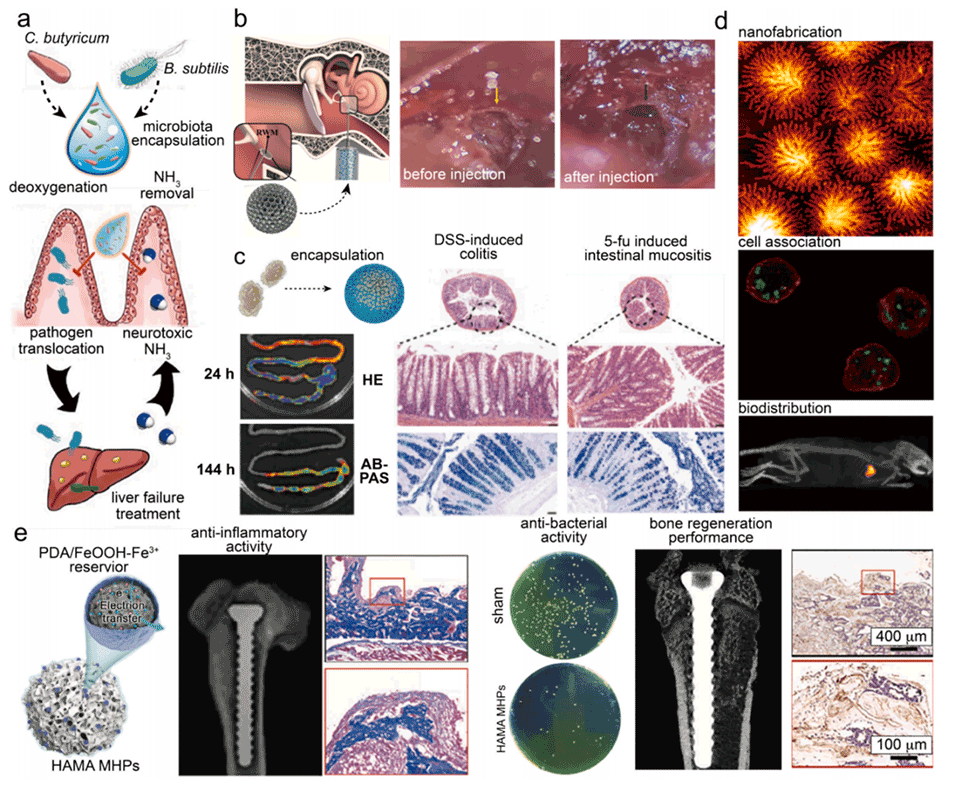
图14.大孔水凝胶微粒用于其他医学应用。
论文链接:https://doi.org/10.1016/j.cej.2025.161435














